Ołów
| nieruchomości | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ogólnie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nazwa , symbol , liczba atomowaatomic | Ołów, Pb, 82 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kategoria elementu | Metale | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupa , kropka , blok | 14 , 6 , godz | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wygląd zewnętrzny | Niebieskawo-biały | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| numer CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numer WE | 231-100-4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Karta informacyjna ECHA | 100.028.273 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ułamek masowy powłoki Ziemi | 18 ppm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomowy | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atomowa | 207,2 (1) u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Promień atomowy (obliczony) | 180 (154) po południu | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Promień kowalencyjny | 146 po południu | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Promień Van der Waalsa | 202 po południu | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Konfiguracja elektronów | [ Xe ] 4 f 14 5 d 10 6 s 2 6 p 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Energia jonizacji | 7th.416 679 9 (6) eV ≈ 715.6 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Energia jonizacji | 15..032 499 (7) eV ≈ 1 450.42 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Energia jonizacji | 31.9373 (6) eV ≈ 3 081.48 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Energia jonizacji | 42.33256 (10) eV ≈ 4 084.47 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Energia jonizacji | 68.8 (5) eV ≈ 6 640 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fizycznie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Stan fizyczny | naprawiony | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Struktura krystaliczna | Sześcienny obszar skupiony | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| gęstość | 11,342 g/cm³ (20 °C ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Twardość Mohsa | 1,5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| magnetyzm | diamagnetyczny ( Χ m = -1,6 10 -5 ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Temperatura topnienia | 600,61 K (327,43 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| temperatura wrzenia | 2017 K (1744 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Objętość molowa | 18,26 10 -6 m 3 mola -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ciepło parowania | 177 kJ mol- 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ciepło stapiania | 4,85 kJ mol- 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Prędkość dźwięku | 1260 m s -1 przy 293,15 K. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Specyficzna pojemność cieplna | 131 J kg -1 K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Przewodność elektryczna | 4,76 · 10 6 A · V −1 · m −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Przewodność cieplna | 35 W m -1 K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mechanicznie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Liczba Poissona | 0,44 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemicznie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Stany utleniania | 2 , 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Potencjał normalny | -0,1251 V (Pb 2+ + 2 e - → Pb) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektroujemność | 2,33 ( skala Paulinga ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Izotopy | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| W przypadku innych izotopów zobacz listę izotopów | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| instrukcje bezpieczeństwa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proces zatwierdzania w ramach REACH | bardzo mocno niepokojący : działa szkodliwie na rozrodczość ( CMR ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dane toksykologiczne |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
W miarę możliwości i zwyczajowo stosowane są jednostki SI . O ile nie zaznaczono inaczej, podane dane dotyczą warunków standardowych . | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ołów jest pierwiastkiem chemicznym o symbolu pierwiastka Pb ( łac. plumbum ) i liczbie atomowej 82. Jest trującym metalem ciężkim i znajduje się w 4. grupie głównej lub 14. grupie IUPAC ( grupa węgla ) i 6. okresie układu okresowego pierwiastków . Ołów jest łatwo kowalny i ma stosunkowo niską temperaturę topnienia.
Do izotopów 206 PB 207 Pb i 208 Pb są najcięższe atomy stabilny, więc prowadzić to element o najwyższej masie i liczbie atomowej , które jest wciąż stabilna. Wszystkie izotopy ołowiu mają magiczną liczbę protonową 82, która powoduje tę stabilność. Przy 208 Pb istnieje nawet tak zwane podwójne magiczne jądro, ponieważ ma ono również magiczną liczbę neutronów 126.
Ponieważ izotopy ołowiu -206, -207 i -208 są produktami końcowymi trzech naturalnych serii rozpadu pierwiastków promieniotwórczych, powstała stosunkowo duża ilość ołowiu; dlatego jest powszechny w skorupie ziemskiej w porównaniu do innych ciężkich pierwiastków ( rtęć , złoto itp.).
fabuła


Najstarsze do tej pory znalezisko metalicznego ołowiu zostało dokonane w Çatalhöyük , około 50 km na południowy wschód od Konyi na płaskowyżu anatolijskim. Składa się z pereł ołowianych wraz z perłami miedzianymi, datowanymi na około 6500 pne.
We wczesnej epoce brązu do produkcji brązów ze stopów z miedzią używano ołowiu obok antymonu i arsenu , dopóki cyna nie stała się powszechnie akceptowana. W Babilończycy byli już zaznajomieni z ołowiu wazony. W Asyryjczykom było importu ołowiu ( abāru ), która dokumentuje Tiglath-Pileser I., między innymi, jako cześć z Melid . W starożytnej Grecji ołów wydobywano głównie w postaci galeny do pozyskiwania srebra. Z kolei w Cesarstwie Rzymskim tkanina była wykorzystywana do różnych zastosowań. Ołów miał szczególne znaczenie np. w architekturze, gdzie bloki kamienia były łączone ze sobą za pomocą ołowianych klipsów. Szacuje się, że do budowy Porta Nigra zużyto około siedmiu ton ołowiu. Innymi ważnymi obszarami zastosowań były okładziny kadłubów statków w celu ochrony przed inwazją szkodników oraz produkcja rur wodociągowych w miastach. Ponadto ołów był wykorzystywany jako surowiec do produkcji naczyń, jako materiał na tablice do pisania czy tzw. tessery , które były wykorzystywane m.in. jako znaki identyfikacyjne lub autoryzacyjne. Niewielkie kawałki ołowiu, tzw. „proce ołowiane”, były używane jako procy w armii rzymskiej . Ze względu na duże zapotrzebowanie ołów sprzedawano również na duże odległości, o czym świadczą m.in. napisy na rzymskich sztabkach ołowianych.
W starożytnej literaturze wierzono, że ołów i cyna to dwa przejawy tej samej substancji, tak więc ołów określano po łacinie jako plumbum nigrum (od niger „czarny” ), a cynę jako plumbum candidum (od candidus „biały” ). Dlatego często nie jest jasne, czy starożytny tekst ołówkiem oznacza ołów czy cynę. Nawet rzymski autor Witruwiusz uważał, że używanie ołowiu w rurach do wody pitnej jest szkodliwe dla zdrowia i zalecał zamiast tego, jeśli to możliwe, używanie rur glinianych. Niemniej jednak rury do wody pitnej wykonane z ołowiu były w użyciu aż do lat 70., co wyraża się również np. w angielskim słowie plumber „pipe laying” . Z dzisiejszego punktu widzenia szczególnie niepokojący był dodatek ołowiu jako słodzika do wina (tzw. „cukier ołowiowy”, patrz octan ołowiu(II) ). Częste stosowanie ołowiu w fajkach i winie było również omawiane jako przyczyna upadku Cesarstwa Rzymskiego , ale obecnie jest to odrzucane w badaniach.
W Westfalii Rzymianie zdobyli przewagę aż do odwrotu po bitwie pod Warusem . Skład izotopów charakterystyczny dla różnych stanowisk wskazuje, że ołów do produkcji rzymskich trumien ołowianych znaleziony w Nadrenii pochodzi z północnego Eifel . Przetwarzanie ołowiu przez Rzymian doprowadziło do zanieczyszczenia środowiska, które do dziś można zweryfikować: rdzenie lodowe z Grenlandii pokazują się między V wiekiem p.n.e. pne i III wiek n.e. wymierny wzrost zawartości ołowiu w atmosferze.
Ołów (od średnio-wysokoniemieckiego blī ) również miał później znaczenie. Wykorzystywano go np. do obramowania okien ze szkła ołowiowego np. w kościołach lub do pokrycia ołowianych dachów . Ołów stał się szczególnie ważny po wynalezieniu broni palnej dla wojska jako materiału na pociski do broni krótkiej. Ponieważ żołnierze wytwarzali własne pociski, nie było niczym niezwykłym, że kradli każdy ołów, jaki mogli znaleźć, aby zrobić z niego pociski.
Ołów odgrywał również ważną rolę w alchemii . Ze względu na swoje podobieństwo do złota (podobnie miękki i ciężki) ołów uznano za dobry materiał wyjściowy do syntezy złota (synteza jako zmiana koloru z szarego na żółty). Alchemiczny symbol ołowiu jest stylizowany sierp (♄), ponieważ został przypisany do Boga i planety Saturn (łac Saturnus ) jako planetarnego metalu od czasów starożytnych .
Wraz z początkiem rewolucji przemysłowej ołów był wówczas potrzebny w dużych ilościach dla przemysłu chemicznego , na przykład do produkcji kwasu siarkowego w procesie komorowym ołowiu lub wykładania instalacji do produkcji materiałów wybuchowych . Był to wówczas najważniejszy metal nieżelazny .
Próbując określić wiek Ziemi poprzez pomiar stosunku ołowiu do uranu w próbkach skał, amerykański geochemik Clair Cameron Patterson odkrył około 1950 r., że wszystkie próbki skał były skażone dużymi ilościami ołowiu z atmosfery. Potrafił zidentyfikować źródło tetraetyloołowiu stosowanego jako środek przeciwstukowy w paliwach . Przed 1923 Patterson odkrył, że atmosfera prawie w ogóle nie zawierała ołowiu. Opierając się na tej wiedzy, całe życie walczył o ograniczenie uwalniania ołowiu do środowiska. Jego wysiłki ostatecznie doprowadziły do powstania w Stanach Zjednoczonych ustawy o czystym powietrzu z 1970 r. , która wprowadziła surowsze przepisy dotyczące emisji. W 1986 roku sprzedaż benzyny ołowiowej w Stanach Zjednoczonych, w Niemczech została wprowadzona ustawa o benzynie ołowiowej stopniowo od 1988 roku, w UE całkowicie zakazana od 2001 roku. W efekcie niemal natychmiast poziom ołowiu we krwi Amerykanów spadł o 80 proc. Jednakże, ponieważ ołów pozostaje praktycznie na zawsze w środowisku, każdy człowiek nadal ma we krwi około 600 razy więcej metalu niż przed rokiem 1923. Około roku 2000 nadal legalnie uwalniano do atmosfery około 100 000 ton. Głównymi trucicielami są górnictwo, przemysł metalowy i produkcja.
W 2009 roku ilość ołowiu pozyskiwanego z metali nieżelaznych była czwarta po aluminium , miedzi i cynku . Stosowany jest głównie do akumulatorów samochodowych (akumulatorów ołowiowych ) (60% całkowitej produkcji).
Generalnie podejmowane są próby zmniejszenia narażenia ludzi i środowiska na ołów, a tym samym zatrucia ołowiem . Oprócz zakazu stosowania benzyny ołowiowej, stosowanie ołowiu w sprzęcie elektrycznym i elektronicznym zostało ograniczone od 2002 r. przez dyrektywy RoHS . W 1989 r. farby i powłoki zawierające ołów zostały całkowicie zakazane, a od 2005 r. w niektórych krajach związkowych częściowo zakazano używania amunicji zawierającej ołów. Ołów został zakazany jako materiał do rur wodociągowych już w 1973 r., ale nadal nie ma przepisów dotyczących usuwania rur ołowianych z istniejących nieruchomości, dlatego Niemiecka Rada Federalna zażądała zakazu stosowania rur do wody pitnej zawierających ołów w 2017 r. Od 1 marca 2018 r. użytkowanie (przechowywanie, mieszanie, wykorzystanie do produkcji itp.) i wprowadzanie do obrotu ołowiu - stałego (np. w postaci sztabek lub peletów) lub proszku - jest podobne do wielu związków ołowiu w Unia Europejska od dawna Z kilkoma wyjątkami, jest regularnie zabroniony, jeśli jest przeznaczony do powszechnej sprzedaży, a stężenie ołowiu w nim wynosi 0,3% lub więcej; Ponadto dostawca musi zapewnić, że jest to oznaczone jako „tylko dla użytkowników komercyjnych” przed wprowadzeniem go do obrotu.
Zdarzyć
Ołów występuje w skorupie ziemskiej w ilości około 0,0018% i rzadko występuje w postaci stałej , czyli pierwiastkowej. Niemniej jednak, na całym świecie jest obecnie znanych około 200 miejsc na stały ołów (stan na 2017 r.), na przykład w Argentynie , Etiopii , Australii , Belgii , Brazylii , Chińskiej Republice Ludowej , Niemczech , Finlandii , Francji , Gruzji , Grecji , Grenlandii , Włoszech , Kanada , Kazachstan , Kirgistan , Meksyk , Mongolia , Namibia , Norwegia , Austria , Polska , Rosja , Szwecja , Słowenia , Czechy , Ukraina , Wyspy Dziewicze Stanów Zjednoczonych , Wielka Brytania i Stany Zjednoczone Ameryki (USA).
Ołów można również znaleźć w próbkach skał grzbietu środkowoatlantyckiego , a dokładniej na północno-wschodnim krańcu „Głębi Markowa” w „strefie pęknięcia Sierra Leone” (próg Sierra Leone), a także poza Ziemią na Księżycu w Mare Fecunditatis .
W każdej lokalizacji skład izotopowy nieznacznie odbiega od wartości średnich podanych powyżej, dzięki czemu dokładna analiza składu izotopowego może posłużyć do określenia lokalizacji oraz, w przypadku znalezisk archeologicznych, do wyciągnięcia wniosków na temat dawnych szlaków handlowych . Ponadto w zależności od miejsca występowania ołów może również zawierać różne dodatki obce takie jak srebro, miedź, cynk, żelazo, cyna i/lub antymon.
W rudach ołowiu ołów występuje głównie w postaci galeny (siarczek ołowiu PbS, połysk ołowiu ). Minerał ten jest również głównym komercyjnym źródłem wydobycia nowego ołowiu. Kolejnymi minerałami ołowiu są cerusyt ( węglan ołowiu (II), PbCO 3 , również ruda ołowiu białego ), krokoit (chromian ołowiu (II), PbCrO 4 , również ruda ołowiu czerwonego ) oraz anglezyt (siarczan ołowiu (II), PbSO 4 , również azotek ołowiu ). Prowadzić minerałów o najwyższej zawartości ołowiu w związku są lithargite i massicotite (do 92,8%) i Minia (do poziomu 90,67%). Do chwili obecnej znanych jest łącznie 514 minerałów ołowiu (stan na 2017 r.).
Zasoby nadające się do wydobycia gospodarczego szacuje się na 67 mln ton na całym świecie (stan na 2004 r.). Największe złoża znajdują się w Chińskiej Republice Ludowej , USA , Australii , Rosji i Kanadzie . W Europie Szwecja i Polska to kraje o największych złożach.
Również w Niemczech, w północnym Eifel (Rescheid / Gruben Wohlfahrt i Schwalenbach; Mechernich / Grube Günnersdorf, a także górnictwo odkrywkowe / Virginia; Bleialf ), w Schwarzwaldzie, w Harz (Goslar / Rammelsberg ), w Saksonii ( Freiberg / Muldenhütten ), w dolnym Lahn ( Bad Ems , Holzappel ) oraz w Westfalii ( Ramsbeck / Sauerland ) w przeszłości wydobywano, przetapiano i rafinowano rudę ołowiu.
Obecnie najważniejszym źródłem ołowiu jest recykling starych produktów ołowianych. W związku z tym, istnieją tylko dwa podstawowe hut w Niemczech, które produkują z rudy ołowiu The Binsfeldhammer prowadzą huty w Stolberg (Rhld.) I Metaleurop w Nordenham w pobliżu Bremerhaven . Wszystkie inne huty wytwarzają tak zwany ołów wtórny poprzez przetwarzanie starego ołowiu (zwłaszcza ze zużytych akumulatorów samochodowych ).
Ołów jako minerał
Naturalne występowanie ołowiu w jego elementarnej postaci znane było jeszcze przed założeniem Międzynarodowego Stowarzyszenia Mineralogicznego (IMA). Rudy żelaza manganu bogate depozyt Långban Szwecja podano w przypuszczalnej miejsca lokalizacji , gdzie masowe masy do 50 kg lub 60 kg, mówi się, że nie znaleziono. Ołów jest zatem uznawany za tak zwany minerał praojczysty jako niezależny rodzaj minerału.
Według systematyki minerałów według Strunza (wydanie IX) ołów wymieniony jest pod numerem systemu 1.AA.05 (pierwiastki - metale i związki międzymetaliczne - rodzina miedzi cupalitów - grupa miedziowa) lub w nieaktualnym wydaniu 8 pod I/ A.03 ( grupa cynowo-ołowiowa ) sklasyfikowane. Systematyka minerałów według Dany , stosowana głównie w krajach anglojęzycznych , wymienia pierwiastek mineralny w systemie nr. 01.01.2004 ( grupa złota ).
W naturze ołów stały występuje głównie w postaci arkuszy i płyt o wymiarach centymetrów, a także kruszyw ziarnistych, dendrytycznych, włosowatych lub drucianych . Bardzo rzadko spotykane są również kryształy ołowiu oktaedrycznego , pokrojonego w kostkę i dwunastościennego , które zazwyczaj są drobne, ale czasami osiągają wielkość od 4 cm do 6 cm.
Państwa z największymi funduszami
| ranga | kraj | Stawki dostaw (w 1000 t ) |
ranga | kraj | Stawki dostaw (w 1000 t) |
|---|---|---|---|---|---|
| 1 |
|
950 | 11 |
|
33,9 |
| 2 |
|
642 | 12. |
|
33 |
| 3 |
|
445 | 13th |
|
31,3 |
| 4. |
|
306,2 | 14. |
|
24 |
| 5 |
|
118,5 | 15. |
|
22. |
| 6. |
|
76,7 | 16 |
|
20. |
| 7th |
|
65,9 | 17. |
|
19. |
| ósmy |
|
39,8 | 18. |
|
18,7 |
| 9 |
|
38 | 19. |
|
15. |
| 10 |
|
37,5 | 20. |
|
14,7 |
Najważniejszymi na świecie krajami produkującymi rudę ołowiu w 2004 r. były Chińska Republika Ludowa (950.000 ton), Australia (642.000 ton) i USA (445.000 ton), które łącznie odpowiadały za około dwie trzecie z 3,1 miliona ton wydobytych na całym świecie. Irlandia, Szwecja i Polska to najwięksi wiodący producenci w Europie.
Najważniejszymi producentami ołowiu rafinowanego ( hutniczego miękkiego ołowiu o czystości 99,9%) są Chińska Republika Ludowa (1,8 mln ton), USA (1,2 mln ton) i Niemcy (403 000 ton), które razem stanowią około połowę 6,7 miliona ton wyprodukowanych na całym świecie. Innymi znaczącymi producentami ołowiu rafinowanego w Europie są Wielka Brytania, Włochy, Francja i Hiszpania.
Światowe zużycie i produkcja ołowiu wzrosły z około 7 mln ton do około 11 mln ton w latach 2013-2016.
Ekstrakcja i prezentacja
Zdecydowanie najważniejszym minerałem ołowiu jest galena . Dzieje się tak często w połączeniu z siarczkami innych metali (miedzi, bizmutu, cynku, arsenu, antymonu itp.), które naturalnie zawierają do 5% zanieczyszczeń w surowym ołowiu.
Ruda, która została przetworzona do zawartości minerałów do 60% poprzez kruszenie, klasyfikację i flotację , jest przetwarzana na ołów metaliczny w trzech różnych procesach przemysłowych. Procesy redukcji prażenia i reakcja prażenia coraz częściej ustępują miejsca i są zastępowane procesami bezpośredniego topienia, które z jednej strony mogą być bardziej ekonomiczne, az drugiej bardziej przyjazne dla środowiska.
Redukcja pieczeni
Proces ten przebiega w dwóch etapach, prażenia i redukcji . Podczas prażenia drobno zmielony siarczek ołowiu umieszcza się na ruchomym ruszcie i przetłacza przez niego powietrze o temperaturze 1000°C. Reaguje z tlenem z powietrza w reakcji egzotermicznej, tworząc tlenek ołowiu (II) (PbO) i dwutlenek siarki . Jest on usuwany przez gazy prażenia i może być wykorzystany do produkcji kwasu siarkowego . W tych warunkach tlenek ołowiu jest płynny i spływa w dół. Można go tam spiekać .
- (Pieczenie)
Tlenek ołowiu jest następnie redukowany do ołowiu metalicznego za pomocą koksu . Odbywa się to w piecu szybowym podobnym do tego stosowanego w procesie wielkopiecowym . Dodawane są kruszywa tworzące żużel, takie jak wapno .
- (praca redukcyjna)
Pieczenie reakcji pracy
Proces ten jest stosowany głównie w przypadku rud ołowiu, które są wysoko wzbogacone w PbS i umożliwiają generowanie ołowiu w jednym kroku. Ruda siarczkowa jest tylko niecałkowicie prażona. Mieszanina siarczku ołowiu / tlenku ołowiu jest następnie dalej ogrzewana bez dostępu powietrza. Tlenek ołowiu reaguje z pozostałym PbS, tworząc ołów i dwutlenek siarki bez dodawania dalszego środka redukującego:
- (Pieczenie),
- (Praca w reakcji).
Bezpośredni proces topienia
Nowoczesne procesy wytwarzania ołowiu oparte są na procesach bezpośredniego wytapiania, które zostały zoptymalizowane pod kątem zgodności środowiskowej i efektywności ekonomicznej (np. proces QSL ). Korzystne jest ciągłe zarządzanie procesem z ograniczeniem do jednej komory reakcyjnej, która jest jedynym emiterem zanieczyszczeń – w porównaniu z tym klasyczne procesy produkcyjne mają spiekanie jako dodatkowy etap emisji. Prażenie i rozdrabnianie odbywają się równolegle w jednym reaktorze. Podobnie jak w procesie reakcji prażenia, siarczek ołowiu nie jest całkowicie prażony. Część ołowiu powstaje zatem w reakcji siarczku ołowiu z tlenkiem ołowiu. Ponieważ reaktor jest lekko nachylony, spływa żużel zawierający ołów i tlenek ołowiu . Przechodzi on przez strefę redukcji, do której wdmuchiwany jest pył węglowy, a tlenek ołowiu jest redukowany do ołowiu. Podczas pieczenia zamiast powietrza stosuje się czysty tlen . To znacznie zmniejsza ilość spalin, które z drugiej strony mają wyższe stężenie dwutlenku siarki niż w procesach konwencjonalnych. Ich zastosowanie do produkcji kwasu siarkowego jest zatem prostsze i bardziej ekonomiczne.
Rafinacja
Powstały ołów zawiera 2-5% innych metali, w tym miedź , srebro , złoto , cynę , antymon , arsen i bizmut w różnych proporcjach. Oczyszczanie i wprowadzanie do obrotu niektórych z tych produktów ubocznych, w szczególności srebra zawartego do 1% ołowiu, znacząco wpływa na opłacalność wydobycia ołowiu.
Rafinacja pirometaliczna ołowiu jest procesem wieloetapowym. W wyniku topienia w obecności azotanu sodu/węglanu sodu lub powietrza antymon, cyna i arsen ulegają utlenieniu i mogą zostać usunięte z powierzchni stopionego metalu w postaci antymonianów, cynianów i arsenianów ołowiu („rozmaz antymonu”). Miedź i wszelki cynk, nikiel i kobalt, które może zawierać, są usuwane z surowego metalu poprzez segregację ołowiu. Zawartość siarki również znacznie spada. Zgodnie z procesem Parkesa srebro osadza się z ołowiu („Parkesyzacja”) poprzez dodanie cynku i segregację tworzących się mieszanych kryształów Zn-Ag , podczas gdy znaczenie starszego procesu Pattinsona znacznie spadło ( patrz także produkcja srebrny, spójrz srebrny ). Zgodnie z procesem Krolla-Bettertona bizmut można usuwać z powierzchni stopionego ołowiu jako piankę bizmutową przez dodanie go do stopu z wapniem i magnezem .
Dalsze czyszczenie można przeprowadzić przez rafinację elektrolityczną, ale proces ten jest bardziej kosztowny ze względu na wysokie wymagania energetyczne. Ołów jest pierwiastkiem bazowym, który w szeregu elektrochemicznym ma bardziej ujemny potencjał standardowy niż wodór. Ma to jednak wysokie przepięcie na elektrodach ołowiowych , dzięki czemu możliwe jest elektrolityczne osadzanie metalicznego ołowiu z roztworów wodnych, patrz rafinacja elektrolityczna ołowiu .
Rafinacji ołowiu pojawieniu się na rynku w postaci miękkich, ołowiu lub znormalizowanych wytapiania ołowiu z 99,9 do 99,97% czystości (np Eschweilera Raffiné ) lub drobne ołowiu z 99,985 do 99,99% ołowiu (DIN 1719, nieaktualne). W zależności od przeznaczenia, oznaczenia takie jak prowadzenie kabla są również wspólne dla stopu zawierającego ok. 0,04% miedzi. Obecne normy, takie jak DIN EN 12659, nie uwzględniają już tych terminów, które nadal są w użyciu.
nieruchomości
Właściwości fizyczne
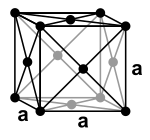
Ołów jest metalem nieszlachetnym o standardowym potencjale elektrody około -0,13 V. Jest jednak bardziej szlachetny niż wiele innych powszechnych metali, takich jak żelazo, cynk czy aluminium. Jest to diamagnetyczny metal ciężki o gęstości 11,3 g/cm³, który krystalizuje w sposób sześcienny skoncentrowany na ścianie, a zatem ma sześcienne najbliższe upakowanie sfer z grupą przestrzenną Fm 3 m (grupa kosmiczna nr 225) . Parametr sieci krystalicznej dla czystego ołowiu 0,4950 nm (odpowiada 4,95 nm ) z 4 jednostek wzoru na jednostkową komórkę .
Jest to podstawa wyraźnej ciągliwości metalu i niskiej twardości w skali Mohsa wynoszącej 1,5. Dzięki temu można go łatwo zwijać w blachę lub formować w druty, które jednak nie są zbyt wytrzymałe ze względu na niską twardość. Diamentopodobny modyfikacji, jak to jest znane z lżejszych homologów z grupy 14, nie występuje z ołowiu. Wynika to z relatywistycznej niestabilności wiązania Pb-Pb i niskiej tendencji do pojawiania się czterowartościowego.
Świeże próbki ołowiu mają kolor od szaro-białego do metalicznie białego i wykazują typowy metaliczny połysk , który jednak bardzo szybko zanika w wyniku powierzchownego utleniania. Kolor zmienia się na ciemnoszary i staje się matowy. Miękki metal pozostawia na papierze (ołowiową) szarą linię . Z tego powodu ludzie pisali i malowali ołowiem. Nazwa „ ołówek ” jest używana do dziś, choć grafit jest w niej używany od dawna .
Temperatura topnienia ołowiu wynosi 327 ° C, jego temperatura wrzenia 1740–1751 ° C (wartości w literaturze technicznej różnią się: 1740 ° C, 1746 ° C, 1751 ° C). Jako typowy metal, ołów przewodzi zarówno ciepło, jak i elektryczność , ale jest to znacznie gorzej niż inne metale (por. przewodność elektryczna ołowiu: 4,8· 106 S/m, srebro: 62· 106 S/m). Poniżej 7,196 K ołów nie wykazuje oporu elektrycznego , staje się nadprzewodnikiem typu I. Prędkość dźwięku w ołowiu wynosi około 1200 m/s, w literaturze wartości nieco się różnią, prawdopodobnie ze względu na różnice w czystości lub przetwarzaniu.
Właściwości chemiczne
W powietrzu ołów jest pasywowany przez tworzenie warstwy tlenku ołowiu i tym samym jest chroniony przed dalszym utlenianiem . Dlatego świeże kawałki mają początkowo metaliczny połysk, ale szybko matowieją, tworząc matową powierzchnię. W stanie drobno rozdrobnionym ołów jest wysoce łatwopalny ( ołów piroforyczny ).
Ze względu na pasywację ołów jest również nierozpuszczalny w różnych kwasach. Ołów jest odporny na kwas siarkowy , kwas fluorowodorowy i kwas solny , ponieważ nierozpuszczalne sole ołowiu tworzą się z anionami odpowiedniego kwasu. Dlatego ołów ma pewne znaczenie w inżynierii aparatury chemicznej do specjalnych zastosowań.
Ołów natomiast rozpuszcza się w kwasie azotowym ( azotan ołowiu (II) jest rozpuszczalny w wodzie), gorącym, stężonym kwasie siarkowym (tworzenie rozpuszczalnego kompleksu Pb (HSO 4 ) 2 ), kwasie octowym (tylko przy dostępie powietrza ) i gorące zasady .
Metaliczny ołów jest stabilny w wodzie niezawierającej tlenu. Jednak w obecności tlenu rozpuszcza się powoli, tak że rury z wodą pitną zawierające ołów mogą stanowić zagrożenie dla zdrowia. Jeśli natomiast woda zawiera dużo jonów wodorowęglanowych i siarczanowych , co zwykle wiąże się z dużą twardością wody , po pewnym czasie utworzy się warstwa zasadowego węglanu ołowiu i siarczanu ołowiu . Chroni to wodę przed ołowiem, ale nawet wtedy część ołowiu z rur będzie migrować do wody.
Izotopy
Naturalnie występujące ołów składa się przeciętnie około 52,4% izotopu 208 Pb, około 24,1% 206 Pb, około 22,1% 207 Pb, do około 1,4% 204 Pb. Skład różni się nieco w zależności od złoża, dzięki czemu pochodzenie ołowiu można określić analizując skład izotopowy. Jest to ważne w przypadku znalezisk historycznych wykonanych z ołowiu oraz ustaleń z wcześniejszych stosunków handlowych.
Pierwsze trzy wymienione izotopy są stabilne. Przy 204 Pb jest pierwotnym radionuklidem . Rozpada się na 200 Hg z emisją promieniowania alfa o okresie półtrwania 1,4 · 10 17 lat (140 biliardów lat) . 208 Pb ma podwójnie magiczny rdzeń ; jest to najcięższy stabilny nuklid. (Bardziej poważny długo stabilny odbywa 209 Bi jest niestabilny, według ostatnich pomiarów i zaników z okresem półtrwania (1,9 ± 0,2) x 10 19 lat (19 trylionów lat) z emisją alfa cząstek w 205 Tl istoty Bardzo wolny rozpad wynika z faktu, że przy Z = 83 ma tylko o jeden proton więcej niż magiczna liczba protonów 82 i magiczna liczba neutronów 126, czyli jest bardzo podobna do podwójnego magicznego rdzenia ołowianego z 208 nukleonami).
Stabilne izotopy naturalnie występującego ołowiu są końcowymi produktami szeregu rozpadu uranu i toru: 206 Pb jest końcowym nuklidem szeregu uranowo-radowego rozpoczynającym się od 238 U , 207 Pb jest końcem szeregu uranowo-aktynowego rozpoczynającym się od 235 U i 208 Pb koniec serii toru rozpoczynający się odpowiednio od 244 Pu i 232 Th . Ta seria rozpadów powoduje, że stosunek izotopów ołowiu w próbce nie jest stały w czasie, jeśli wykluczona jest wymiana materiału z otoczeniem. Można to wykorzystać do określenia wieku metodą uranowo-ołowiową lub torowo-ołowiową, która ze względu na długi okres półtrwania izotopów uranu i toru, w przeciwieństwie do metody radiowęglowej , jest szczególnie odpowiednia do datowania próbek, które są miliony lat. Ponadto efekt ten prowadzi do zróżnicowanych sygnatur izotopowych w ołowiu z różnych złóż, które można wykorzystać jako dowód pochodzenia.
Ponadto istnieje 33 nietrwałe izotopy i 13 niestabilnych izomerów z 178 Pb do 215 PB, które albo sztucznie lub występują w szeregu rozpadu w uranu i toru , takie jak 210 Pb w serii uranu radu. Najdłużej żyjącym izotopem z nich jest 205 Pb z okresem półtrwania 153 mln lat.
posługiwać się
Największymi konsumentami ołowiu są USA, Japonia, Niemcy i Chińska Republika Ludowa. Konsumpcja jest silnie uzależniona od cyklu koniunkturalnego w branży motoryzacyjnej, w której akumulatory wykorzystywane jest około 60% światowego zapotrzebowania na ołów. Kolejne 20% jest przetwarzane w przemyśle chemicznym.
Ekranowanie przed promieniowaniem

Ze względu na dużą masę atomową ołów w wystarczająco grubych warstwach lub blokach nadaje się do ekranowania przed promieniowaniem gamma i rentgenowskim ; to pochłania promieniowanie rentgenowskie i promieniowanie gamma, bardzo efektywnie. W tym celu ołów jest tańszy i łatwiejszy w obróbce, np. w postaci miękkiej blachy, niż nawet „cięższe atomowo”, gęstsze metale. Dlatego jest powszechnie stosowany do ekranowania w ochronie przed promieniowaniem (np. medycyna nuklearna , radiologia , radioterapia ) . Jednym z przykładów jest fartuch ołowiany, który lekarze i pacjenci noszą podczas robienia zdjęć rentgenowskich. Szkło ołowiowe jest również używane do ochrony przed promieniowaniem.
W sektorze szpitalnym specyfikacja techniczna dla obiektów konstrukcyjnych pełniących funkcję ekranującą, takich jak ściany, drzwi i okna, jest ekwiwalentem grubości ołowiu i jest często pisana w celu umożliwienia obliczenia skuteczności ochrony przed promieniowaniem i narażenia na promieniowanie.
Ołów jest zatem z. B. stosowany również do siatek przeciwrozproszeniowych .
Specjalnym zastosowaniem jest ekranowanie spektrometrów gamma do precyzyjnej dozymetrii, do czego wymagany jest ołów o możliwie najniższej radioaktywności. Naturalna zawartość radioaktywnego 210 Pb działa destrukcyjnie. Im dłuższa data wytopu, tym niższa, ponieważ podczas wytapiania od ołowiu oddzielane są macierzyste nuklidy z szeregu uranowo-radowego (towarzyszy w rudzie). 210 Pb rozpada dlatego od czasu wytopu na swoją półtrwania 22,3 lat bez nowych replik. Dlatego istnieje duże zapotrzebowanie na historyczne przedmioty ołowiane, takie jak obciążniki z zatopionych statków czy historyczne kule armatnie do wydobywania niskopromieniującego ołowiu do produkcji takich osłon. Istnieją również inne instytucje badawcze, które z podobnych powodów potrzebują tego starego tropu.
metal
Ołów jest używany głównie jako metal lub stop . W przeciwieństwie do wcześniejszych czasów, kiedy ołów był jednym z najważniejszych i najszerzej stosowanych metali, obecnie podejmowane są próby zastąpienia ołowiu innymi, nietoksycznymi pierwiastkami lub stopami. Ze względu na swoje ważne właściwości, zwłaszcza odporność na korozję i wysoką gęstość, a także łatwość wytwarzania i przetwarzania, ma nadal duże znaczenie w przemyśle. Na przykład pierwiastki o podobnej lub nawet większej gęstości są albo bardziej problematyczne ( rtęć , uran ), albo bardzo rzadkie i drogie ( wolfram , złoto , platyna ).
Inżynieria elektryczna
Większość ołowiu jest obecnie wykorzystywana do magazynowania energii chemicznej w postaci akumulatorów kwasowo-ołowiowych (np. do samochodów). Akumulator samochodowy zawiera ołów i elektrodę tlenkową ołowiu (IV) oraz rozcieńczony kwas siarkowy (37%) jako elektrolit. Nierozpuszczalny siarczan ołowiu(II) powstaje w kwasie siarkowym z jonów Pb 2+ powstających w reakcji elektrochemicznej . Doładowanie jest możliwe poprzez odwrotną reakcję siarczanu ołowiu (II) na ołów i tlenek ołowiu (IV). Zaletą głównej akumulatora jest wysokie napięcie znamionowe do akumulatora ogniwa 2,06 V .
Inżynieria mechaniczna
Ponieważ ołów ma dużą gęstość, jest używany jako waga. Potocznie jest więc określenie „ołowiane ciężkie” dla rzeczy bardzo ciężkich. Ciężarki ołowiane były wykorzystywane m.in. jako przeciwwagi do wyważania kół samochodowych. Jest to jednak zabronione od 1 lipca 2003 r. dla nowych samochodów i od 1 lipca 2005 r. dla wszystkich samochodów (do 3,5 t); ołowiane odważniki zostały zastąpione odważnikami cynkowymi lub miedzianymi. Inne zastosowania wykorzystujące wysoką gęstość to: ołowiane łańcuchy do naciągania zasłon i obciążniki nurkowe kompensujące wyporność nurka i sprzętu podczas nurkowania. Ponadto ołów jest używany jako tłumik drgań w częściach wrażliwych na wibracje (samochody), do stabilizacji statków oraz do specjalnych zastosowań wygłuszających.
Budowa aparatury
Dzięki pasywacji ołów jest chemicznie bardzo stabilny i m.in. odporny. Kwas siarkowy i brom . Dlatego jest stosowany jako ochrona przed korozją w budowie aparatury i pojemników. Wcześniej ważnym zastosowaniem był proces w komorze ołowiowej do produkcji kwasu siarkowego, ponieważ ołów był wówczas jedynym znanym metalem odpornym na opary kwasu siarkowego. Wcześniejsze zakłady i pomieszczenia do produkcji nitrogliceryny również były wykładane ołowiem na podłodze i ścianie. Ołów był również szeroko stosowany do osłony kabli, aby chronić je przed wpływami środowiska, takimi jak kable telefoniczne. Obecnie ołów stosowany jest głównie w tworzywach sztucznych , m.in. B. PVC został zastąpiony, ale nadal jest używany w kablach w rafineriach, ponieważ jest również niewrażliwy na węglowodory .
Budowa

Ponieważ ołów jest łatwy w obróbce i odlewaniu, ołów był w przeszłości szeroko stosowany w obiektach metalowych. W zestawie najważniejsze produkty ołowiane Rura. Ze względu na toksyczność związków chemicznych, które mogą powstać z ołowiu ( zatrucie ołowiem ), rury ołowiane nie były używane od lat 70-tych. Pomimo uformowania się warstwy węglanu w rurach, ołów nadal rozpuszcza się w wodzie pitnej . Doświadczenie pokazuje, że wartość graniczna obowiązującego rozporządzenia w sprawie wody pitnej nie jest już przestrzegana już po kilku metrach .
Ołów był również używany w budownictwie do łączenia kamieni za pomocą odlewanych metalowych klipsów lub metalowych kołków, na przykład do mocowania zawiasów do kamiennej futryny drzwi lub żelaznej balustrady na kamiennych schodach. Ta ołowiana technika jest nadal szeroko stosowana w renowacji. Czyli na szczycie wieży w katedrze św. Szczepana w Wiedniu czy na moście w Mostarze . Również do ram okiennych, np. B. na oknach średniowiecznych kościołów często używano prętów ołowianych . Ołów (rolowany ołów) jest również używany jako pokrycie dachowe (np. główne kopuły Hagia Sophia ) lub do zamknięć dachowych (np. w słynnych „ ołowianych komnatach ”, dawnym więzieniu w Wenecji i w katedrze w Kolonii) oraz do obramowania otworów dachowych. W przeszłości ołów był również mieszany z farbami i farbami antykorozyjnymi, zwłaszcza w farbach do powierzchni metalowych. Nawet dzisiaj ołów jest zanieczyszczeniem budowlanym, które należy brać pod uwagę w istniejących budynkach , ponieważ nadal można go znaleźć w wielu starszych częściach budynków i zakładów.
Sterowanie pneumatyczne
Od końca XIX wieku specjalnym obszarem zastosowania rur ołowianych były pneumatyczne sterowanie organami ( działanie pneumatyczne ), pneumatyczne pianina artystyczne oraz, jako szczególne i bardzo udane zastosowanie, sterowanie link trainer , pierwsze szeroko rozpowszechnione używany symulator lotu. Decydujące były zalety rur ołowianych (tanie, stabilne, elastyczne, zajmujące mało miejsca na niezbędne obszerne wiązki rur, lutowalne, łatwe w obróbce mechanicznej, trwałe).
Technologia wojskowa
Wojsko było i jest ważnym odbiorcą ołowiu. Ołów jest używany jako surowiec do pocisków, zarówno do proc , jak i do broni palnej. Posiekany ołów został zastrzelony w tzw. grejpfrucie . Powodem zastosowania ołowiu była i jest z jednej strony wysoka gęstość, a co za tym idzie duża siła penetracji, az drugiej łatwa produkcja metodą odlewania. Obecnie ołów jest zwykle zamknięty w płaszczu (stąd „ pocisk płaszczowy ”) wykonanym ze stopu miedzi ( tombak ). Głównymi zaletami są wyższa prędkość pocisku, którą można osiągnąć, przy której nieosłonięty pocisk ołowiany nie może być dalej używany ze względu na jego miękkość, oraz zapobieganie odkładaniu się ołowiu wewnątrz lufy broni palnej. Dostępna jest jednak również amunicja bezołowiowa .
Naprawy karoserii
Przed pojawieniem się nowoczesnych dwuskładnikowych wypełniaczy do wypełniania uszkodzonych i naprawionych miejsc na karoserii pojazdów stosowano ołów lub stopy ołowiu i cyny ze względu na ich niską temperaturę topnienia. W tym celu materiał został przylutowany do uszkodzonego obszaru za pomocą palnika lutowniczego i topnika . Miejsce zostało następnie oszlifowane jak szpachelką. Ma to tę zaletę, że w przeciwieństwie do wypełniacza ołów tworzy trwałe połączenie z blachą i w przypadku wahań temperatury bierze również udział w jej rozszerzaniu liniowym. Ponieważ powstające opary i pyły są trujące, proces ten jest dziś rzadko stosowany, z wyjątkiem renowacji zabytkowych pojazdów.
zwyczaje regionalne
Starym zwyczajem wyroczni , stosowanym już przez Rzymian, jest odlewanie ołowiu , w którym płynny ołów (obecnie również w stopie z cyną) krzepnie w zimnej wodzie. Za pomocą przypadkowych form mają być proroctwa dotyczące przyszłości. Dziś zwyczaj jest nadal praktykowany w Nowy Rok, aby uzyskać (niekoniecznie poważnie) spojrzenie na nadchodzący rok.
Sporty wodne
Podczas nurkowania , ołowiane ciężarki są wykorzystywane do tarowania ; Nadmiar dużej gęstości (dobre 10 g/cm³) w porównaniu z wodą zapewnia zwartą siłę docisku, dzięki czemu nurek może pływać nawet w płytkiej wodzie. Stosunkowo niska cena jest również korzystna w przypadku użycia ołowiu jako masy: W oparciu o światowe ceny metali z lipca 2013 r. ołów ma doskonały stosunek ceny do masy. Wykorzystywane są w postaci płyt na podeszwach opancerzonego skafandra nurkowego, jako zaokrąglone klocki nakręcane na szeroki pas biodrowy lub – współcześnie – jako śrut do strzelby w siatkach w kieszeniach kompensatora pływalności. Otwarcie klamry pasa lub kieszeni (poniżej) umożliwia szybkie zrzucenie balastu w razie potrzeby.
Balast kil z jachtów żaglowych korzystnie z ołowiu. Złom żelaza jest tańszy, ale też mniej gęsty, co nie jest idealne przy dzisiejszych szczupłych kilach. Oprócz gęstości, kolejną zaletą jest to, że ołów nie rdzewieje, a zatem nie ulega degeneracji, nawet jeśli okładzina stępki jest uszkodzona.
Składnik ze stopu
Ołów jest również używany w niektórych ważnych stopach . Dodanie innych metali do stopu zmienia twardość , temperaturę topnienia lub odporność na korozję materiału , w zależności od metalu . Najważniejszym stopem ołowiu jest twardy ołów , stop ołowiowo-antymonowy, który jest znacznie twardszy i dlatego bardziej odporny mechanicznie niż czysty ołów. Ślady niektórych innych pierwiastków (miedzi, arsenu, cyny) w większości zawarte są w twardym ołowiu i również mają decydujący wpływ na twardość i wytrzymałość. Twardy ołów stosuje się na przykład w budowie aparatury, gdzie oprócz odporności chemicznej ważna jest również stabilność.
Innym stopem ołowiu jest metal listowy , stop ołowiu z 60-90% ołowiu, który zawiera również antymon i cynę. Wykorzystywany jest do liter w tradycyjnym druku typograficznym , ale dziś nie odgrywa już roli w masowej produkcji druków, ale co najwyżej w wydaniach bibliofilskich . Ponadto ołów stosowany jest w łożyskach jako tzw. metal łożyskowy .
Ołów pełni rolę składnika stopowego w lutach miękkich , które wykorzystywane są m.in. w elektrotechnice . Oprócz ołowiu cyna jest najważniejszym składnikiem lutów miękkich. Zużycie ołowiu w stopach lutowniczych w 1998 r. wyniosło na całym świecie około 20 000 ton. Dyrektywa UE 2002/95/EG RoHS w dużej mierze zakazuje stosowania ołowiu w technologii lutowania od lipca 2006 roku . Istnieje jednak szereg wyjątków dla zastosowań specjalnych.
Ołów jest powszechnym drobnym składnikiem mosiądzu . Tam zawartość ołowiu (do 3%) pomaga poprawić skrawalność. Również w innych stopach, takich jak B. brąz , ołów może być zawarty jako składnik drugorzędny. Dlatego nie należy pić pierwszej wody, która wypłynie z mosiężnych kształtek po dłuższym odstawieniu, ponieważ część ołowiu została rozpuszczona.
bez ołowiu
Produkty i zastosowania zawierające ołów są albo całkowicie zastępowane (takie jak tetraetyl ołów w benzynie ) lub zawartość ołowiu jest ograniczona przez wartości graniczne do poziomu odpowiadającego zanieczyszczeniu technicznemu (np. cyna i lut ). Produkty te są często nazywane „bezołowiowymi”. Istnieją między innymi wartości graniczne. w przepisach dotyczących tzw. RoHS (Dyrektywa 2011/65/UE), która przewiduje 1000 ppm (0,1%). Wartość graniczna dla opakowań jest bardziej rygorystyczna i wynosi 100 ppm (dyrektywa 94/62/WE).
Polityczna wola zastąpienia ołowiu ma zastosowanie również tam, gdzie jego zastosowanie byłoby interesujące technicznie lub ekonomicznie ze względu na jego właściwości, zagrożenie dla zdrowia byłoby niskie, a recykling byłby możliwy przy rozsądnym wysiłku (np. ołów jako pokrycie dachowe).
Szkło ołowiowe
Ze względu na efekt ekranujący ołów składa się ze stożka lamp katodowych (tj. „tylnej” części lampy) do telewizorów , ekranów komputerowych itp. ze szkła ołowiowego . Przewód absorbuje miękkich X- promienie, które nieuchronnie powstają w lampach katodowych . W tym celu ołów nie może być jeszcze bezpiecznie zastąpiony, dlatego dyrektywa RoHS nie jest tutaj stosowana. Ze względu na ten efekt ekranowania szkło o bardzo wysokiej zawartości ołowiu znajduje również zastosowanie w radiologii i ochronie przed promieniowaniem (np. w szybach okiennych). Ponadto, ze względu na wysoki współczynnik załamania, szkło ołowiowe jest wykorzystywane jako tzw. kryształ ołowiowy do wyrobów szklanych wysokiej jakości .
toksyczność
Pierwiastek ołowiu może być wchłaniany głównie przez płuca w postaci pyłu. W przeciwieństwie do tego ołów jest słabo wchłaniany przez skórę. Dlatego ołów pierwiastkowy w postaci zwartej nie jest toksyczny dla ludzi. Metaliczny ołów tworzy w powietrzu gęstą, słabo rozpuszczalną w wodzie warstwę ochronną z węglanu ołowiu. Rozpuszczone związki ołowiu i pył ołowiu, które mogą dostać się do organizmu poprzez połknięcie lub wdychanie, są toksyczne. Organiczne związki ołowiu są szczególnie toksyczne, m.in. B. Tetraetyloołów , które są silnie lipofilne i szybko wchłaniają się przez skórę.
Inhalacji frakcje ołowiu i nieorganicznych związków ołowiu zostały sklasyfikowane jako rakotwórcze przez Komisję MAK z niemieckiej Fundacji Badań od 2006 roku :
- Arsenian ołowiu i chromian ołowiu w kategorii 1 („Substancje wywołujące raka u ludzi i co do których można założyć, że przyczyniają się do ryzyka zachorowania na raka. Badania epidemiologiczne dostarczają wystarczających dowodów na związek między narażeniem ludzi a występowaniem raka.”),
- Ołów i inne nieorganiczne związki ołowiu z wyjątkiem arsenianu ołowiu i chromianu ołowiu w kategorii 2 („Substancje, które należy uważać za rakotwórcze dla ludzi, ponieważ można założyć, że wystarczające wyniki z długoterminowych doświadczeń na zwierzętach lub wskazania z doświadczeń na zwierzętach i badań epidemiologicznych przyczyniają się do raka ryzyka. ").
Ołów gromadzi się w organizmie nawet wtedy, gdy jego najmniejsze ilości są spożywane przez długi czas. B. przechowywany w kościach i bardzo powoli wydalany. Ołów może powodować przewlekłe zatrucia, które objawiają się bólami głowy, zmęczeniem, wyniszczeniem oraz zaburzeniami ukrwienia, układu nerwowego i mięśni. Zatrucie ołowiem jest szczególnie niebezpieczne dla dzieci i kobiet w ciąży. Może również powodować uszkodzenia owoców i niezdolność do poczęcia. W skrajnych przypadkach zatrucie ołowiem może prowadzić do śmierci. Toksyczność ołowiu polega między innymi na zaburzeniu syntezy hemoglobiny . Hamuje kilka enzymów, a tym samym utrudnia wbudowywanie żelaza do cząsteczki hemoglobiny. To zakłóca dopływ tlenu do komórek ciała.
Szkło ołowiowe i szkliwo ołowiowe nie nadają się do naczyń do jedzenia i picia, ponieważ kwas octowy może rozpuszczać ołów jako rozpuszczalny w wodzie octan ołowiu ze związku krzemianowego. Gdy silniki samochodów nadal pracowały na benzynie z tetraetyloołowiem, roślinność przy drogach iw miastach była zanieczyszczona ołowiem w postaci pyłu tlenkowego. Szorstkie i wgłębione powierzchnie, takie jak wgłębienie wokół łodygi jabłka, są pułapkami na kurz.
Zanieczyszczenie środowiska ołowiem
powietrze
Zanieczyszczenie powietrza ołowiem jest spowodowane głównie pyłami zawierającymi ołów : głównymi źródłami są przemysł ołowiu, spalanie węgla, a do niedawna głównie ruch samochodowy ze względu na spalanie paliw ołowiowych w silnikach samochodowych - chlorowcowane węglowodory dodawane do benzyny wynikało z reakcji z dodatkową czteroetylku ołowiu, w uzupełnieniu do mniejszych ilości ołowiu (II) i ołowiu (II), bromek , zwłaszcza ołów i ołowiu (II), tlenek . W wyniku zakazu stosowania paliw ołowiowych, związane z tym zanieczyszczenie powietrza znacznie się zmniejszyło w ostatnich latach.
Narażenie na ołów z pyłu ołowiu jest obecnie najwyższe w pracy w firmach produkujących i przetwarzających ołów. Stara studnia w czyszczeniu i usuwaniu czerwonego ołowiu -Anstriche poprzez piaskowanie tworzy pył ołowiowy. Pyły tlenku ołowiu powstające podczas rafinacji ołowiu i spalania węgla można by zredukować stosując odpowiednie filtry. Innym mało znaczącym pod względem ilości źródłem jest spalanie odpadów komunalnych w spalarniach odpadów .
Strzelcy sportowi i inni narażeni są na znaczne obciążenia od metali (ciężkich) zawartych w lufie lub zapalniku , w tym ołowiu oprócz antymonu , miedzi i rtęci ; Środki ostrożności można podjąć, uruchamiając odpowiednie systemy ssące na strzelnicach i używając amunicji bezołowiowej .
podłoga
Podłogi mogą być również zanieczyszczone ołowiem. Średnia zawartość ołowiu w skorupie kontynentalnej wynosi 15 mg/kg. Gleby naturalnie zawierają od 2 do 60 mg/kg ołowiu; jeśli powstają ze skał zawierających rudę ołowiu, ich zawartość może być znacznie wyższa. Większość zanieczyszczeń gleb ołowiem ma charakter antropogeniczny , źródła tego są zróżnicowane. Większa część wnikania odbywa się przez ołowiany pył z powietrza, który dostaje się do gleby wraz z deszczem lub przez suche osadzanie. Dla Niemiec i roku 2000 wpływ atmosferyczny do gleby oszacowano na 571 t ołowiu/rok. Innym źródłem jest obciążony nawóz , zarówno nawozy mineralne (136 t Pb/rok), w szczególności azotany , jak i obornik (182 t Pb/rok). Osad ściekowy (90 t Pb/a) i kompost (77 t Pb/a) również przyczyniają się do zanieczyszczenia gleby ołowiem. Znaczący wpis dotyczy również amunicji ołowianej. W przypadku terenów skażonych, takich jak: B. W dawnych lokalizacjach zakładów przemysłowych produkujących ołów lub w pobliżu starych kabli z powłoką ołowiową, podłoga może również mieć wysoki poziom zanieczyszczenia ołowiem. Szczególnie wysoki poziom zanieczyszczenia ołowiem doprowadził na przykład do wysokiego poziomu zanieczyszczenia wśród dzieci w mieście Santo Amaro da Purificação ( Brazylia ).
woda
Zanieczyszczenie wód ołowiem wynika głównie z wymywania ołowiu z zanieczyszczonych gleb. Przyczyniają się do tego również niewielkie ilości, które deszcz rozpuszcza z materiałów ołowianych, takich jak panele dachowe. Bezpośrednie zanieczyszczenie wód przez przemysł ołowiowy i wydobycie ołowiu nie odgrywa już (przynajmniej w Niemczech) prawie żadnej roli ze względu na budowę oczyszczalni ścieków . Roczny zrzut ołowiu do wody zmniejszył się w Niemczech z ok. 900 t w 1985 r. do ok. 300 t w 2000 r.
W Niemczech od 1 grudnia 2013 r. wartość graniczna w wodzie pitnej wynosi 10 µg/l (wcześniej 25 µg/l); Pomiar opiera się na próbie reprezentatywnej dla średniego tygodniowego poboru wody przez konsumentów (patrz rozporządzenie w sprawie wody pitnej ).
jedzenie
Zanieczyszczenie powietrza, gleby i wody ołowiem powoduje, że metal przedostaje się do ludzkiego łańcucha pokarmowego za pośrednictwem grzybów, roślin i zwierząt. Różne grzyby mogą zawierać szczególnie wysoki poziom ołowiu. Ołów osadza się w postaci pyłu na liściach roślin, co było charakterystyczne dla obszaru wokół dróg o dużym natężeniu ruchu samochodowego, gdy benzyna była jeszcze ołowiana. Kurz ten można usunąć przez staranne mycie. Dodatkowym źródłem może być ołowiana amunicja z upolowanych zwierząt. Ołów może również migrować do żywności z zawierających ołów szkliw na naczyniach ceramicznych. W zdecydowanej większości przypadków ołowiu i kadmu nie można wykryć w świeżych owocach i warzywach lub tylko w bardzo niewielkich ilościach.
Rury wodociągowe wykonane z rur ołowianych mogą zanieczyszczać wodę pitną. W Niemczech zainstalowano je dopiero w latach 70. XX wieku. Rury ołowiane wciąż można znaleźć, zwłaszcza w starych budynkach w niektórych regionach północnych i wschodnich Niemiec. Według Stiftung Warentest w ponad 5% próbek wody z tych budynków wartości ołowiu w wodzie wodociągowej były powyżej obowiązującej wartości granicznej. To samo dotyczy Austrii i dotyczy przewodów i rur wodociągowych w domu, za które odpowiada właściciel domu. Ołów może być uwalniany ze sztućców zawierających ołów poprzez kwaśną żywność (owoce, wino, warzywa).
Armatura wodociągowa (kurki odcinające, armatura, zawory kątowe, mieszacze) najczęściej wykonuje się z mosiądzu lub brązu . Do mosiądzu dodano 3% ołowiu dla dobrej skrawalności, brąz zawiera 4-7%. To, czy jony ołowiu i innych metali ciężkich (Cu, Zn, Ni) dostaną się do wody w istotnym stopniu zależy od jakości wody : twardości wody , wartości pH , tlenu, zawartości soli. W 2013 roku wartość graniczna zawartości ołowiu w wodzie pitnej została obniżona do 0,01 mg/L. W zasadzie po dłuższym przebywaniu wody w rurze, np. na noc, zawartość wszystkich jonów, które wyemigrowały ze ścianki rury można zredukować uruchamiając rurę wodną na około minutę (płukanie) przed jej wycofaniem do celów związanych z wodą pitną.
Analityka
Klasyczne jakościowe oznaczanie ołowiu
Dowód przez krystalizację
Jony ołowiu można przedstawić jako jodek ołowiu (II) w mikroskopowej reakcji wykrywania. Próbkę rozpuszcza się w rozcieńczonym kwasie solnym i ostrożnie odparowuje aż do krystalizacji. Do pozostałości dodaje się kroplę wody, a następnie kryształ rozpuszczalnego w wodzie jodku, np. . B. dodano jodek potasu (KI). Po krótkim czasie tworzą się mikroskopijne, żółte, heksagonalne płatki jodku ołowiu (II).
Jakościowe dowody w procesie separacji
Od ołowiu nie osad ilościowo PbCl 2 po dodaniu kwasu solnego , można wykryć zarówno w grupie HCl i W do 2 grupy S. PbCl 2 można wytrącić albo przez dodanie jodku potasu zgodnie z powyższą reakcją w postaci żółtego PbI 2 , albo za pomocą K 2 Cr 2 O 7 jako żółtego chromianu ołowiu, PbCrO 4 .
Po wprowadzeniu H 2 S do próbki kwasu solnego dwuwartościowy ołów wytrąca się w postaci czarnego PbS. Jest to wykrywane jako PbI 2 lub PbCrO 4 po trawieniu (NH 4 ) S X i dodaniu 4 M HNO 3 .
Instrumentalna analiza ilościowa ołowiu
Dostępnych jest wiele metod analizy śladowej ołowiu i jego organicznych pochodnych. Jednak w literaturze stale przedstawiane są nowe lub ulepszone procesy, również w odniesieniu do często koniecznego zatężania wstępnego. Problemem, którego nie należy lekceważyć, jest przygotowanie próbki.
Spektrometria absorpcji atomowej (AAS)
Spośród różnych technik AAS, technologia rur kwarcowych i grafitowych zapewnia najlepsze wyniki analizy śladowej związków ołowiu. Często ołów jest przekształcany w lotny wodorek ołowiu, PbH 2 , za pomocą NaBH 4 . Jest on podawany do kuwety kwarcowej, a następnie podgrzewany elektrycznie do ponad 900°C. Próbkę rozpyla się i mierzy się absorbancję przy 283,3 nm przy użyciu lampy z katodą wnękową. Osiągnięto granicę wykrywalności 4,5 ng/ml. Do atomizacji w AAS stosuje się również palnik powietrzno-acetylenowy (F-AAS) lub plazmę indukowaną mikrofalowo (MIP-AAS).
Atomowa spektrometria emisyjna (AES)
W AES do atomizacji sprawdziły się plazma indukowana mikrofalami (MIP-AES) i indukcyjnie sprzężona plazma argonowa (ICP-AES). Detekcja odbywa się przy charakterystycznych długościach fal 283,32 nm i 405,78 nm. Stosując MIP-AES wyznaczono granicę wykrywalności 0,19 pg/g dla trimetyloołowiu (CH 3 ) 3 Pb + . ICP-AES umożliwia ograniczenie wykrywalności ołowiu w wodzie pitnej na poziomie 15,3 ng/ml.
Spektrometria mas (MS)
W naturze występują łącznie cztery stabilne izotopy o różnych częstotliwościach dla ołowiu. Izotop 206 Pb jest często używany w spektrometrii masowej . Za pomocą kwadrupolowego MS ICP izotop ten można było oznaczać w moczu z granicą wykrywalności 4,2 pg/g.
Fotometria
Najbardziej rozpowszechnioną metodą fotometrycznej detekcji ołowiu jest tzw. metoda ditizonowa. Ditizonem jest dwukleszczowy, aromatyczny ligand i tworzy się czerwony kompleks z Pb 2+ jonami o pH 9-11.5, absorbancja, który mierzy się przy 520 nm (ε = 6,9 x 10 4 l / mol-cm). Bizmut i tal zakłócają oznaczanie i powinny być wcześniej wytrącone ilościowo lub wyekstrahowane.
Woltamperometria
Subtrakcyjna anodowa woltamperometria strippingowa (SASV) jest idealna do elektrochemicznego oznaczania śladów ołowiu. Rzeczywiste oznaczenie woltamperometryczne jest poprzedzone okresem wzbogacania redukcyjnego na obracającej się elektrodzie tarczowej Ag. Właściwe określenie następuje następnie poprzez pomiar prądu utleniania podczas skanowania okna potencjału od -800 mV do -300 mV. Pomiar jest następnie powtarzany bez uprzedniego wzbogacenia, a uzyskana w ten sposób krzywa jest odejmowana od pierwszego pomiaru. Wysokość pozostałego piku utleniania przy -480 mV koreluje z ilością obecnego ołowiu. Wyznaczono granicę wykrywalności 50 pM ołowiu w wodzie.
Związki ołowiu
Związki ołowiu występują na stopniach utlenienia +II i +IV. Ze względu na efekt relatywistyczny stopień utlenienia +II jest - w przeciwieństwie do lżejszych homologów z grupy 14, takich jak węgiel i krzem - bardziej stabilny niż stopień utlenienia + IV. Fakt, że preferowany jest stopień utlenienia, który jest niższy o 2, stwierdza się analogicznie w innych grupach głównych i nazywa się efektem obojętnej pary elektronów . Związki ołowiu (IV) są zatem silnymi utleniaczami. W międzymetalicznych związkach ołowiu ( ołowiany : M x Pb y ), zwłaszcza z metalami alkalicznymi i ziem alkalicznych , również przyjmuje ujemne stany utlenienia do -IV. Wiele związków ołowiu to sole , ale są też organiczne związki ołowiu, które mają strukturę kowalencyjną. Podobnie jak w przypadku ołowiu, obecnie podejmowane są próby zastąpienia związków ołowiu innymi, nietoksycznymi związkami. Na przykład „biały ołów” (podstawowy węglan ołowiu (II)) został zastąpiony jako biały pigment dwutlenkiem tytanu .
Tlenki
- Tlenek ołowiu (II) PbO występuje w dwóch odmianach, jako czerwony ołów i żółty masykolit. Obie modyfikacje były wcześniej stosowane jako pigmenty. Służy jako surowiec dla innych związków ołowiu.
- Tlenek ołowiu (II, IV) Pb 3 O 4 , znany również jako czerwony ołów, jest jasnoczerwonym proszkiem, który był wcześniej szeroko stosowany jako pigment i farba antykorozyjna. W Niemczech, a od 2005 roku również w Szwajcarii jest zakazany jako ochrona przed rdzą. Pb 3 O 4 jest wykorzystywany w produkcji szkła do wytwarzania kryształu ołowiowego .
- Tlenek ołowiu (IV) PbO 2 to czarno-brązowy proszek stosowany jako materiał elektrodowy w akumulatorach ołowiowych oraz jako utleniacz w przemyśle chemicznym (np. przy produkcji barwników).
Związki siarki
- Siarczek ołowiu (II) PbS jest tak jak galena ( galena ) głównym minerałem ołowiu. Służy v. a. do produkcji ołowiu metalicznego.
- Siarczan ołowiu (II) PbSO4 występuje również naturalnie jako anglesite i był używany jako biały pigment.
Więcej soli ołowiu
- Ołów (ll), Pb (CH 3 COO) 2 · 3H 2 O, również nazywaną cukrem ołowiu, stosowane być substytutem cukru, np B. do słodzenia wina. Ze względu na toksyczność cukru ołowiowego ludzie umierali od takiego zatrutego wina.
- Octan ołowiu (IV) (Pb (CH 3 COO) 4 ) tworzy bezbarwne kryształowe igły, które w wilgotnym powietrzu pachną octem. Z wodą rozkłada się na tlenek ołowiu (IV) i kwas octowy. Służy jako silny środek utleniający w chemii organicznej.
- Biały ołów , zasadowy węglan ołowiu 2 PbCO 3 · Pb (OH) 2 , niegdyś popularny biały pigment; dziś jest w większości zastępowany tlenkiem tytanu.
- Azotan ołowiu (II) Pb (NO 3 ) 2 to trujący, biały proszek, który był używany do materiałów wybuchowych i do robienia zapałek.
- Chlorku ołowiu (II) PbCl 2 stosuje się jako materiał wyjściowy do produkcji chromianu ołowiu.
- Chromian ołowiu (II) PbCrO 4 to pomarańczowo-żółty proszek, który kiedyś był używany jako pigment i nie jest już używany ze względu na jego toksyczność.
- Azydek ołowiu Pb (N 3 ) 2 jest ważnym początkowym materiałem wybuchowym .
Organiczne związki ołowiu
Organiczne związki ołowiu są prawie zawsze w stanie utlenienia +4. Najbardziej znanym z nich jest tetraetyloołów Pb (C 2 H 5 ) 4 (TEL) trujący płyn, który został dodany do benzyny jako anty- czynnik otwór. Obecnie tetraetyloołów jest używany tylko w paliwie lotniczym .
literatura
- Gerhart Jander, Ewald Blasius: Wprowadzenie do stażu nieorganiczno-chemicznego. Wydanie XIV. S. Hirzel, Lipsk 1995, ISBN 3-7776-0672-3 .
- William H. Brock: Historia chemii Vieweg. Vieweg, Braunschweig 1997, ISBN 3-540-67033-5 .
- Stefan Meier: Ołów w starożytności. Górnictwo, hutnictwo, handel dalekobieżny. Rozprawa . Zurych, Uniwersytet 1995.
- Raymund Gottschalk, Albrecht Baumann: Materiałowe pochodzenie późnorzymskich trumien ołowianych w Nadrenii, Niemcy. W: European Journal of Mineralogy . 13, Stuttgart 2001, s. 197-200.
- Heiko Steuer , Ulrich Zimmermann: Stare górnictwo w Niemczech . (= Archeologia w Niemczech. Wydanie specjalne). Konrad Theiss, Stuttgart 1993, ISBN 3-8062-1066-7 .
linki internetowe
- Atlas minerałów: Ołów (Wiki)
- ARCHIWUM MATERIAŁÓW: Lead - Obszerne informacje o materiałach i zdjęcia
- Zatrucie ołowiem: perspektywa historyczna - historyczna perspektywa zatrucia ołowiem (j. angielski)
- Badanie procesów i systemów recyklingu baterii pod kątem ich znaczenia ekologicznego i ekonomicznego ze szczególnym uwzględnieniem problemu kadmu ( Memento z 13 kwietnia 2012 r. w Internet Archive ) (2001, PDF, s. 215–226; 1,37 MB)
- TRGS 505-Przepisy techniczne dla substancji niebezpiecznych-ołów (PDF; 186 kB)
- Wycieki ołowiu do środowiska (PDF; 3,9 MB)
- Federalna Agencja Środowiska: Ołów monografii materiałowej (1996) ( Memento z 27 września 2007 w Internet Archive ) (PDF; 48 kB)
- Molekularna przyczyna zatrucia ołowiem
- Zdrowie i zdrowie człowieka, Zdrowie środowiskowe i toksykologia, Specjalistyczne usługi informacyjne, Narodowa Biblioteka Medyczna (en.)
- Ołów – informacje z Federalnego Urzędu ds. Bezpieczeństwa Żywności i Weterynarii
Indywidualne dowody
- ↑ Harry H. Binder: Leksykon pierwiastków chemicznych. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3 .
- ↑ Wartości dla właściwości (pole informacyjne) są pobierane z www.webelements.com (lead) , chyba że zaznaczono inaczej .
- ↑ CIAAW, Standardowe Wagi Atomowe Zaktualizowane 2013 .
- ↑ a b c d e wpis o ołowiu w Kramida, A., Ralchenko, Yu., Reader, J. i NIST ASD Team (2019): NIST Atomic Spectra Database (wersja 5.7.1) . Wyd.: NIST , Gaithersburg, MD. doi : 10.18434 / T4W30F ( https://physics.nist.gov/asd ). Źródło 13 czerwca 2020 r.
- ↑ b c d e wpis w wyniku na WebElements, https://www.webelements.com , dostępne w dniu 13 czerwca 2020 roku.
- ^ NN Greenwood, A. Earnshaw: Chemia pierwiastków. Wydanie I. VCH, Weinheim 1988, ISBN 3-527-26169-9 , s. 482.
- ↑ David R. Lide (red.): CRC Handbook of Chemistry and Physics . Wydanie 90. (Wersja internetowa: 2010), CRC Press / Taylor and Francis, Boca Raton, FL, Właściwości pierwiastków i związków nieorganicznych, s. 4-142-4-147. Podane tam wartości oparte są na gramach/mol i podawane są w jednostkach cgs. Podana tutaj wartość jest wartością SI obliczoną z niej, bez jednostki miary.
- ^ A b Yiming Zhang, Julian RG Evans, Shoufeng Yang: Wartości skorygowane o temperaturach wrzenia i entalpii parowania Elements w podręcznikach. W: Journal of Chemical & Engineering Data . 56, 2011, s. 328-337, doi: 10.1021/je1011086 .
- ↑ a b C. A. Sutherland, EF Milner, RC Kerby, H. Teindl, A. Melin, HM Bolt: Ołów. W: Encyklopedia chemii przemysłowej Ullmanna. Wiley-VCH Verlag, Weinheim 2006, doi : 10.1002 / 14356007.a15_193.pub2
- ↑ b c d Wejście na ołowiu, proszek na bazie substancji GESTIS z tej IFA , dostępnym w dniu 30 kwietnia 2017 r. (wymagany JavaScript)
- ↑ Wpis na ołów w wykazie klasyfikacji i oznakowania w Europejskiej Agencji Chemikaliów (ECHA), dostępne w dniu 1 sierpnia 2016. Producenci i dystrybutorzy mogą rozwinąć się zharmonizowanej klasyfikacji i oznakowania .
- ↑ Wpis w wykazie SVHC w tym Europejskiej Agencji Chemikaliów , dostępne w dniu 21 kwietnia 2020 r.
- ↑ Instytut Chemii Nieorganicznej i Ograniczeń Gmelin: Ołów Część A 1: Historia . Springer-Verlag, 2013, ISBN 978-3-662-11844-3 , s. 6 ( ograniczony podgląd w wyszukiwarce Google Book).
- ↑ Betina Faist : Handel długodystansowy imperium asyryjskiego między XIV a XI wiekiem p.n.e. (= Stary Wschód i Stary Testament. Tom 265). Ugarit Verlag, Münster 2001, s. 45.
- ^ B Hans Schwerteck: ołowiu. W: Nowy Pauly (DNP). Tom 2, Metzler, Stuttgart 1997, ISBN 3-476-01472-X , Sp.707-709, tutaj Sp.707.
- ↑ Peter Kritzinger : Nowe zeznanie starego przyjaciela: ołowiana pieczęć, handel ołowiem i produkcja ołowiu w wolnej Germanii. W: wkład Marburga w starożytny handel, historię gospodarczą i społeczną . Tom 35, 2017, s. 87-107, tutaj s. 102 (zwłaszcza nota 55) ( online ).
- ↑ a b c Hans Schwerteck: ołów. W: Nowy Pauly (DNP). Tom 2, Metzler, Stuttgart 1997, ISBN 3-476-01472-X , Sp.707-709, tutaj Sp.708.
- ↑ Dietwulf Baatz : Proce z ołowiu. Dochodzenie w sprawie broni. W: Rocznik Saalburga. Tom 45, 1990, s. 59-67.
- ↑ Witruwiusz, De architectura 8,6,10–11 (tekst: łac. niem . ).
- ↑ BENZINBLEIGESETZ: BENZINBLEIGESETZ , dostęp 24 marca 2018 r.
- ↑ Bill Bryson: Krótka historia prawie wszystkiego . Goldmann Verlag, 2011, ISBN 978-3-641-07924-6 , s. 219 ( ograniczony podgląd w wyszukiwarce Google Book).
- ↑ Wolfgang Piersig: ołów - metal starożytności, teraźniejszości, przyszłości, materiał dla techniki, kultury, sztuki . GRIN Verlag, 2011, ISBN 978-3-656-07290-4 , s. 8 ( ograniczony podgląd w wyszukiwarce Google Book).
- ↑ Federalny Instytut Bezpieczeństwa i Higieny Pracy : BAuA – Dokumentacja – Dokumentacja warsztatu dla interesariuszy „Renowacja okien drewnianych z powłokami ołowiowymi” w dniu 16 lutego 2009 r. – Federalny Instytut Bezpieczeństwa i Higieny Pracy , dostęp 24 marca 2018 r.
- ↑ Technische Universität Dresden, Wydział Nauk o Środowisku: Badania nad dystrybucją bezołowiowej amunicji myśliwskiej – dyfuzyjne rozważania teoretyczne na temat akceptacji potencjalnej innowacji środowiskowej , praca doktorska Jana Engela
- ↑ Druk 700/17 (uchwała) 15 grudnia 2017 r. w sprawie rozporządzenia w sprawie reorganizacji przepisów dotyczących wody pitnej , uchwała B 4.
- ↑ a b Państwowy Urząd Zdrowia Dolnej Saksonii : Pytania i odpowiedzi dotyczące ołowiu w wodzie pitnej , dostęp 21 stycznia 2020 r.
- ↑ Art. 67 ust 1 rozporządzenia (WE) nr 1907/2006 i. W połączeniu z załącznikiem XVII nr 30 tego tzw. rozporządzenia REACH oraz załącznikiem VI część 3 rozporządzenia (WE) nr 1272/2008 (tzw. rozporządzenie CLP ). Zakaz wynikał z umieszczenia ołowiu w postaci proszku (wielkość cząstek poniżej 1 mm, indeks nr 082-13-00-1) lub masy (nr indeksu 082-14-00-7) na liście substancji niebezpiecznych dla reprodukcji (tutaj Kategoria 1A) zgodnie z tabelą 3 wyżej wymienionego załącznika do rozporządzenia CLP i zgodnie z dodatkiem 5 wyżej wymienionego załącznika do rozporządzenia REACH przez Komisję rozporządzenia (UE) 2017/1510 z dnia 30 sierpnia 2017 roku ze skutkiem od 1 marca 2018 r. Naruszenie tego zakazu wprowadzania do obrotu z. B. sprzedaż takiego ołowiu „prywatnemu” w celu wylewania ołowiu itp. jest zatem w Niemczech zgodnie z § 5 nr 20 rozporządzenia w sprawie sankcji chemicznych i. V. m. § 27 ustawy o chemikaliach za przestępstwo (stan na lipiec 2019 r.).
- ↑ Hans Breuer: Chemia ogólna i nieorganiczna. (= dtv-Atlas Chemie. Tom 1). Wydanie IX. dtv, Monachium 2000, ISBN 3-423-03217-0 , s. 151.
- ↑ a b Lista stanowisk ołowiu stałego w Mineralienatlas i Mindat
- ↑ a b Ołów . W: John W. Anthony, Richard A. Bideaux, Kenneth W. Bladh, Monte C. Nichols (red.): Handbook of Mineralogy, Mineralogy Society of America . 2001 ( handbookofmineralogy.org [PDF; 57 kB ; udostępniono 12 stycznia 2018 r.]).
- ↑ Webmineral - Gatunki mineralne posortowane według pierwiastka Pb (Ołów ).
- ↑ Instytut Fraunhofera: Trendy w sytuacji podaży i popytu na surowce mineralne. ( Pamiątka z 10 marca 2013 r. w Archiwum Internetowym ) (PDF, 350 s.; 2,1 MB).
- ↑ a b Friedrich Klockmann : Podręcznik mineralogii Klockmanna . Wyd.: Paul Ramdohr , Hugo Strunz . 16. edycja. Enke, Stuttgart 1978, ISBN 3-432-82986-8 , s. 396 (pierwsze wydanie: 1891).
- ↑ Richard V. Gaines, H. Catherine W. Skinner, Eugene E. Foord, Brian Mason , Abraham Rosenzweig: Nowa mineralogia Dany . Wydanie ósme. John Wiley & Sons, Nowy Jork (i in.) 1997, ISBN 0-471-19310-0 , s. 5 .
- ↑ Lista nazw minerałów IMA / CNMNC; Lipiec 2019 (PDF 1,67 MB; ołów (ołów) patrz s. 106)
- ↑ Lista nazw minerałów IMA / CNMNC; 2009 (PDF 1,8 MB, ołów (ołów) patrz str. 161).
- ↑ Webmineral - Minerały uporządkowane według klasyfikacji New Dana. 01.01.2001 Grupa złota
- ↑ Przykłady obrazów platy i ołowiu dendrytycznego na mindat.org
- ↑ Przykład mikroskopowego obrazu oktaedrycznych kryształów ołowiu na mindat.org
- ↑ Służba Geologiczna Stanów Zjednoczonych.
- ↑ Statystyki: Światowe zużycie ołowiu do 2016 r. | Statystyki , dostęp 24 marca 2018 r.
- ↑ Statystyki: • Produkcja ołowiu na całym świecie do 2016 r. | Statystyki , dostęp 24 marca 2018 r.
- ↑ QSL na berzelius.de ( Memento z 29 września 2007 w Internet Archive )
- ↑ a b Michael Binnewies: Chemia ogólna i nieorganiczna. Widmo, Heidelberg 2004, ISBN 3-8274-0208-5 .
- ^ Ralph WG Wyckoff: Struktury krystaliczne . Wydanie II. taśma 1 . John Wiley & Sons, Nowy Jork, Londyn, Sydney 1963, s. 3 (w załączniku ).
- ^ Hugo Strunz , Ernest H. Nikiel : Strunz Tabele mineralogiczne. System klasyfikacji minerałów chemiczno-strukturalnych . Wydanie IX. E. Schweizerbart'sche Verlagbuchhandlung (Nägele i Obermiller), Stuttgart 2001, ISBN 3-510-65188-X , s. 35 .
- ↑ Dane arkusz ołowiu (PDF) z Merck , dostępne w dniu 23 lutego 2010 r.
- ↑ a b c A. F. Holleman , E. Wiberg , N. Wiberg : Podręcznik chemii nieorganicznej . Wydanie 101. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9 .
- ↑ P. de Marcillac, N. Coron, G. Dambier, J. Leblanc, J.-P. Moalic: Eksperymentalne wykrywanie cząstek α pochodzących z rozpadu promieniotwórczego naturalnego bizmutu. W: Przyroda . 422, 2003, s. 876-878; doi: 10.1038 / natura01541 .
- ↑ G. Audi, O. Bersillon, J. Blachot, AH Wapstra: Ocena NUBASE właściwości jądrowych i rozpadu. W: Fizyka Jądrowa. Tom A 729. Amsterdam 2003, s. 3-128. doi : 10.1016 / j.nuclphysa.2003.11.001 . ( PDF ; 1,0 MB).
- ↑ Polowanie na neutriny, ołów ze starożytnego statku chroni eksperyment high-tech. W: Spiegel Online. 19 marca 2010 . Źródło 19 marca 2010 .
- ↑ F. Scheiding: O środkach ochronnych przy produkcji nitrogliceryny. W: Angewandte Chemie . 3, 20, 1890, s. 609-613; doi: 10.1002 / anie.18900032002 .
- ↑ RoHS: Nowe wyjątki od wymagań dotyczących stosowania substancji: RoHS: Nowe wyjątki od wymagań dotyczących stosowania substancji ( pamiątka z 24 marca 2018 r. w Internet Archive ), dostęp 24 marca 2018 r.
- ↑ Za dużo ołowiu w armaturze kuchennej. dnia: orf.at 19 sierpnia 2011, dostęp 28 kwietnia 2012.
- ↑ Wykaz wartości MAK i BAT 2017, Komunikat 53, Senacka Komisja ds. Badań Substancji Niebezpiecznych , Wiley-VCH Verlag, 21 lipca 2017, ISBN 978-3-527-81211-0 , Rozdział III. Substancje rakotwórcze ( doi : 10.1002 / 9783527812110.ch3 , pełny tekst wolny) oraz wykaz wartości MAK i BAT 2017 ( doi : 10.1002 / 9783527812110.oth , pełny tekst wolny).
- ↑ Katja Bauer: Toksyny na strzelnicach elitarnej policji? na: badische-zeitung.de , 4 czerwca 2016, (4 czerwca 2016)
- ↑ Strzelcy powinni używać amunicji bezołowiowej. W: badische-zeitung.de , Panorama. 9 czerwca 2016 r. (11 czerwca 2016 r.)
- ↑ F. Scheffer, P. Schachtschabel: Podręcznik do nauki o glebie. Wydanie XIII. Enke Verlag, Stuttgart 1992, ISBN 3-432-84772-6 , rozdz. XXII 4d.
- ↑ Dane środowiskowe (s. 31). (PDF; 4,1 MB).
- ↑ Ołów śrut i środowisko, Nabu; Związek okręgowy Akwizgran .
- ↑ Poluj z amunicją ołowianą, SWR .
- ↑ Carvalho FM, Neto AM, Peres MF i in . 1996; 72 (5): 295-298. doi: 10.2223 / jped.629
- ↑ Dane środowiskowe (str. 28 i 35). (PDF; 4,1 MB).
- ↑ Metale ciężkie w żywności: Metale ciężkie w żywności , dostęp 24 marca 2018 r.
- ^ Stiftung Warentest ostrzega przed ołowiem w wodzie pitnej , 19 marca 2010, dostęp 2 stycznia 2013.
- ↑ Brąz kontra mosiądz. ( Pamiątka z 28 maja 2013 r. w Internet Archive ) pod adresem: messing-sanitaer.de , dostęp 3 lutego 2014 r.
- ↑ Korozja materiałów metalowych w wodzie pitnej. na: trinkwasserspezi.de , dostęp 3 lutego 2014 r.
- ↑ G. Jander, E. Blasius: Podręcznik analitycznej i preparatywnej chemii nieorganicznej. 16. edycja. S. Hirzel-Verlag, Stuttgart 2005, ISBN 3-7776-1388-6 , s. 533, 472, 540-541.
- ↑ N. Maleki, A. Safavi, Z. Ramezani: Oznaczanie ołowiu metodą spektrometrii absorpcji atomowej z generacją wodorków (HGAAS) przy użyciu stałego ośrodka do generowania wodorków. W: J Anal W Spectrom . 14, 1999, s. 1227-1230; doi: 10.1039 / A808429G .
- ↑ M. Heisterkamp, F. Adams: Propylacja in situ z użyciem tetrapropyloboranu sodu jako szybkie i uproszczone przygotowanie próbek do analizy specjacyjnej związków ołowioorganicznych z zastosowaniem GC-MIP-AES. W: J. Anal. Na. Widmo. 14, 1999, s. 1307-1311; doi: 10.1039 / A901340G .
- ↑ M. Zougagh, A. Garcia de Torres, E. Alonso, J. Pavon: Automatyczne zatężanie wstępne i oznaczanie ołowiu w wodzie metodą ICP-AES przy użyciu mikrokolumny TS. W: Talanta . 62, 2004, s. 503-510; doi: 10.1016 / j.talanta.2003.08.033 .
- ↑ Z. Chen, N. Zhang, L. Zhuo, B. Tang: Katalityczne metody kinetyczne do fotometrycznego lub fluorymetrycznego oznaczania jonów metali ciężkich. W: Microchim Acta . 164, 2009, s. 311-336; doi: 10.1007 / s00604-008-0048-8 .
- ^ A. Townsend, K. Miller, St. McLean, St. Aldous: Oznaczanie miedzi, cynku, kadmu i ołowiu w moczu metodą ICP-MS o wysokiej rozdzielczości. W: J. Anal. Na. Widmo. 13, 1998, s. 1213-1219; doi: 10.1039 / A805021J .
- ↑ R. Łobinski, Z. Marczenko: Spektrochemiczna analiza śladów metali i niemetali. Elsevier 1997, ISBN 0-444-82879-6 .
- ^ I. Oehme, OS Wolfbeis: Czujniki optyczne do oznaczania jonów metali ciężkich. W: Microchim. Akta . 126, 1997, s. 177-192; doi: 10.1007 / BF01242319 .
- ↑ B. Lange, ZJ Vejdelek: Analiza fotometryczna. Verlag Chemie, Weinheim 1980.
- ↑ Y. Bonfil, E. Kirowas-Eisner: Oznaczanie nanomolarnych stężeń ołowiu i kadmu metodą woltamperometrii anodowo-striptowej na elektrodzie srebrnej. W: Anal. Szym. Akta . 457, 2002, str. 285-296; (PDF) ( Pamiątka z 30 stycznia 2012 w Internet Archive )
- ^ J. Wang: Analiza odpędzania w elektrodach bizmutu: przegląd. W: Elektroanaliza . 17, 2005, str. 1341-1346; doi: 10.1002 / elan.200403270 .