Przewlekła białaczka szpikowa
| Klasyfikacja zgodnie z ICD-10 | |
|---|---|
| C92.1 | Przewlekła białaczka szpikowa |
| ICD-10 online (wersja WHO 2019) | |
| Klasyfikacja zgodnie z ICD-O-3 | |
|---|---|
| 9863/3 | Przewlekła białaczka szpikowa nos |
| Pierwsza wersja ICD-O-3 online | |
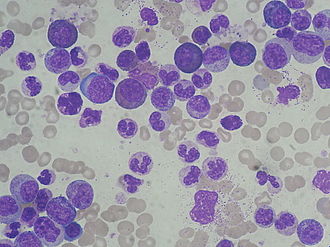
Przewlekła białaczka szpikowa (CML) , w tym przewlekła białaczka szpikowa i (rzadko) przewlekłej myelosis nazywa, przewlekła białaczka z proliferacji leukocytów (krwinek białych), a zwłaszcza granulocyty i ich prekursorów, w tym we krwi i krwiotwórczych Związany ze szpikiem kostnym . W początkowej fazie choroba często przebiega bezobjawowo.
CML należy do grupy mieloproliferacyjnych nowotworów (NPL), to znaczy, że choroby wynikające z zaburzeń (genetyczne) z krwiotwórczych komórek macierzystych znaleziono w szpiku kostnym . Choroba opisana przez Rudolfa Virchowa w 1845 roku i po raz pierwszy udokumentowana pod nazwą białaczka była najprawdopodobniej CML.
Dzięki zastosowaniu nowszych leków specyficznych dla nowotworów, tak zwanych inhibitorów kinazy tyrozynowej , od przełomu tysiącleci rokowanie i formy leczenia CML uległy znaczącej zmianie i choroba stała się w wielu przypadkach uleczalna ze stosunkowo niewielkim działaniem. efekty. CML jest tak zwany od takiego zastosowania terapii celowanych (ang. Terapie celowane ) prawie do choroby modelowej dla całej hematologii lub terapii nowotworowej w ogóle.
Epidemiologia

CML występuje z częstością około 1,6 nowych przypadków na 100 000 dorosłych rocznie i stanowi około 20 procent wszystkich białaczek. Jest to głównie choroba wieku dorosłego i wykazuje stały wzrost wraz z wiekiem. Mężczyźni są około 1,4 razy bardziej narażeni niż kobiety. Średnią ( medianę ) rozpoznania dokonuje się w wieku 65 lat; około 10 procent pacjentów ma mniej niż 35 lat w momencie postawienia diagnozy. Szacuje się, że każdego roku występuje około 1700 nowych przypadków w całych Niemczech, około 160 w Szwajcarii i około 175 w Austrii.
Przyczyny i pochodzenie

Przyczyną choroby jest zmiana i następująca po niej proliferacja (rozmnażanie) pojedynczej multipotencjalnej krwiotwórczej komórki progenitorowej . W prawie wszystkich przypadkach przyczyną jest wzajemna translokacja między chromosomami 9 i 22 (napisane: t (9; 22) (q34; q11) lub w skrócie t (9; 22)). W obu zaangażowanych chromosomach punkt złamania znajduje się na dłuższym ramieniu (ramię q), z chromosomem 9 bliżej końca niż w przypadku chromosomu 22 .
Przerwanie chromosomu występuje na obu chromosomach w obszarze genów, a mianowicie ABL (lub ABL1 ) na chromosomie 9 i BCR („ region klastra punktu przerwania ”) na chromosomie 22. Translokacja prowadzi do powstania genów fuzyjnych: BCR-ABL na zmienionym chromosomie 22 (z końcem chromosomu 9) i ABL-BCR na zmienionym chromosomie 9 (z końcem chromosomu 22). Translokacja chromosomów jest cytogenetycznie widoczna jako skrócony chromosom 22, znany jako „ chromosom Philadelphia ”.
W ABL koduje gen dla kinazy tyrozynowej i odgrywa ważną rolę w regulacji wzrostu komórek. Jeśli utworzy się gen fuzyjny BCR-ABL , funkcja ABL jest zdecydowanie zaburzona, a aktywność kinazy tyrozynowej jest trwale aktywowana. BCR-ABL gen działa więc jako onkogen i powoduje zwiększenie i niekontrolowanego rozmnażania komórek dotkniętych. Translokacja jest nabywana w trakcie życia i nie jest dziedziczna ani dziedziczna, ponieważ komórki linii zarodkowej są nienaruszone (o ile wiadomo, dotyczy to tylko komórek układu krwiotwórczego). Nie wiadomo, dlaczego tak się dzieje. Podobnie jak w przypadku mutacji ogólnie, promieniowanie jonizujące lub chemikalia są omawiane jako czynniki ryzyka wystąpienia zmiany .
Chromosom Philadelphia nie jest wykrywalny u wszystkich pacjentów z CML. W dużym badaniu prospektywnym przeprowadzonym przez Medical Research Council nie wykryto cytogenetycznie chromosomu Philadelphia w około 15 procentach przypadków. Jednak u dwóch trzecich tych pacjentów z ujemnym chromosomem Philadelphia, onkogen BCR-ABL był wykrywalny, a obraz kliniczny nie różnił się znacząco od tego u pacjentów z dodatnim chromosomem Philadelphia. Niektórzy z tych pacjentów mieli złożone zmiany chromosomowe, które maskowały translokację t (9; 22). U jednej trzeciej, tj. Około pięciu procent wszystkich pacjentów z CML, nie było dowodów na translokację t (9; 22) lub fuzję BCR-ABL . Obraz kliniczny tej postaci wyraźnie różnił się od „typowej” CML i miał znacznie gorsze rokowanie .
kierunek
CML klasycznie przebiega w trzech etapach , a z fazy przewlekłej The przyspieszenia fazy i kryzy blastycznej (lub podmuch przepięć ). Przed pojawieniem się nowych leków i zanim pojawiła się opcja przeszczepu komórek macierzystych pochodzących od zdrowych dawców, przebieg choroby przebiegał prawie regularnie. Kryzys wybuchowy był końcowym etapem choroby i doprowadził do śmierci chorego. Nawet dzisiaj nie można z całą pewnością przewidzieć, kiedy faza przyspieszona i kiedy wystąpi u pacjenta kryzys wybuchowy. Znane są pojedyncze przypadki pacjentów z CML, którzy żyli w fazie przewlekłej przez ponad 20 lat. U innych pacjentów faza akceleracji i przełom podmuchowy wystąpiły wkrótce po rozpoznaniu. Obecnie kryzysy wywołane przez wybuch stały się rzadsze, ponieważ istnieją dobre opcje leczenia fazy przewlekłej. Jednak czasami są one nadal diagnozowane (często jako „pierwsza manifestacja” CML).
Faza przewlekła
Początek choroby jest powolny, podstępny i często pozostaje niezauważony przez lata. Głównymi objawami tej fazy są leukocytoza (wzrost liczby białych krwinek) i splenomegalia (powiększenie śledziony). Powiększenie śledziony tłumaczy się zwiększającym się wypieraniem zdrowej krwi ze szpiku kostnego, tak że pozaszpikowe tworzenie się krwi następuje w śledzionie, a później także w wątrobie. Diagnoza jest zwykle stawiana na tym etapie i nierzadko jest to diagnoza przypadkowa, na przykład na podstawie morfologii krwi, która ujawnia leukocytozę. W morfologii różnicowej , oprócz dojrzałych granulocytów, występują niedojrzałe prekursory szeregu mieloidalnego, aż do mieloblastów (tzw. Patologiczne przesunięcie w lewo ). Odsetek całkowicie niedojrzałych komórek (blastów) jest mniejszy niż dziesięć procent.
Faza przyspieszenia
Faza akceleracji ( łac. Accelerare = przyspieszyć) jest fazą przejściową między fazą przewlekłą a falą uderzeniową, w której choroba nabiera rozpędu. Charakteryzuje się nasileniem leukocytozy, anemią ( anemią ), małopłytkowością (brakiem płytek krwi ) i narastającym obrzękiem śledziony. Różnicowa morfologia krwi wykazuje odsetek blastów wynoszący od dziesięciu do 30 procent. Analiza cytogenetyczna często wykazuje nowe zmiany chromosomowe oprócz chromosomu Philadelphia (najczęściej: izochromosom 17, drugi chromosom Philadelphia, trisomia chromosomów 8 lub 19). Ogólne subiektywne samopoczucie pacjenta ulega pogorszeniu. Jeśli pacjent przechodzi chemioterapię, działanie leku słabnie i dawkę należy zwiększyć.
Kryzys wybuchowy
Kryzys wybuchowy pojawia się stosunkowo nagle po fazie akceleracji lub bezpośrednio z fazy przewlekłej. W kryzysie wybuchowym choroba zmienia swój charakter z przewlekłego, raczej powolnego przebiegu na przebieg odpowiadający ostrej białaczce. Kryzys wybuchowy jest definiowany przez:
- Odsetek blastów we krwi obwodowej i / lub szpiku kostnym ≥ 30% (według kryteriów niemieckiej grupy badanej CML) lub ≥ 20% (według definicji WHO) i / lub
- potwierdzone cytologicznie lub histologicznie nacieki blastyczne (nagromadzenie dużej ilości komórek CML w tkance) poza szpikiem kostnym, śledzioną lub węzłami chłonnymi. Takie nacieki są również znane jako chloromy .
Blasty w około dwóch trzecich wszystkich kryzysów blastycznych wykazują mieloidalny lub całkowicie niezróżnicowany fenotyp immunologiczny . Pozostała trzecia ma limfatyczny immunofenotyp. W tym drugim przypadku przełom blastyczny jest zwykle trudny lub niemożliwy do odróżnienia od ostrej białaczki limfoblastycznej z chromosomem Philadelphia bez wiedzy o wcześniejszej historii . Różne transkrypty mRNA - BCR-ABL - , których względna dystrybucja różni się w CML i ALL, dają pewne wskazania . Etap kryzysu wybuchowego kończy się stosunkowo szybko (w ciągu kilku tygodni) i nieleczony jest śmiertelny.
Diagnoza
a) Cytologia szpiku kostnego: Typowe dla CML jest wzrost we wszystkich czterech rzędach komórek mielopoezy: trombopoezy (tworzenie płytek krwi), granulopoeza (tworzenie granulocytów), monopoeza (tworzenie monocytów) i erytropoeza (tworzenie erytrocytów). Z reguły pojawia się „pełny (czyli bogaty w komórki) szpik kostny”. Najbardziej nasila się granulocytopoeza i zyskuje przewagę w późnej fazie choroby kosztem innych rzędów komórek. Jednak występują ilościowe i jakościowe zmiany z czasami niezwykle małymi megakariocytami („mikromegakariocytami”), a często także ze wzrostem bazofilów i / lub eozynofilów .
b) Cytogenetyka i genetyka molekularna: 95% wykrywanie chromosomu Philadelphia i / lub onkogenu BCR-ABL we krwi i szpiku kostnym. Brak tych zmian jest prognostycznie mniej korzystny. Wykrywanie BCR-ABL w chorobie mieloproliferacyjnej jest rozstrzygające dla rozpoznania CML. Czasami chromosom Philadelphia występuje również w ostrej białaczce limfoblastycznej .
c) Morfologia i parametry kliniczno-chemiczne krwi: trombocytoza (w początkowej fazie) u jednej trzeciej pacjentów (ryzyko zakrzepicy!), neutrofilia z wyraźną eozyno- i bazofilią oraz przesunięcie w lewo (wzrost niedojrzałych prekursorów granulocyty ) i umiarkowanej niedokrwistości . Jednak w fazie przewlekłej występuje tylko kilka wybuchów, w przeciwieństwie do ostrej białaczki szpikowej, pomimo znacznie zwiększonej liczby leukocytów. W CML można uzyskać liczbę białych krwinek do ponad 500 000 / µl (wartość normalna <10 000 / µl). Ponadto, w przeciwieństwie do komórek limfocytowych w przewlekłej białaczce limfocytowej (CLL) lub białaczce prolimfocytowej (PLL), które również mają wysoką liczbę leukocytów we krwi, komórki CML wykazują tendencję do przylegania do siebie („lepkość”). Dlatego przy tak wysokich wartościach istnieje ostre ryzyko wystąpienia objawów leukostazy , czyli nie ma już gwarancji zdolności przepływu krwi. W rezultacie na tym etapie mogą wystąpić zakrzepice i zaburzenia krążenia (zakrzepica żylna siatkówki , zawał śledziony, bolesny priapizm z powodu zakrzepicy tkanki erekcyjnej , zawał mózgu , zawał mięśnia sercowego ).
d) Cytochemia: Indeks ALP jako wyraz aktywności alkalicznej fosfatazy leukocytów w neutrofilach jest zwykle obniżony. Jednak w dzisiejszych czasach przepis ten prawie całkowicie stracił na znaczeniu.
Wyrazem zwiększonego obrotu komórkowego jest zwykle podwyższona aktywność dehydrogenazy mleczanowej (LDH) i poziom kwasu moczowego we krwi.
terapia
Ogólne cele terapii
Celem terapii jest możliwie największe stłumienie choroby z uzasadnionymi skutkami ubocznymi. Do pomiaru skuteczności zabiegu używa się następujących terminów:
- odpowiedź hematologiczna ( odpowiedź hematologiczna) , czyli stopień normalizacji morfologii krwi i regresji splenomegalii; odpowiedź hematologiczną określa się na podstawie badania klinicznego i różnicowej morfologii krwi;
- odpowiedź cytogenetyczna ( odpowiedź cytogenetyczna) , d. H. Procent komórek, w których chromosomem Philadelphia Ph + mogą być wykryte cytogenetycznie ;
- odpowiedź molekularna ( odpowiedź molekularna) , czyli pomiar mRNA BCR-ABL metodą ilościowej reakcji łańcuchowej polimerazy (PCR)
Następujące terminy są zdefiniowane w międzynarodowym żargonie medycznym:
Odpowiedź hematologiczna
Jako pełna odpowiedź hematologiczna ( pełna odpowiedź hematologiczna , CHR) jest określana, tj. Całkowita normalizacja morfologii krwi i objawów klinicznych. H. Płytki krwi poniżej 450 x 10 9 / l, leukocyty poniżej 10 x 10 9 / l, rozmaz krwi bez niedojrzałych prekursorów granulocytów (mielocyty, promielocyty, mieloblasty) i mniej niż 5% bazofili i brak wyczuwalnej splenomegalii.
Odpowiedź cytogenetyczna
Odpowiedź cytogenetyczną mierzy się za pomocą badania cytogenetycznego . Określa się procent metafaz z wykrywalną translokacją Philadelphia.
- Pełna odpowiedź cytogenetyczna ( pełna odpowiedź cytogenetyczna , CCyR): Ph + 0 procent
- Częściowa odpowiedź cytogenetyczna ( częściowa odpowiedź cytogenetyczna , PCyR): Ph + 1-35 procent
- Niska odpowiedź cytogenetyczna ( niewielka odpowiedź cytogenetyczna , MiCyR): Ph + 36-65 procent
- Minimalna odpowiedź cytogenetyczna (minimalna odpowiedź cytogenetyczna) : Ph + 66-95 procent
- Brak odpowiedzi cytogenetycznej (brak odpowiedzi cytogenetycznej) : Ph +> 95%
Odpowiedź molekularna
Odpowiedź molekularną mierzy się za pomocą RT-PCR . Aby zapewnić porównywalność między różnymi laboratoriami, opracowano skalę międzynarodową (IS).
- Pełna odpowiedź molekularna ( pełna odpowiedź molekularna , CMR): BCR-ABL niewykrywalne
- Odpowiedź molekularna ( większa odpowiedź molekularna , MMR): BCR-ABL ≤ 0,10 IS
Mówiąc prościej, można powiedzieć, że przy pełnej odpowiedzi hematologicznej odsetek komórek CML we krwi / szpiku kostnym może znajdować się co najwyżej w dolnym dwucyfrowym przedziale procentowym, przy pełnej odpowiedzi cytogenetycznej jest to najwyżej w dolnym przedziale jednocyfrowy zakres procentowy i przy pełnej odpowiedzi molekularnej jest poniżej zakresu zawartości alkoholu.
Lek
Hydroksykarbamid
Normalizację liczby białych krwinek można często osiągnąć stosując hydroksymocznik (hydroksymocznik, angielski: hydroksymocznik, HU). Ten lek cytostatyczny jest na rynku od dawna. Hamuje konwersję rybonukleotydów do deoksyrybonukleotydów, a także jest skuteczny w innych wymienionych powyżej chorobach mieloproliferacyjnych. Typowe dawki to jedna tabletka od 500 mg do około czterech tabletek (= dwa gramy) dziennie.
Efekty uboczne są rzadkie, czasami lekkie nudności, bardzo rzadko uszkodzenie błony śluzowej lub toksyczność wątroby . Terapia ta umożliwia zmniejszenie liczby leukocytów we krwi prawie z powrotem do normalnego zakresu (od 5 000 do 10 000 / μl). Jednak ta normalizacja nie ma trwałego wpływu na przebieg choroby. Po średnio trzech latach stan pogarsza się dalej i rozpoczyna się faza akceleracji. Mediana przeżycia pacjentów leczonych hydroksymocznikiem jest nieco dłuższa niż pacjentów całkowicie nieleczonych i w historycznych badaniach dotyczących terapii wynosiła około 4,5 roku.
Stosowanie hydroksymocznika w CML jest obecnie przydatne tylko w niektórych sytuacjach, na przykład gdy bardzo wysoka liczba białych krwinek ma zostać zmniejszona w początkowej fazie leczenia lub jeśli zastosowanie TKI (patrz poniżej) nie jest możliwe z powodu nietolerancji. skutki uboczne lub jeśli oczekiwana długość życia pacjenta jest bardzo krótka z powodu innych istniejących chorób (np. zaawansowany rak).
Interferon-α
Interferon alfa (α) (IFN-α) jest cytokiną wytwarzaną i uwalnianą przez leukocyty; służy odpowiedzi immunologicznej na infekcje wirusowe i bakteryjne oraz indukuje między innymi zahamowanie proliferacji w komórkach docelowych, np. w przypadku ataku wirusa. Zwiększa również aktywność cytotoksycznych limfocytów T i makrofagów . Interferon jest zwykle wstrzykiwany podskórnie 3 razy w tygodniu . Typowe dawki to 3 x 0,5 do 3 x 6 milionów jednostek na tydzień. Można go podawać w monoterapii lub w połączeniu z innymi lekami. Interferon-α jest często lekiem, który nie jest dobrze tolerowany. Mogą wystąpić objawy grypopodobne, ale występują one w zależności od dawki. W wielu przypadkach terapia interferonem wpływa na zdolność koncentracji i zapamiętywania ; może wystąpić depresja , zawroty głowy , splątanie i polineuropatie . Zabieg wpływa również na przewód pokarmowy i wątrobę .
Inhibitory kinazy tyrozynowej (TKI)
Specyficzną terapię można zastosować u pacjentów z dodatnim wynikiem BCR-ABL . Od przełomu tysiącleci istnieją leki, które mogą specyficznie hamować aktywność enzymatyczną kinazy tyrozynowej składnika ABL w BCR-ABL w sposób konkurencyjny . Te inhibitory kinazy tyrozynowej zrewolucjonizowały leczenie CML i doprowadziły do radykalnej poprawy wyników leczenia. Rozróżnia się inhibitory kinazy tyrozynowej (TKI) pierwszej, drugiej i trzeciej generacji, które weszły na rynek jeden po drugim. Najważniejszym TKI pierwszej generacji jest imatynib . Związek otrzymał pozwolenie na leczenie CML w Europie i Stanach Zjednoczonych odpowiednio w 2001 i 2003 roku. TKI drugiej generacji to nilotynib i dazatynib , TKI trzeciej generacji to bosutynib i ponatynib .
Obecnie uważa się, że inhibitory kinazy tyrozynowej są medycznym „ złotym standardem ” leczenia CML.
Imatinib i badanie IRIS
Skuteczność i wyższość imatinibu do wszystkich znanych wcześniej inne leczenie farmakologiczne był w dużej międzynarodowej faza III próbne leczenie z ponad 1000 pacjentów z przewlekłą białaczką szpikową, zwany IRIS badania, znacząco ( Iris. = I MIĘDZYNARODOWE R andomized studium I nterferon i S TI571 ). Badanie terapii IRIS było pierwotnie planowane jako dwuramienne badanie porównawcze . H. połowa pacjentów powinna otrzymywać imatynib w ramach leczenia, a druga połowa pacjentów powinna otrzymywać standardowe leczenie interferonem-α i cytarabiną. Jednak wyższość leczenia imatynibem stała się wyraźna już podczas pierwszej oceny okresowej, przy średnim czasie obserwacji wynoszącym 18 miesięcy. Pacjenci leczeni imatynibem mieli dobrą odpowiedź cytogenetyczną (patrz definicje terminów powyżej) 87,1% i pełną odpowiedź cytogenetyczną 76,2%. W grupie interferonu-α / cytarabiny odpowiednie liczby wynosiły 34,7% i 14,5%. W grupie pacjentów leczonych imatynibem 96,7% nie wykazało progresji choroby do fazy przełomu blastycznego / przyspieszenia, podczas gdy w grupie otrzymującej interferon-α / cytarabinę było to 91,5%. Ogólnie leczenie imatynibem było również lepiej tolerowane niż leczenie interferonem α / cytarabiną.
Wyniki te doprowadziły do tego, że większość pacjentów z grupy interferonu-α / cytarabiny przeszła do ramienia leczenia z imatynibem (to skrzyżowanie było dozwolone w ramach badania IRIS ). Ponadto Amerykańska Agencja ds.Żywności i Leków oraz Europejska Agencja Leków (głównie na podstawie wyników badania IRIS ) przyspieszyły dopuszczenie imatynibu do leczenia CML, w wyniku czego wielu pacjentów włączonych do badania IRIS pozostawiony Interferon-α / cytarabina leczył badanie i kontynuował leczenie imatynibem poza badaniem. W związku z tym badanie IRIS zmieniło się z początkowo dwuramiennego badania w czysto obserwacyjne badanie dotyczące leczenia pacjentów z CML imatynibem.
Aktualizacja danych z badania IRIS opublikowana w 2009 roku wykazała przeżycie wolne od progresji u 92 procent pacjentów z medianą czasu obserwacji wynoszącą osiem lat dla pacjentów leczonych imatynibem od samego początku.
Imatinib stał się standardowym lekiem w leczeniu CML po ogłoszeniu wyników badania IRIS . Jednak nadal nie ma zgody co do optymalnej dawki imatynibu. Zwykle stosowana dawka to 400 mg na dobę. Niemieckie badanie dotyczące leczenia CML IV sprawdza, czy dawka dobowa 800 mg jest tolerowana i daje lepsze wyniki. Według wstępnych ocen wydaje się, że starsi pacjenci (≥ 65 lat) osiągają remisję znacznie szybciej przy 800 mg imatynibu niż przy 400 mg leku, za co jednak trzeba zapłacić większymi skutkami ubocznymi. Wniosek z tej analizy był taki, że dawka imatynibu u pacjentów w wieku ≥ 65 lat powinna być większa niż 400 mg na dobę. Wydaje się pewne, że dzienna dawka na ogół nie powinna być znacząco niższa niż 400 mg, ponieważ sprzyja to rozwojowi oporności. W międzyczasie jednak sytuacja uległa zmianie ze względu na fakt, że dostępne są nowsze inhibitory kinazy tyrozynowej drugiej lub trzeciej generacji (patrz poniżej). W aktualnych wytycznych nie jest wyraźnie zalecany żaden konkretny TKI, podano jedynie specyfikacje dotyczące celów terapii, które mają zostać osiągnięte.
Imatynib jest zwykle stosunkowo dobrze tolerowany. Działania niepożądane mogą obejmować nudności i wymioty (rzadko), obrzęki , wysięk opłucnowy i osierdziowy (gromadzenie się płynu w opłucnej lub osierdziu ), zwiększoną aktywność aminotransferaz , skurcze mięśni i wysypki .
Nilotynib i dasatynib: TKI drugiej generacji
Pomimo niezwykłego sukcesu leczenia imatynibem, około 20 do 25 procent pacjentów z CML będzie wymagało alternatywnej terapii w ciągu 5 do 8 lat leczenia imatynibem. Przyczyną tego jest przede wszystkim niewystarczająca skuteczność, utrata skuteczności imatynibu lub nietolerancja imatynibu. W tej sytuacji istnieją dwie główne alternatywy, jedna polega na zmianie na inny inhibitor kinazy tyrozynowej, a druga polega na wykonaniu allogenicznego przeszczepu komórek macierzystych lub szpiku kostnego. Przyczyną utraty skuteczności może być mutacja w obszarze domen kinazy tyrozynowej genu BCR-ABL .
Dwa nowe inhibitory kinazy tyrozynowej drugiej generacji, dazatynib (nazwa handlowa Sprycel ) i nilotynib (nazwa handlowa Tasigna ), zostały obecnie zatwierdzone do leczenia CML w przypadku oporności lub nietolerancji na imatynib. Zarówno dazatynib, jak i nilotynib są znacznie skuteczniejsze w hamowaniu kinazy ABL in vitro, a także przeciw większości oporności na imatynib. Tylko w przypadku mutacji T315I obie substancje są nieskuteczne. Istnieje mutacja genu, która prowadzi do wymiany aminokwasów treonina → izoleucyna w pozycji 315. Reszty izoleucylowe są znacznie większe niż reszty treonylowe, a zatem prawdopodobnie zapobiegają wiązaniu się leku ze specyficznym miejscem wiązania.
Które rozpoczęło się w 2013 r. Niemieckie badanie terapii TIGER (TIGER = T asigna / I nterferon w niem. ) Ustala całkowicie (częściowo na późniejszym etapie w połączeniu z interferonem α) nilotynib. W kontekście tego badania imatynib należy podawać tylko w przypadku nietolerancji nilotynibu, natomiast dazatynib (lub allogeniczny przeszczep komórek macierzystych) należy stosować w przypadku wystąpienia oporności na nilotynib.
TKI trzeciej generacji
Inne niedawne TKI to Bosutinib ( Bosulif ) i ponatynib ( Iclusig ), które zostały zatwierdzone w 2012 roku w Stanach Zjednoczonych do leczenia CML z nietolerancją lub nieskutecznością innych TKI. Kilka miesięcy później został również zatwierdzony w Europie. Szczególnie interesujący jest ponatynib, który jest również skuteczny przeciwko mutacji BCR-ABL T315I.
Odporność na inhibitory kinazy tyrozynowej
Podczas terapii inhibitorami kinazy tyrozynowej czasami występuje zjawisko polegające na tym, że działanie leku jest coraz słabsze i ostatecznie całkowicie zanika. Najwcześniejszym tego wskaźnikiem jest wzrost poziomu BCR-ABL (który jest zwykle mierzony we krwi co trzy miesiące podczas terapii). Jeśli nie zostaną podjęte dalsze działania, choroba rozprzestrzeni się ponownie i przyjmie sposób opisany powyżej . W takich przypadkach mówi się o oporności na lek, na przykład oporności na imatynib lub oporności na nilotynib.
Takie oporności są często spowodowane mutacjami nukleotydów w onkogenie BCR-ABL , które prowadzą do wymiany aminokwasów . Lek nie wykazuje już wtedy żadnego wpływu na zmutowane białko BCR-ABL. Obecnie przyjmuje się, że większość z tych mutacji jest już obecna w małych ilościach na początku terapii, a następnie są wybierane przez terapię (tylko zmutowany, tj. Odporny klon może rosnąć). Jednak niektóre mutacje prawdopodobnie pojawiają się również losowo w przebiegu choroby. W ciągu ostatnich kilku lat scharakteryzowano wiele mutacji BCR-ABL . Klinicznie interesujący jest fakt, że niektóre mutacje BCR-ABL nadają oporność na inhibitor kinazy tyrozynowej, ale są wrażliwe na inne. W takich przypadkach sensowna jest zmiana na inny inhibitor kinazy tyrozynowej. W zgodnym oświadczeniu grupy ekspertów z European LeukemiaNet z 2011 r. Zalecono następującą procedurę wykrywania mutacji podczas terapii imatynibem:
- T315I : przeszczep alogeniczny lub terapia eksperymentalna;
- V299L , T315A , V517L / V / I / C : raczej nilotynib niż dazatynib;
- Y253H , E255K / V , F359V / C / I : raczej dazatynib niż nilotynib;
- każda inna mutacja: wyższa dawka imatynibu lub dazatynibu lub nilotynibu.
Jednak istnieje również zjawisko oporności bez możliwości wykrycia mutacji BCR-ABL . Oczywiście istnieją inne zmiany genetyczne, które nie są jeszcze dobrze poznane. W takiej sytuacji może się przydać zmiana inhibitora kinazy tyrozynowej lub zwiększenie dawki wcześniej podanego.
Cele terapii w terapii TKI
W 2013 roku komitety eksperckie sformułowały rekomendacje dotyczące celów terapeutycznych, które miały zostać osiągnięte. Żaden konkretny TKI (np. Imatynib, nilotynib, dazatynib itp.) Nie był wyraźnie zalecany. Terapeutycznymi celami leczenia inhibitorami kinazy tyrozynowej jest pełna odpowiedź hematologiczna (CHR) najpóźniej po trzech miesiącach, pełna odpowiedź cytogenetyczna (CCyR) najpóźniej po sześciu miesiącach oraz rozległa remisja molekularna (MMR) po 18 miesiącach najnowszy. W przypadku ostrzeżeń zaleca się przeprowadzanie odpowiednio częstszych kontroli (np. Do 1 × miesięcznego pomiaru BCR-ABL ); w przypadku niepowodzenia terapii należy ją zmienić.
| Kryteria oceny skuteczności terapii TKI | |||
|---|---|---|---|
| czas | Optymalne | Ostrzeżenia | Niepowodzenie terapii |
| Czas na diagnozę | Nie dotyczy | Wysokie ryzyko (patrz poniżej oceny ryzyka), dodatkowe aberracje chromosomalne w komórkach Ph + |
Nie dotyczy |
| 3 miesiące od diagnozy |
BCR-ABL ≤ 10% i / lub metafazy Ph + ≤ 35% |
BCR-ABL > 10% i / lub metafazy Ph + 35 do 95% |
brak całkowitej remisji hematologicznej (CHR) i / lub metafaz Ph +> 95% |
| 6 miesięcy od diagnozy |
BCR-ABL ≤ 1% i / lub metafazy Ph + 0% |
BCR-ABL 1 do 10% i / lub metafazy Ph + 1 do 35% |
BCR-ABL > 10% i / lub metafazy Ph +> 35% |
| 12 miesięcy od diagnozy | BCR-ABL ≤ 0,1% | BCR-ABL 0,1% do 1% |
BCR-ABL > 1% i / lub metafazy Ph +> 0% |
| w dowolnym późniejszym czasie | BCR-ABL ≤ 0,1% (MMR) | aberracje klonalne cytogenetyczne | Utrata całkowitej remisji cytogenetycznej i / lub utrata remisji hematologicznej i / lub potwierdzona (!) Utrata rozległej remisji molekularnej (MMR) i / lub dowody mutacji BCR-ABL |
Przeszczep szpiku kostnego lub komórek macierzystych krwi
Allogeniczny przeszczep komórek macierzystych (SCT) (rzadziej szpiku kostnego KMT), zgodnie z obecnym stanem wiedzy, jedyną terapią, która wykazała kompletne leczenie może spowodować. Istnieją również izolowani pacjenci, u których terapia inhibitorami kinazy tyrozynowej prowadzi do tego, że gen fuzyjny BCR-ABL nie jest już wykrywalny . Jednak nie jest tutaj jasne, czy chodzi o prawdziwe wyleczenie, czy tylko zepchnięcie choroby poniżej granicy wykrywalności. Ponieważ im wcześniej przeprowadza się SCT / KMT, rokowanie jest najlepsze, decyzję należy podjąć jak najwcześniej. Problemem tego przeszczepu jest stosunkowo wysoka śmiertelność z powodu powikłań (zwłaszcza ciężkich zakażeń) podczas zabiegu przeszczepu oraz możliwość wystąpienia ciężkich chorób autoagresji po przeszczepie ( choroba przeszczep przeciwko gospodarzowi , GvHD).
Efekt ten może powstać, ponieważ wszystkie komórki krwi i komórki obronne organizmu powstają z komórek macierzystych szpiku kostnego. Tak więc nie tylko zastępowana jest krew, ale przeszczepiane są podstawowe części układu odpornościowego. Podczas gdy w konwencjonalnych przeszczepach można zaobserwować efekt gospodarz kontra przeszczep („biorca kontra przeszczep”), tj. Typową reakcję odrzucenia, można tu zaobserwować przeszczepiony układ odpornościowy skierowany przeciwko nowemu ciału. Z tego powodu SCT / KMT musi być również poprzedzone maksymalnie agresywną chemioterapią , aby jak najdokładniej zniszczyć własny układ odpornościowy organizmu. Ustanowienie nowych komórek macierzystych może zostać poważnie zakłócone przez pozostały układ odpornościowy.
Efekt przeszczep przeciwko gospodarzowi jest nie tylko niekorzystny dla pacjenta: niektórzy biorcy przeszczepu mogą odnieść korzyści z walki z pozostałymi komórkami nowotworowymi dzięki nowemu układowi odpornościowemu. Efekt ten nazywany jest reakcją przeszczep przeciwko białaczce (reakcja GvL).
Przeszczep przeprowadza się tylko wtedy, gdy:
- Pacjenci, u których leczenie imatynibem lub nowszymi inhibitorami kinazy tyrozynowej jest nieskuteczne,
- młodsi pacjenci i
- Pacjenci, dla których można znaleźć zgodnego dawcę (dawcy rodzinni lub osoby trzecie).
Koszty terapii
| lek | Typowa dzienna
dawka |
Codzienne koszty terapii |
|---|---|---|
| Glivec | 400 mg | 113 € |
| Tasigna | 600 mg | 134 € |
| Sprycel | 100 mg | 189 € |
| Roferon A. | 3 × 6 milionów IU (na tydzień) |
31 € |
| Litalir | 1 g | 4,30 € |
| Uwaga: Celem tej tabeli nie jest sugerowanie, że wymienione leki mają równoważne działanie. Tutaj porównuje się tylko koszty terapii. Istnieją duże różnice w skuteczności. | ||
Standardowy lek Imatinib jest dostępny w postaci tabletek w dawkach 100 mg lub 400 mg. Standardowa dawka to 400 mg imatynibu na dobę. Cena w niemieckiej aptece opakowania leku Glivec zawierającego 90 tabletek 400 mg wynosi 10 120,86 EUR (co odpowiada 112,45 EUR za tabletkę). Opakowania Sprycel zawierające 56 tabletek po 50 mg kosztują 5291,92 EUR, co odpowiada dziennej cenie terapeutycznej w wysokości 189 EUR za zwykłą dawkę dobową 100 mg. Tasigna jest dostępna w mocy 150 mg (112 kapsułek) w cenie ok. 3752,26 €, co przy zwykłej dawce dobowej 600 mg wiąże się z kosztami terapii w wysokości 134 €. Koszt leku dla pacjenta z CML wynosi od około 41 200 EUR ( Glivec ), 69 000 EUR ( Sprycel ) do 48 779 EUR ( Tasigna ) rocznie.
Dla porównania: kuracja hydroksymocznikiem (hydroksymocznik, np. Litalir ) w dawce dobowej 1 g powoduje roczne koszty terapii ok . 1600 €, przy czym interferon alfa (np. Roferon 3 × 6 mln IU tygodniowo) kosztuje rocznie ok. 11 500 €.
Fakt, że pięć różnych, wysoce skutecznych inhibitorów kinazy tyrozynowej różnych producentów jest obecnie na rynku (od lipca 2013 r .: Imatinib i Nilotinib firmy Novartis , Dasatinib z Bristol-Myers Squibb , Bosutinib z Pfizer , Ponatinib z Ariad Pharmaceuticals ) spotkał się z krytyką , ale koszty terapii są nadal niebotycznie wysokie, a nawet rosną. W artykule opublikowanym w maju 2013 roku w prestiżowym amerykańskim czasopiśmie Blood , międzynarodowy kolektyw ponad 100 ekspertów wyraźnie skrytykował wysokie ceny nowoczesnych leków przeciwnowotworowych, zwłaszcza na przykładzie CML, i wskazał, że takie ceny nie byłyby dostępne dla każdy system opieki zdrowotnej w perspektywie długoterminowej. Nawet w krajach wysoko rozwiniętych, takich jak Stany Zjednoczone czy Szwecja, istnieje znaczna liczba pacjentów, których ze względu na wysokie koszty leków nie stać na taką terapię i przez to mają gorsze przeżycie. Spośród około 1,2 do 1,5 miliona osób cierpiących na CML na całym świecie, tylko około 235 000 do 250 000, czyli 20 do 25%, jest leczonych standardowym lekiem imatynibem, co jest w dużej mierze spowodowane wysokimi kosztami terapii. Zwrócono również uwagę, że między różnymi krajami występują znaczne różnice cen. Roczne koszty leczenia imatinibem podano dla różnych krajów (w 1000 USD): USA 92, Niemcy 54, Wielka Brytania 34, Francja 40, Włochy 31, Korea Południowa 29, Japonia 43, Rosja 24. Głównym powodem różne koszty były różne Specyfikacje prawne, które doprowadziły do różnych swobód w ustalaniu cen producenta.
Spór prawny pomiędzy firmą Novartis a Indiami dotyczący ważności ochrony patentowej Glivec (Imatinib) w Indiach również spotkał się z dużym zainteresowaniem międzynarodowym . Ostatecznie Novartis został ostatecznie pokonany 1 kwietnia 2013 r. Przed Sądem Najwyższym w Indiach, w wyniku czego imatinib jest również dostępny jako lek generyczny od innych producentów w Indiach .
Koszty allogenicznego przeszczepu komórek macierzystych, w tym leczenia następczego, szacuje się na około 150 000 EUR, chociaż liczba ta dotyczy tylko natychmiastowego leczenia następczego. Jeśli później pojawią się powikłania, takie jak przewlekła choroba przeszczep przeciwko gospodarzowi , rzeczywiste koszty całkowite mogą być znacznie wyższe. Nierzadko zdarza się, że pacjenci po przeszczepach tracą zdolność do pracy i / lub zatrudnienia, tak że „ekonomiczne” koszty całkowite są znacznie wyższe.
prognoza
| Wynik | uwzględnione parametry kliniczne i krwi |
Łącze internetowe do obliczeń |
|---|---|---|
| Wynik EUTOS | Wielkość śledziony bazofile |
eutos.org |
| Wynik Sokala Hasforda | Wiek Płytki krwi Rozmiar śledziony Bazofile Eozynofile Mieloblasty |
leukemia-net.org |
Wskaźniki przeżycia w ujęciu historycznym
Zanim leki były dostępne, CML była chorobą z grupy neoplazji mieloproliferacyjnej (MPN) o najgorszym rokowaniu. Mediana przeżycia pacjentów bez leczenia CML było tylko około trzech do czterech lat. Hydroksykarbamid doprowadził do niewielkiej poprawy do około 4½ roku, a interferon doprowadził następnie do dalszej poprawy mediany przeżycia do około 5½ roku.
Obecnie wskaźniki pięcioletniego przeżycia przy leczeniu imatynibem wynoszą około 90 procent lub nawet więcej. Nawet przy ponad 10-letnim okresie obserwacji pacjentów leczonych imatynibem „średni punkt końcowy przeżycia” nie został jeszcze osiągnięty.
Przeszczep komórek macierzystych w CML
Dziesięcioletnie przeżycie pacjentów leczonych imatynibem jest znacznie wyższe niż po przeszczepie komórek macierzystych , gdzie wskaźniki przeżycia są historycznie podawane na poziomie około 55 procent po dziesięciu latach (patrz tabela ocen ryzyka). W przypadku przeszczepów komórek macierzystych znaczna liczba pacjentów umiera w wyniku intensywnego leczenia, ciężkich infekcji lub choroby przeszczep przeciwko gospodarzowi . Pacjenci, którzy przeżyli po przeszczepie komórek macierzystych, również często borykają się z problemem przewlekłej choroby przeszczep przeciwko gospodarzowi, tak że nie muszą już przyjmować imatynibu, ale zamiast tego muszą przyjmować inne leki przeciwko chorobie GvH.
Obecnie nie ma więc już uzasadnienia, jak w przeszłości, wysyłania pacjentów z CML do przeszczepu bezpośrednio po postawieniu diagnozy. Jednak sensowne może być wykonanie przeszczepu u poszczególnych pacjentów wysokiego ryzyka w przebiegu choroby, jeśli np. Nie reagują na leczenie imatynibem lub innymi inhibitorami kinazy tyrozynowej i poza tym są w dobrym stanie ogólnym. Po dziesięciu latach 40 procent grup wysokiego ryzyka nadal żyje dzięki terapii interferonem-α, tylko 20 procent grup wysokiego ryzyka.
Całkowite wyleczenie bez przeszczepu komórek macierzystych?
Zgodnie z konwencjonalną opinią, całkowitego wyleczenia w sensie całkowitego zniknięcia onkogenu BCR-ABL nie można w większości przypadków osiągnąć ani wcześniejszymi inhibitorami kinazy tyrozynowej (imatynib, nilotynib, dazatynib), ani interferonem-α. Są pacjenci, u których imatynib lub nilotynib działają tak dobrze, że onkogenu BCR-ABL nie można już wykryć nawet najbardziej czułymi metodami pomiarowymi. W pojedynczych przypadkach nie jest jasne, czy tych pacjentów można uznać za wyleczonych, czy też czułość pomiaru metody badania jest po prostu niewystarczająca do wykrycia kilku pozostałych komórek CML. Dlatego w tej chwili generalnie nie zaleca się w takich przypadkach pomijania leku w niekontrolowany sposób, ponieważ obawia się nawrotu choroby.
Trwają badania kliniczne, w których między innymi bada się, czy ostatnie pozostałe komórki macierzyste CML można wyeliminować, a tym samym całkowicie wyleczyć pacjenta opisanymi powyżej negatywnymi skutkami BCR-ABL metodami immunoterapeutycznymi ( np. Interferon). Wspomniane powyżej niemieckie badanie terapii TIGER, rozpoczęte w 2013 roku, bada to podejście terapeutyczne. Plan zakłada leczenie pacjentów przede wszystkim nilotynibem (aw niektórych przypadkach także interferonem). W przypadku pacjentów, którzy osiągnęli całkowitą remisję molekularną trwającą dłużej niż 2 lata, należy podjąć próbę całkowitej eliminacji - oczywiście z dalszym ciągłym monitorowaniem molekularnym - w celu sprawdzenia, czy pacjenci są trwale wyleczeni.
literatura
- Bubnoff, Nikolas von; Duyster, Justus: Przewlekła białaczka szpikowa: terapia i monitorowanie . W: Dtsch Arztebl Int . Nie. 107 (7) , 2010, s. 114-121 ( streszczenie ).
- Ludwig Heilmeyer , Herbert Begemann: krew i choroby krwi. W: Ludwig Heilmeyer (Hrsg.): Podręcznik chorób wewnętrznych. Springer-Verlag, Berlin / Göttingen / Heidelberg 1955; Wydanie drugie tamże 1961, s. 376-449, tu: s. 424-426: Die chronisch-myeloische Leukemia (chronic-leukemic melosis).
linki internetowe
- Informacje o chorobie CML. CML-Info.com
- Onkologia, hematologia - dane i informacje. CML ONKODIN
- Informacje od pacjentów dla pacjentów. Białaczka online
- Przewodnik po przewlekłej białaczce szpikowej
Indywidualne dowody
- ↑ Wytyczne dotyczące przewlekłej białaczki szpikowej. German Society for Hematology and Oncology (DGHO), wrzesień 2013, dostęp 19 marca 2016 .
- ↑ Junia V. Melo, David J. Barnes: Przewlekła białaczka szpikowa jako model ewolucji choroby w przypadku raka u ludzi . W: Nature Reviews Cancer . taśma 7 , 2007, s. 441-453 , PMID 17522713 ( nature.com [dostęp 8 sierpnia 2011]).
- ↑ a b Arkusze informacyjne SEER Stat: Przewlekła białaczka szpikowa. Surveillance, Epidemiology and End Results (SEER), dostęp 2 czerwca 2011 r. (Na podstawie danych z lat 2004-2008).
- ↑ CA Schiffer: BCR-ABL Inicjatory kinazy tyrozynowej w przewlekłej białaczce szpikowej. W: N Engl J Med . 2007; 357, strony 258-265. PMID 17634461
- ↑ Dane dla Niemiec są na podstawie szacunków Competence Network ostrego i przewlekłego białaczki odsyłaczy , dane dla Austrii i Szwajcarii szacowane są proporcjonalnie do niemieckich liczbach
- ↑ a b c A. Hochhaus: Przewlekła białaczka szpikowa (CML). W: S. Seeber, J. Schütte (red.): Therapy Concepts Oncology . Springer-Verlag, Heidelberg 2007, ISBN 978-3-540-28588-5 , s. 293.
- ^ A b D. G. Savage i wsp .: Objawy kliniczne w momencie rozpoznania u 430 pacjentów z przewlekłą białaczką szpikową obserwowanych w ośrodku referencyjnym przez 16 lat. W: Br J Haematol . 1997; 96, str. 111-116. PMID 9012696 .
- ↑ ze starożytnej greki χλωρός chlōrós „blady / jasnozielony, zielono-żółty”. Nacieki wydają się lekko zielone, gdy są przetwarzane przez patologa.
- ↑ European LeukemiaNet: zalecenia dotyczące CML
- ↑ a b c R. Hehlmann, H. Heimpel, J. Hasford, HJ Kolb, H. Pralle, DK Hossfeld, W. Queisser, H. Löffler, A. Hochhaus, B. Heinze et al.: Randomized porównanie interferonu- alfa z busulfanem i hydroksymocznikiem w przewlekłej białaczce szpikowej. Niemiecka Grupa Badawcza CML. W: Blood. 1994; 84 (12), str. 4064-4077. PMID 7994025 .
- ^ A b SG O'Brien, F. Guilhot, RA Larson, I. Gathmann, M. Baccarani, F. Cervantes, JJ Cornelissen, T. Fischer, A. Hochhaus, T. Hughes, K. Lechner, JL Nielsen, P Rousselot, J. Reiffers, G. Saglio, J. Shepherd, B. Simonsson, A. Gratwohl, JM Goldman, H. Kantarjian, K. Taylor, G. Verhoef, AE Bolton, R. Capdeville, BJ Druker; Badacze IRIS: imatynib w porównaniu z interferonem i niskimi dawkami cytarabiny w nowo zdiagnozowanej przewlekłej białaczce szpikowej w fazie przewlekłej. W: N Engl J Med.2003 ; 348, strony 994-1004. PMID 12637609
- ↑ Infopage FDA Gleevec (Imatinib Mesylate) , zwłaszcza historia dotycząca przepisów, w tym listy zatwierdzające i recenzje od Drugs @ FDA
- ↑ European Public Assessment Report (EPAR): Glivec of the European Medicines Agency (pdf)
- ↑ M. Baccarani, J. Cortes, F. Pane, D. Niederwieser, G. Saglio, J. Apperley, F. Cervantes, M. Deininger, A. Gratwohl, F. Guilhot, A. Hochhaus, M. Horowitz, T. Hughes, H. Kantarjian, R. Larson, J. Radich, B. Simonsson, RT Silver, J. Goldman, R. Hehlmann; European LeukemiaNet: Przewlekła białaczka szpikowa: aktualizacja koncepcji i zaleceń dotyczących postępowania w European LeukemiaNet. J Clin Oncol . 2009; 27 (35), s. 6041-6051. PMID 19884523
- ↑ U. Proetel, N. Pletsch, M. Lauseker, MC Müller, B. Hanfstein, SW Krause, L. Kalmanti, A. Schreiber, D. Heim, GM Baerlocher, WK Hofmann, E. Lange, H. Einsele, M. Wernli, S. Kremers, R. Schlag, L. Müller, M. Hänel, H. Link, B. Hertenstein, M. Pfirrman, A. Hochhaus, J. Hasford, R. Hehlmann, S. Saußele; Niemiecka Grupa Badawcza ds. Przewlekłej Białaczki Szpikowej; Swiss Working Group for Clinical Cancer Research (SAKK): Starsi pacjenci z przewlekłą białaczką szpikową (≥65 lat) odnoszą większe korzyści z wyższych dawek imatynibu niż młodsi pacjenci: podanaliza randomizowanego badania IV CML W: Ann Hematol. Lipiec 2014; 93 (7), s. 1167–1176. PMID 24658964 .
- ↑ a b c M. Baccarani, MW Deininger, G. Rosti, A. Hochhaus, S. Soverini, JF Apperley, F. Cervantes, RE Clark, JE Cortes, F. Guilhot, H. Hjorth-Hansen, TP Hughes, HM Kantarjian, DW Kim, RA Larson, JH Lipton, FX Mahon, G. Martinelli, J. Mayer, MC Müller, D. Niederwieser, F. Pane, JP Radich, P. Rousselot, G. Saglio, S. Saußele, C. Schiffer, R. Silver, B. Simonsson, JL Steegmann, JM Goldman, R. Hehlmann: Zalecenia European LeukemiaNet dotyczące postępowania w przewlekłej białaczce szpikowej: 2013. W: Blood. 2013; 122 (6), s.872-884. doi: 10.1182 / blood-2013-05-501569 . PMID 23803709 .
- ↑ H. de Lavallade, JF Apperley, JS Khorashad, D. Milojkovic, AG Reid, M. Bua, R. Szydlo, E. Olavarria, J. Kaeda, JM Goldman, D. Marin: Imatinib dla nowo zdiagnozowanych pacjentów z przewlekłą chorobą szpikową białaczka: częstość występowania trwałych odpowiedzi w analizie z zamiarem leczenia. W: J Clin Oncol. 10 lipca 2008; 26 (20), s. 3358-3363. PMID 18519952
- ↑ M. Talpaz i wsp.: Dasatynib w białaczkach z dodatnim chromosomem Philadelphia opornym na imatinib. W: N Engl J Med. 2006; 354, str. 2531-2541. PMID 16775234
- ↑ H. Kantarjian i wsp .: Nilotynib w CML opornej na imatynib i ALL z chromosomem Philadelphia. W: N Engl J Med. 2006; 354, strony 2542-2551. PMID 17715389
- ↑ a b A. Hochhaus, T. Ernst, J, Ziermann, E. Eigendorff, P. La Rose: Przewlekła białaczka szpikowa. W: Onkolog. 2012; 18, strony 1108-1114. Wydawnictwo Springer
- ↑ Ponatynib: inhibitor pan-BCR-ABL. ARIAD, dostęp 13 sierpnia 2011 .
- ↑ T. O'Hare, CA Eide, MW Deininger: mutacje domeny kinazy Bcr-Abl, lekooporność i droga do wyleczenia przewlekłej białaczki szpikowej. W: Blood. 1 października 2007; 110 (7), s. 2242-2249. PMID 17496200
- ↑ S. Branford, JV Melo, TP Hughes: Wybór optymalnej terapii inhibitorem kinazy tyrozynowej drugiej linii u pacjentów z przewlekłą białaczką szpikową po niepowodzeniu imatinibu: czy status mutacji BCR-ABL naprawdę ma znaczenie? W: Blood. 24 grudnia 2009; 114 (27), s.5426-5435. PMID 19880502
- ↑ T. O'Hare, CA Eide, MWN Deininger: mutacje domeny kinazy Bcr-Abl, lekooporność i droga do wyleczenia przewlekłej białaczki szpikowej. W: Blood. 2007; 110 (7), s. 2242-2249. PMID 17496200
- ^ S.Redaelli, R. Piazza, R. Rostagno i wsp .: Aktywność bosutynibu, dazatynibu i nilotynibu przeciwko 18 opornym na imatynib mutantom BCR / ABL. W: J Clin Oncol. 2009; 27 (3), s. 469–471. PMID 19075254
- ↑ S. Soverini, A. Hochhaus, FE Nicolini, F. Gruber, T. Lange, G. Saglio, F. Pane, MC Müller, T. Ernst, G. Rosti, K. Porkka, M. Baccarani, NC Cross, G. Martinelli: Analiza mutacji domeny kinazy BCR-ABL u pacjentów z przewlekłą białaczką szpikową leczonych inhibitorami kinazy tyrozynowej: zalecenia panelu ekspertów w imieniu European LeukemiaNet. W: Blood. 2011; 118 (5), s. 1208-1215. doi: 10.1182 / blood-2010-12-326405 . PMID 21562040 .
- ↑ a b c d Glivec 400 mg tabletki powlekane. Źródło 24 listopada 2020 r .
- ↑ a b „Primum non nocere” i dążenie przemysłu farmaceutycznego do zysku - nierozwiązywalna sprzeczność w onkologii? W: Der Arzneimittelbrief Tom 46, nr 5, maj 2013.
- ↑ a b Eksperci od przewlekłej białaczki szpikowej: Cena leków na przewlekłą białaczkę szpikową (CML) jest odzwierciedleniem niezrównoważonych cen leków przeciwnowotworowych: z perspektywy dużej grupy ekspertów CML. W: Blood. 2013; 121 (22), s. 4439-4442. PMID 23620577
- ↑ Sprawa patentowa Glivec w Indiach. Pobrano 3 kwietnia 2014 r. (W języku angielskim, prezentacja przypadku z punktu widzenia firmy Novartis).
- ↑ ODWOŁANIA CYWILNE Nr. 2706-2716 OF 2013. (Nie jest już dostępne w Internecie). Sąd Najwyższy Indii, 1 kwietnia 2013 r., Archiwum z oryginału 7 kwietnia 2014 r . ; dostęp 3 kwietnia 2014 .
- ↑ A.Burchert, MC Müller, P. Kostrewa, P. Erben, T. Bostel, S. Liebler, R. Hehlmann, A. Neubauer, A. Hochhaus: Trwała odpowiedź molekularna z podtrzymaniem interferonu alfa po terapii indukcyjnej imatynibem z interferonem alfa u pacjentów z przewlekłą białaczką szpikową. W: J Clin Oncol. 2010; 28 (8), s.1429-1435. PMID 20142590 .

