Elongation (tłumaczenie)
| Rodzic |
| Tłumaczenie |
| Ontologia genów |
|---|
| QuickGO |
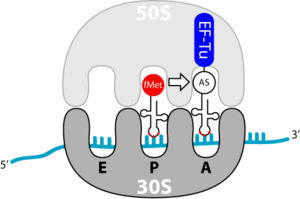
Wydłużenie w translacyjnych traktowane proces przedłużenie aminową łańcucha kwasu podczas biosyntezy tych białek ; zachodzi w miejscu rozpoznania i wiązania rybosomu . Pojedynczy etap elongacji obejmuje trzy etapy: wiązanie załadowanego tRNA , tworzenie wiązania peptydowego i przygotowanie do następnego etapu elongacji. Powtarza się to aż do osiągnięcia kodonu końcowego .
Wiązanie aminoacylowego tRNA w pozycji A.
Wydłużenie zaczyna się od wiązania załadowanego tRNA w miejscu A. Proces ten opiera się na transporcie przez współczynnik wydłużenia Tu ( EF-Tu ). To znowu jest białko G. EF-Tu ma dwa ważne zadania:
- Ochrona wiązania estrowego między 3'-OH tRNA i transportowanym aminokwasem
- samo-uwalnianie, gdy prawidłowe tRNA związało się z sekwencją kodonów miejsca A rybosomu.
Wyładowanie jest wynikiem hydrolizy związanego GTP. Może to mieć miejsce tylko wtedy, gdy rybosom i tRNA są prawidłowo sparowane, tj. Jeśli prawidłowe tRNA znajduje się w rybosomie. Nieprawidłowe tRNA nie może oddzielić się od EF-Tu, co gwarantuje włączenie prawidłowego aminokwasu.
Warto również zauważyć, że EF-Tu może rozpoznać każde tRNA, z wyjątkiem inicjującego tRNA, fmet-tRNA. Zapewnia to, że metionina jest włączona do wewnętrznych kodonów AUG, a nie fMet.
Tworzenie wiązania peptydowego
Jest to krok spontaniczny, ze względu na warunki przestrzenne między aminokwasami i większą siłę wiązania wiązania peptydowego w porównaniu z wiązaniem estrowym (między tRNA i AS). Tutaj wiązanie peptydowe jest tworzone między grupą karboksylową ( C -termius) istniejącego łańcucha peptydowego i grupą aminową ( N -termius) nowego aminokwasu. Łańcuch peptydowy rośnie od N - do C -termius. 28S rRNA ma katalityczną aktywność w reakcji; dlatego rybosom jest rybozymem. Reakcja przerywa wiązanie między formylometioniną i inicjatorem tRNA. Inicjator tRNA jest uwalniany, a na drugim tRNA tworzony jest dipeptyd . Peptyd pozostaje w miejscu P w 50S UE (podjednostce) rybosomu, ale 30S UE z mRNA i dwoma tRNA są nadal w pozycji wyjściowej.
Powodem formylowania w metioninę na grupie aminowej, grupy ( N -Termius) może być teraz widoczne. Dipeptyd, który powstaje po pierwszej rundzie wydłużania, ma możliwość zamknięcia pierścienia. Azot metioniny miałby możliwość ataku nukleofilowego na karboksylowy atom węgla drugiego aminokwasu. Dipeptyd odłączyłby się od tRNA i w ten sposób zakończyłoby się wydłużanie.
Przywracanie sytuacji początkowej
Translokacja (ruch) wyładowanego inicjatora i drugiego tRNA jest przeprowadzana przez współczynnik elongacji-G (EF-G). Ma to podobieństwo molekularne do kompleksu EF-Tu-tRNA. Uważa się, że EF-G, podobnie jak EF-Tu, łączy się z UE 50S. Dolna część EF-G przypomina tRNA, więc interakcja z 30S UE jest oczywista. Ponieważ EF-G jest z kolei białkiem G, ulega zmianie konformacyjnej podczas hydrolizy GTP, czyli zmienia swoją strukturę. W rezultacie część podobna do tRNA migruje w kierunku wnętrza rybosomu i „wypycha” dwa tRNA o jedną pozycję dalej. Inicjator tRNA znajduje się teraz w miejscu E, drugi tRNA w miejscu P. Wraz z dysocjacją EF-G ponownie osiągany jest stan początkowy. Nowe tRNA może wiązać się z miejscem A i promować wzrost łańcucha peptydowego.
literatura
- Kapp LD, Lorsch JR: Mechanika molekularna translacji eukariotycznej . W: Annu. Rev. Biochem. . 73, 2004, strony 657-704. doi : 10.1146 / annurev.biochem.73.030403.080419 . PMID 15189156 .
linki internetowe
- M. Anand, BA Balar, S. Gross, PA Ortiz, S. Ozturk, YR Pittman, R. Ulloque, TG Kinzy: Eukariotic Translation Elongation . W: Reactome - wyselekcjonowana baza wiedzy o biologicznych szlakach. 13, 2005, doi : 10.3180 / REACT_1477.1 .