insulina
| insulina | ||
|---|---|---|

| ||
| Dwie reprezentacje modelowe cząsteczki insuliny. Po lewej prosta cząsteczka (monomer) jako model kopuły, z której wyłania się kształt powierzchni. Po prawej sześciokrotna cząsteczka (heksamer) jako tzw. model wstęgowy , w którym struktura wewnętrzna staje się klarowna. W tym ostatnim przypadku helisy α są reprezentowane przez śruby, a arkusze β za pomocą strzałek. | ||
|
Istniejące strukturalnych danych : 1ai0 , 3ins , 4 cale , 6 ins , 7ins , 9ins | ||
| Właściwości białka ludzkiego | ||
| Masa /długość pierwotna struktura | 5,8 kDa / 51 aminokwasów | |
| Struktura drugorzędowa do czwartorzędowej | Heterodimer (21 + 30 aa) | |
| Prekursor | Proinsulina | |
| Identyfikator | ||
| Nazwa genu | DO | |
| Identyfikatory zewnętrzne | ||
| Informacje o narkotykach | ||
| Kod ATC | A10 AB01 | |
| DrugBank | DB00030 | |
| Występowanie | ||
| Rodzina homologiczna | CLU_140421_1_0 | |
| Takson nadrzędny | Kręgowce | |
| Ortolog | ||
| osoba | mysz | |
| Entrez | 3630 | 16334 |
| Ensemble | ENSG00000129965 | ENSMUSG00000000215 |
| UniProt | P01308 | Q5EEX1 |
| Refseq (mRNA) | NM_000207 | NM_008387 |
| Refseq (białko) | NP_000198 | NP_032413 |
| Locus genów | Chr 11: 2,14 - 2,14 Mb | Chr 7: 142,49 - 142,49 Mb |
| Wyszukiwanie w PubMed | 3630 |
16334
|
Insuliny (inne nazwy: insulinum , hormonu insuliny , wysepka hormonów ) jest proteohormone (polipeptyd hormonu ), który jest niezbędny dla wszystkich kręgowców i jest utworzony w beta komórkach w trzustce . Te wyspecjalizowane komórki znajdują się na Wyspach Langerhansa . Nazwa „insulina” pochodzi od tych wysp (od łacińskiego insula „wyspa”). Insulina bierze udział w regulacji metabolizmu, zwłaszcza węglowodanów. Insulina obniża poziom cukru we krwi poprzez stymulowanie komórek w organizmie do pobierania glukozy z krwi .
Funkcja i efekt
Stężenie glukozy we krwi jest regulowane przez obwód kontrolny złożony z dwóch hormonów, które są uwalniane w zależności od stężenia cukru we krwi. Insulina jest jedynym hormonem, który może obniżać poziom cukru we krwi. Jego antagonistą jest glukagon , którego głównym zadaniem jest zwiększenie poziomu cukru we krwi. Nawet adrenalina , kortyzol i hormony tarczycy mają działanie zwiększające poziom glukozy.
Poziom cukru we krwi wzrasta zwłaszcza po spożyciu pokarmów bogatych w węglowodany . W odpowiedzi komórki β uwalniają insulinę do krwi . Insulina obniża poziom cukru we krwi poprzez umożliwienie przechodzenia glukozy z osocza krwi i płynu tkankowego przez błonę komórkową do wnętrza komórki za pomocą jej „kluczowej funkcji” . W szczególności komórki wątroby i mięśni mogą w krótkim czasie wchłonąć duże ilości glukozy i przechowywać ją w postaci glikogenu lub rozłożyć w celu produkcji energii (patrz glikoliza ).
Hormon oddziałuje również na inne komórki, dzięki czemu ma wpływ na metabolizm tłuszczów i aminokwasów oraz równowagę potasową .
Hormon jest niezbędnym czynnikiem w następujących chorobach:
Insulina krążąca we krwi działa poprzez wiązanie się z receptorami insuliny.
Receptor insuliny
Ostatecznie, wiązanie hormon wyzwalacze do jego receptora , wiele kinaz - kaskady (kaskady fosforylacji z) przechodzącej przez ścieżki sygnałowe mogą być opisane.
Te szlaki sygnałowe powodują spadek poziomu glukozy we krwi
- Promocja wychwytu glukozy ( GLUT4 - translokacja na powierzchnię komórki)
- Wspomaga magazynowanie glukozy ( syntezę glikogenu ) w wątrobie i mięśniach
Sygnał ten jest wspierany przez aktywację szlaków zużywania glukozy. Dalsze środki wspomagające polegają na tłumieniu szlaków dostarczania glukozy, na przykład poprzez rozkład drugiego przekaźnika cAMP przez fosfodiesterazę .
Wychwyt glukozy w tkance mięśniowej
Hormon zwiększa przepuszczalność (przepuszczalność) błony komórkowej dla glukozy w mięśniach i tkance tłuszczowej . Należy zauważyć, że to nie sama błona staje się bardziej przepuszczalna, ale aktywuje się więcej białek nośnikowych dla glukozy. Tym białkiem nośnikowym jest GLUT4, zależny od insuliny transporter glukozy o wysokim powinowactwie, który transportuje glukozę do komórki poprzez ułatwioną dyfuzję (transport bierny). Następujące właściwości fizyczne są istotne dla GLUT4: nasycenie , brak aktywacji lub nieaktywności, tj. regulacja tylko poprzez inkorporację lub ekspansję zależną od insuliny.
Wychwyt i metabolizm glukozy w mózgu
Komórki nerwowe (i erytrocyty ) pobierają glukozę-insulinę, od której nie zależy. Dlatego, gdy poziom insuliny wzrasta, komórki insulinozależne pobierają więcej glukozy, a mniej pozostaje dla komórek niezależnych od insuliny.
Ogólnie istnieje ryzyko uszkodzenia glukozo-zależnego układu nerwowego z hipoglikemią . Insulina, podawana w postaci aerozolu do nosa w bezpośrednim kontakcie z OUN , jest badana pod kątem leczenia choroby Alzheimera .
Nagromadzenie i rozpad tkanki tłuszczowej
Hormon hamuje lipolizę w tkance tłuszczowej, a tym samym rozkład tłuszczu . Niedobór insuliny prowadzi zatem do zwiększonej lipolizy z powstawaniem ciał ketonowych i wynikającą z tego ketozą .
Promuj wzrost komórek
Inną centralną funkcją peptydowego hormonu insuliny jest regulacja wzrostu i proliferacji komórek poprzez aktywację transkrypcji genów mających duże znaczenie dla kontroli i przebiegu cyklu komórkowego. To działanie insuliny jest przedmiotem dyskusji na temat preparatów insulinowych .
Wychwyt tryptofanu w mózgu
Wyższe poziomy insuliny mają nieco większy wpływ na wchłanianie tryptofanu w mózgu.
Insulina a regulacja poziomu cukru we krwi
Jednym z najważniejszych biologicznych efektów insuliny jest szybkie przyspieszenie wychwytu glukozy w komórkach mięśniowych i tłuszczowych oraz regulacja pośredniego magazynowania w wątrobie w ramach regulacji poziomu cukru we krwi :
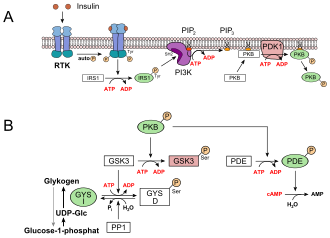
- Węglowodany przyjmowane z pożywieniem są magazynowane jako glikogen w wątrobie i mięśniach . Prowadzi to do obniżenia stężenia glukozy we krwi. Wychwyt glukozy w komórkach wątroby odbywa się niezależnie od insuliny poprzez GLUT2. Receptorowa kinaza tyrozynowa (RTK) jest aktywowana przez insulinę , która inicjuje transdukcję sygnału. Receptor insuliny podłoże 1 (IRS1), przy czym fosfoinozytydu 3-kinazy fosfatydyloinozytolu (PI3K), przy czym drugi przekaźnik fosfatydylo-4,5-bisfosforan (PIP 2 ) zależny od fosfoinozytydu kinazy-1 (PDK1) i wreszcie białkiem kinazę zaangażowany B (PKB) (patrz rysunek, A). PKB fosforyluje kinazę syntazy glikogenu 3 , GSK3, która jest w ten sposób inaktywowana. GSK3 jest kinazą, która fosforyluje syntazę glikogenu, a tym samym ją dezaktywuje (GYS b ). Inhibitory GSK3 konkuruje z fosfatazą , fosfatazy białkowej 1 (PS1). Ponieważ GSK3 nie mogą już pracować, nie ma bardziej syntazy glikogenu w zdefosforylowano postaci (GYS A , patrz rysunek poniżej, B). PKB aktywuje również fosfodiesterazę, PDE, która hydrolizuje cAMP do AMP. W rezultacie tracona jest również ścieżka sygnałowa dla kinazy białkowej A , która jest odpowiedzialna za rozkład glikogenu.
- Pod wpływem insuliny stymulowana jest synteza trójglicerydów w wątrobie, tkance tłuszczowej i mięśniach . Oprócz węglowodanów substratami do tego są lipidy spożywane z pożywieniem .
- W trzech wymienionych tkankach aminokwasy są w coraz większym stopniu wchłaniane i wykorzystywane do syntezy białek.
Te przemiany i mitogennego działania insuliny są inicjowane przez wiązanie się ze swoim receptorem na powierzchni komórek docelowych tkankach, wątroby, mięśni i tłuszczu.
- Insulina indukuje również syntezę i magazynowanie glikogenu w wątrobie i mięśniach, syntezę trójglicerydów w wątrobie i tkance tłuszczowej oraz magazynowanie aminokwasów w mięśniach.
- Jednocześnie insulina hamuje glukoneogenezę wątrobową i dlatego jest jednym z najważniejszych regulatorów metabolizmu glukozy .
Przeciwnik
Jeśli poziom cukru we krwi w organizmie spadnie poniżej wartości 80 mg/dl, produkcja insuliny jest już znacznie zmniejszona.
Jeśli poziom cukru we krwi nadal spada, pojawiają się różni przeciwnicy insuliny:
Poziomy tych przeciwregulujących hormonów znacznie wzrastają, gdy poziom cukru we krwi spada poniżej 60 mg/dl.
W cukrzycy typu 1 mechanizm kontrregulacji jest często zaburzony, co prowadzi do dodatkowych problemów z hipoglikemią .
Somatostatyna działa hamująco na wydzielanie insuliny i glukagonu, ponieważ działa jako ogólny inhibitor w organizmie.
Wpływ na poziom potasu
Insulina obniża poziom potasu we krwi poprzez zapewnienie przemieszczenia potasu do wnętrza hepatocytów i komórek mięśni szkieletowych , czyli z zewnątrzkomórkowego do wewnątrzkomórkowego . Odbywa się to poprzez aktywację ATPazy sodowo-potasowej za pomocą insuliny. Dlatego preparaty insuliny są stosowane razem z glukozą (w celu zapobiegania hipoglikemii ) w leczeniu hiperkaliemii .
Występowanie
Znane są sekwencje insuliny z ponad 100 różnych gatunków . Te sekwencje białkowe odpowiednich insulin podobne - wykazują homologię sekwencji - ale nie są identyczne. O różnicach w budowie chemicznej insuliny ludzkiej w porównaniu z insulinami niektórych ssaków oraz informacje na temat insuliny wytwarzanej sztucznie patrz preparat insuliny .
Insulina i ewolucja : Genotypy, które zapobiegały szybkiemu wyczerpywaniu się rezerw energetycznych w społeczeństwach łowiecko-zbierackich, gdy brakowało pożywienia, predysponują do otyłości i cukrzycy typu 2 w dzisiejszym stylu życia z brakiem ruchu i nadmiarem pożywienia .
Zakres, w jakim geny wpływają na metabolizm glukozy i związane z tym skutki insuliny, nie zostały jeszcze w pełni wyjaśnione.
Te homologi insuliny u owadów są Drosophila insuliny, takie jak peptydy .
Edukacja, przechowywanie, uwalnianie i regulacja
biosynteza
Hormon jest syntetyzowany w komórkach beta wysepek Langerhansa w trzustce . Genetyczne informacje kodowane tylko przez jeden locus genu w krótkim ramieniu z chromosomu 11 . Gen składa się z około 300 nukleotydów .
MRNA najpierw przetłumaczony na preproinsuliny , który składa się z 110 aminokwasów, na rybosomach znajdujących się szorstkiej siateczki śródplazmatycznej (ER) .
Dalsza obróbka odbywa się w dwóch etapach, po fałdowania w cząsteczkę przez utworzenie mostkami disiarczkowymi , że cząsteczka insuliny jest utworzony przez odszczepienie z peptydem sygnałowym i peptydem C.
|

Przetwarzanie preproinsuliny na insulinę
|
składowanie
Cząsteczki insuliny są w pęcherzykach w aparacie Golgiego , który znajduje się w błonie komórkowej komórek beta przez cynk - jonów do heksamerów związane i przechowywane tak stabilizowanego insuliny cynkowej (kompleks).
Zdolność cząsteczek insuliny do wiązania cynku ma kilka ważnych skutków. Insulina nie jest jeszcze skuteczna w postaci heksamerów i po rozbiciu na dimery , ale tylko jako pojedyncza cząsteczka. Ta właściwość odgrywa ważną rolę w preparatach insulinowych . W przypadku szybko działających preparatów insuliny powolny rozpad zespołów molekularnych jest niepożądany i poszukuje się możliwości przyspieszenia rozpadu. W przypadku preparatów insuliny długodziałającej wiązanie cynku jest szczególnie wzmacniane przez wysokie stężenia cynku w celu przedłużenia czasu działania . Podczas opracowywania doustnych preparatów insuliny wiązanie cynkowe jest wykorzystywane do sprzęgania insuliny w celu transportu cząsteczek.
dystrybucja

Uwalnianie insuliny do krwi następuje poprzez egzocytozę .
Insulina jest uwalniana w sposób oscylacyjny . Insulina jest uwalniana do krwiobiegu co trzy do sześciu minut . Po spożyciu pokarmu u zdrowych metabolicznie można zaobserwować dwufazowy przebieg wydzielania insuliny: pierwszy „ szczyt insuliny ” osiąga szczyt po trzech do pięciu minutach i trwa dziesięć minut. Po tym następuje druga faza, która trwa tak długo, jak utrzymuje się hiperglikemia . Pierwsza faza składa się z zmagazynowanych cząsteczek insuliny, druga faza głównie z nowo powstałej insuliny.
Peptyd C jest wycinany z proinsuliny przez peptydazy tylko wtedy, gdy poziom cukru we krwi wzrasta i jest uwalniany wraz z aktywną insuliną i cynkiem. Poprzez wykrywanie peptydu C w surowicy można zmierzyć endogenną produkcję insuliny. Na przykład w przypadku diabetyków można stwierdzić, ile insuliny nadal wytwarza sam organizm, ponieważ syntetyczny produkt nie zawiera sekwencji C.
rozporządzenie
Głównym zadaniem insuliny w połączeniu z glukagonem jest utrzymywanie stałego poziomu glukozy we krwi pomiędzy pewnymi wartościami. Jeśli poziom cukru we krwi spadnie poniżej pewnej wartości, istnieje ryzyko śpiączki hipoglikemicznej i śmierci, jeśli wzrośnie powyżej pewnej wartości, istnieje ryzyko uszkodzenia naczyń krwionośnych, krwinek nerkowych i innych tkanek. Wraz z leptyną wydaje się jednak, że insulina również ma znaczący udział w homeostazie energetycznej . Leptyna nie tylko działa na insulinę, ale sama insulina działa również na leptynę, a dokładniej na wchłanianie leptyny w mózgu.
Ze względu na swoją istotną funkcję biochemiczna implementacja pętli kontrolnej musi być solidna. Ponieważ komórki nie mogą „myśleć”, może być tak, że poszczególne komórki działają jak maszyna stanu lub że kilka komórek współpracuje ze sobą w taki sposób, że bodziec jest rozsądnie obliczany.
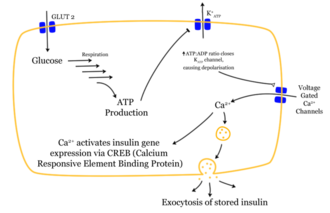
Głównym bodźcem do uwalniania insuliny z komórki β jest poziom cukru we krwi (z 5 mmol glukozy /l krwi), który jest „mierzony” bezpośrednio przez komórkę β. Jest to realizowane biochemicznie za pomocą kanałów potasowych kontrolowanych przez ATP itp., patrz #mechanizm uwalniania kontrolowanego przez glukozę .
Hormony gastryna , sekretyna , GIP i GLP-1 modyfikują podstawowy obwód kontrolny glukozo-insulina działając na komórkę β. Zobacz efekt inkretyny .
GIP jest wydzielany do krwi przez komórki K , które znajdują się w błonie śluzowej dwunastnicy i „mierzą” poziom glukozy w treści pokarmowej oraz zwiększają wydzielanie insuliny przez komórki β. GIP działa zatem na komórki β w czasie, gdy glukoza z pożywienia nie dotarła jeszcze do krwi.
GLP-1 jest wydzielany do krwi przez komórki L , które znajdują się w błonie śluzowej jelita krętego i kątnicy i „mierzą” poziom glukozy w treści pokarmowej, a także zwiększają wydzielanie insuliny przez komórki β. Większość składników odżywczych jest ekstrahowana w jelicie czczym i uwalniana do krwi lub limfy. W kątnicy nie ma wchłaniania składników odżywczych, ale głównie fermentacja.
Ponadto komórki β są unerwione zarówno przez przywspółczulny, jak i współczulny układ nerwowy :
ZN przywspółczulny jest aktywowany w przypadku niedoboru leptyny (lub także w przypadku oporności na leptynę) i ma ogólnie działanie trofotropowe, tj. to znaczy powoduje, że energia jest magazynowana. Więc zwiększa dostarczanie insuliny. Przynajmniej u myszy działa jednocześnie na adipocyty i zwiększa ich wrażliwość na insulinę, podczas gdy nie wpływa na wrażliwość komórek wątroby i mięśni. Glukoza jest wbudowywana w glikogen w komórkach wątroby i mięśni iw ten sposób magazynowana, lipogeneza de novo i magazynowanie TG odbywa się w adipocytach.
Współczulny ZN jest aktywowany w przypadku dostatecznej ilości leptyny i ma ogólne działanie ergotropowe, m.in. oznacza to, że ma wpływ na zwiększenie zużycia energii. Zmniejsza dostarczanie insuliny. Zmniejszenie uwalniania insuliny wydaje się przeciwdziałać zwiększonemu zużyciu energii, ponieważ komórki mięśniowe mogą wchłonąć znacznie więcej glukozy z krwi, jeśli mają na powierzchni jak najwięcej transporterów GLUT-4. Musisz więc polegać na już zmagazynowanej energii w postaci glikogenu i kwasów tłuszczowych.
Mechanizm uwalniania sterowany glukozą
Przenikanie cząsteczki glukozy do komórki β uruchamia łańcuch efektów. Po dostaniu się glukozy do komórki przez transporter GLUT1 jest ona metabolizowana przez glikolizę . Powstały ATP hamuje odpływ jonów potasu ( kanały potasowe wrażliwe na ATP ). Znacznie zmniejszony wypływ potasu prowadzi do depolaryzacji , ponieważ wypływ potasu nie utrzymuje już stabilności potencjału błonowego . Zdepolaryzowany potencjał błonowy powoduje otwarcie zależnych od napięcia kanałów wapniowych . Napływ jonów wapnia jest decydującym bodźcem do fuzji pęcherzyków zawierających insulinę z błoną komórkową.
Zmagazynowane cząsteczki insuliny są uwalniane przez fuzję błon ( egzocytoza ) z komórek β do przestrzeni zewnątrzkomórkowej i dalej do krwiobiegu. Heksamery magazynujące są rozdzielone. Zwiększa się poziom insuliny we krwi.
Okres półtrwania i degradacja
Biologicznego półtrwania poszczególnych cząsteczek insuliny we krwi wynosi około pięć minut.
Insulina jest wchłaniana do komórek przez niektóre receptory insuliny, gdzie jest rozkładana i w ten sposób zużywana. W wątrobie i nerkach insulina jest inaktywowana przez insulinazę , insulinaza, a dokładniej transhydrogenaza glutationowo-insulinowa, rozbija mostki dwusiarczkowe między łańcuchami A i B , przez co insulina dzieli się na dwie części i staje się nieefektywna. Produkty rozpadu są wydalane przez nerki, podobnie jak 1,5% insuliny, która pozostaje nienaruszona. Krótki czas działania insuliny pokazuje, że fizjologiczna kontrola metabolizmu cukrów działa bardzo szybko w zdrowym organizmie; ta prędkość nie może być praktycznie osiągnięta w leczeniu cukrzycy .
Insulina jako lek

W insulinoterapii stosuje się inne preparaty insulinowe . Najpopularniejszą i najstarszą metodą podawania jest wstrzyknięcie podskórne . W tym celu dostępnych jest wiele krótko, średnio i długo działających insulin ludzkich oraz analogów insuliny . Jeśli są one łączone w terapii, należy zwrócić szczególną uwagę na różne okresy półtrwania .
- bardzo szybkie i krótko działające: insulina glulizynowa, insulina lispro, insulina aspart
- krótko działające: insulina normalna (= rozpuszczona insulina ludzka)
- Pośrednio działające: insulina NPH , dwufazowa insulina lispro, dwufazowa insulina aspart
- długo działające: insulina detemir , insulina glargine , insulina degludec
Insulina doustna jest nieskuteczna, ponieważ łańcuchy białkowe w przewodzie pokarmowym enzymów organizmu są rozkładane, zanim zaczną działać. Bada się, w jakim stopniu insuliny można kapsułkować w nanocząsteczkach, aby w ten sposób mogły zostać „niestrawione” wprowadzone do krwiobiegu. Nowsze rozwiązania, takie jak preparaty do inhalacji , które dostarczają insulinę przez drogi oddechowe, jak dotąd nie były w stanie utrzymać się na rynku.
W przeszłości insulinę stosowano jako część terapii szokowej insuliną w leczeniu osób z chorobami psychicznymi . Ten sposób leczenia został pokazany na przykład w filmie biograficznym A Beautiful Mind do Johna Nasha . Ta procedura nie jest już praktykowana.
Nadużywanie insuliny
Insulina znajduje się na liście zabronionych substancji dopingujących, ponieważ może być niewłaściwie wykorzystywana do kilku celów. Ponieważ insulina przeciwdziała zmniejszonemu wychwytowi glukozy w komórkach mięśniowych spowodowanemu przez somatropinę , często stosuje się ją w celu zrekompensowania jej niepożądanych skutków ubocznych (patrz sterydy anaboliczne ). Inne zastosowania obejmują wspomaganie uzupełniania glikogenu u sportowców wytrzymałościowych i pomoc w budowaniu masy mięśniowej.
Niewłaściwe samo podawanie insuliny do nadmiernego obniżenia poziomu cukru we krwi prowadzi do obrazu klinicznego hipoglikemii factitia .
W marcu 2008 roku Colin Norris, pielęgniarz z Newcastle , został skazany na 30 lat więzienia za zabicie czterech swoich pacjentów poprzez wstrzyknięcie wysokich dawek insuliny.
Kalendarium historii badań
| 1869 | Paul Langerhans odkrył komórki wysp trzustkowych w tkance trzustki. |
| 1889 | Oskar Minkowski i Josef von Mering usunęli trzustkę psom i tym samym wywołali cukrzycę. Wkrótce potem podejrzewano, że komórki wysp są tkanką endokrynną (wytwarzającą hormony). |
| 1894 | Eugene Gley (1857-1930) Francuski fizjolog i endokrynolog obniżył poziom cukru we krwi psa po pankreatektomii za pomocą ekstraktu trzustkowego z ubitego zwierzęcia. Rozróżnił funkcję zewnątrzwydzielniczą i endokrynną i tę ostatnią przypisał komórkom wyspowym. |
| 1906 | 21 czerwca 1906 r. niemiecki internista profesor Georg Ludwig Zülzer po raz pierwszy wstrzyknął ludziom wyciąg z trzustki cielęcej o nazwie acomatol, który wyizolował i wyprodukowała firma Schering. |
| 1909 | Po raz pierwszy pojawił się termin insulina „pochodząca z wysp”. Belgijski patolog Jean de Meyer (1878–1934) zaproponował nazwę „insulina”, wywodzącą się od łacińskiego „insula” dla nieznanej dotąd substancji. |
| 1910 | Angielski fizjolog Edward Albert Sharpey-Schafer nazwał brakującą u diabetyków substancję z trzustki „insuliną”. Z dostępnych źródeł nie wynika, kto pierwszy ukuł tę nazwę. |
| 1916 | Nicolae Paulescu po raz pierwszy udało się uzyskać insulinę z tkanki trzustki. |
| 1921 | zastąpili Fredericka Bantinga i Charlesa Besta , izolując insulinę z trzustki płodów zwierzęcych, nazwali to "isletin". |
| 1922 | Pomyślne zastosowanie u pacjentów i rozpoczęcie przemysłowej produkcji insuliny w Kanadzie |
| 1923 | Frederick Banting i John Macleod otrzymał ten Nagroda Nobla w dziedzinie fizjologii lub medycyny za odkrycie insuliny. |
| 1926 | Reprezentacja insuliny w postaci skrystalizowanej przez Johna Jacoba Abla w Ameryce |
| 1928 | Oskarowi Wintersteinerowi udało się udowodnić, że insulina jest białkiem. |
| 1958 | Nagrody Nobla w dziedzinie chemii poszedł Frederick Sanger za pracę nad strukturą białek, zwłaszcza insuliny . |
| 1963 | Profesorowi Helmutowi Zahnowi i jego zespołowi udało się dokonać pierwszej na świecie chemicznej syntezy insuliny. |
| 1964 | Nagrodą Nobla w dziedzinie chemii poszedł Dorota Hodgkin jej określenia struktury biochemicznych ważnych substancji, takich jak insulina i witaminy B 12, stosując analizę struktury rentgenowskiej . |
| 1971 | trójwymiarową strukturę białka insuliny opisali Blundell i in. oświecony. |
| 1982 | po raz pierwszy udało się wyprodukować duże ilości ludzkiej insuliny przy użyciu genetycznie zmodyfikowanych bakterii. |
| 1996 | Insulina lispro (nazwa handlowa Humalog ) była pierwszym szybko działającym analogiem insuliny. |
| 2000 | Insulina glargine (nazwa handlowa Lantus ) była pierwszym długodziałającym analogiem insuliny. |
| 2015 | jest z Abasaglar (insulina glargine) pierwszą insuliną biopodobną na rynku. |
linki internetowe
Indywidualne dowody
- ^ Matthias Otto: Chemia analityczna. John Wiley & Sons, 2011, ISBN 978-3-527-32881-9 , s. 557.
- ↑ Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Biochemia. Wydanie szóste. Spektrum-Verlag, 2007, ISBN 978-3-8274-1800-5 .
- ↑ S. Craft, LD Baker, TJ Montine i in. : Donosowa terapia insulinowa w chorobie Alzheimera i łagodnych zaburzeniach poznawczych związanych z amnezją: pilotażowe badanie kliniczne . W: Archiwum Neurologii . taśma 69 , nie. 1 , styczeń 2012, s. 29–38 , doi : 10.1001 / archneurol.2011.233 .
- ^ PM Daniel, ER Love, SR Moorhouse, OE Pratt: Wpływ insuliny na napływ tryptofanu do mózgu królika. W: J Physiol . tom 312, marzec 1981, s. 551-562, doi: 10.1113 / jphysiol.1981.sp013643
- ↑ „Ojej, potas wynosi 7,2 mmol / l”. (PDF) Pobrane 6 października 2018 (wykład na Uniwersytecie Medycznym w Wiedniu).
- ↑ Dlatego też człowiek , z szympansa , z myszy , z królika i danio : podobne, ale nie identyczne insuliny dopasowanie sekwencji gatunków insuliny .
- ↑ J. Vander Molen, LM Frisse, SM Fullerton, Y. Qian, L. Del Bosque-Plata, RR Hudson, A. Di Rienzo: Genetyka populacyjna CAPN10 i GPR35: implikacje dla ewolucji wariantów cukrzycy typu 2. W: American Journal of Human Genetics . Tom 76, Numer 4, kwiecień 2005, s. 548-560, doi: 10.1086 / 428784 . PMID 15696418 , PMC 1199293 (darmowy pełny tekst).
- ↑ Geny wpływają na metabolizm glukozy. (Nie jest już dostępny online.) W: aerzteblatt.de . 18 stycznia 2010, w archiwum z oryginałem na 26 listopada 2015 roku ; Źródło 25 listopada 2015 .
- ↑ Wpis dotyczący insuliny we Flexikon , wiki firmy DocCheck , dostępny 25 listopada 2015 r.
- ↑ David Owerbach, Graeme I. Bell, William J. Rutter , Thomas B. Pokazuje: Gen insuliny znajduje się na chromosomie 11 u ludzi. W: Przyroda . 286, 1980, s. 82, doi: 10.1038 / 286082a0 .
- ↑ UniProt P01308
- ↑ Wpis UniProt
- ↑ a b Helmut Schatz (red.): Diabetologia zwarta. Wydanie IV. 2006, ISBN 3-13-137724-0 .
- ↑ Heiner Laube: Insulinooporność . Patofizjologia , terapia i perspektywy . Uni-Med, 2001, ISBN 3-89599-541-X .
- ↑ Florian Horn: Biochemia człowieka: podręcznik do studiów medycznych . Wydanie piąte. Thieme, Stuttgart 2012, ISBN 978-3-13-130885-6 , s. 351 .
- ↑ Mark E Daly: Ostry wpływ na wrażliwość na insulinę i dzienne profile metaboliczne diety o wysokiej zawartości sacharozy w porównaniu z dietą bogatą w skrobię . W: Am J Clin Nutr . Nie. 67 , 1998, s. 1186–1196 (angielski, ajcn.org [PDF; dostęp 19 lutego 2011]).
- ↑ Notatki z wykładów Biochemia 2 . Ciało studenckie medycyny na Uniwersytecie w Monachium; archiwum.org
- ^ Podręcznik praktyki farmaceutycznej Hagera. Str. 552.
- ↑ Yu-Hsin Lin i wsp.: Przygotowanie i charakterystyka nanocząstek pokrytych chitozanem do doustnego dostarczania insuliny. W: Biomakromolekuły . 8 (1), 2007, s. 146-152. doi: 10.1021 / bm0607776
- ↑ WADA: Lista Zabronionych 2007 ( Pamiątka z 21 kwietnia 2014 w Internet Archive ) (PDF; 125 kB)
- ↑ Doping News: Insulina ( Pamiątka z 7 czerwca 2007 w Internet Archive )
- ↑ Tom Chivers: Colin Norris, pielęgniarz „Anioł Śmierci”, skazany. W: Telegraf . 2 marca 2008, dostęp 6 września 2016 .
- ↑ Jacek Zając, Anil Shrestha, Parini Patel, Leonid Poretsky: Zasady cukrzycy . Wyd.: Leonid Poretsky. Springer US, New York 2010, ISBN 978-0-387-09840-1 , rozdział Główne wydarzenia w historii cukrzycy , s. 3-16 , doi : 10.1007 / 978-0-387-09841-8_1 ( friedmanfellows.com [PDF]).
- ↑ Vivienne Baillie Gerritsen: Białko XX wieku . W: Prezentacja białek. 9 kwietnia 2001.
- ↑ Helmut Zahn, Johannes Meienhofen, Dietrich Brandenburg i in.: Synteza łańcuchów insuliny i ich łączenie w preparaty insulinoaktywne. W: Journal of Nature Research B . 18, 1963, s. 1120-1121 ( online ).
- ↑ TL Blundell, JF Cutfield, SM Cutfield i sl. : Pozycje atomowe w romboedrycznych kryształach insuliny 2-cynkowej . W: Przyroda . taśma 231 , nie. 5304 , czerwiec 1971, s. 506-511 , PMID 4932997 .