Łańcuch węglowy


W chemii organicznej termin łańcuch węglowy oznacza element strukturalny związków, w których występuje kilka wiązań węgiel-węgiel , czyli atomy węgla są ze sobą połączone . Rozróżnia się łańcuchy liniowe i rozgałęzione. Atomy węgla mają różne nazwy w zależności od ich pozycji w łańcuchu: Pierwszorzędowy atom węgla ma tylko jeden dodatkowy atom węgla jako sąsiad, drugorzędny atom węgla ma dwa, trzeciorzędowy atom węgla ma trzy, a czwartorzędowy atom węgla ma cztery.
prezentacja
Istnieją różne opcje przedstawiania łańcuchów węglowych. Wszystkie atomy związane z łańcuchem są narysowane za pomocą wzorów linii walencyjnych . Często atomy wodoru połączone z łańcuchem węglowym są pomijane i pokazano tylko wiązania CC; notacja ta nazywana jest formułą szkieletową .
Atomy węgla mogą być połączone kowalencyjnymi wiązaniami pojedynczymi , jak na przykład w alkanach . Te cząsteczki mogą się swobodnie obracać wokół osi tego wiązania. Jeśli dwa atomy węgla są połączone wiązaniem podwójnym , jak ma to miejsce w przypadku alkenów , swobodny obrót tego wiązania zostaje zawieszony. W przypadku alkinów dwa atomy węgla są połączone wiązaniem potrójnym . Szczególnym przypadkiem są połączenia w kształcie pierścienia np. B. Cykloalkany : tutaj łańcuch węglowy jest zamknięty. Istnieją różne związki w kształcie pierścieni, składające się z różnej liczby atomów węgla. Obrotowość wiązań jest mocno ograniczona w przypadku małych pierścieni, ale zwiększa się wraz z rozmiarem pierścienia.
| propan | Propen | Propyne | Cyklopropan |
|---|---|---|---|
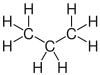
|

|
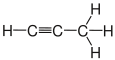
|
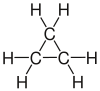
|
Ponadto polimery mogą zawierać łańcuchy węglowe jako element strukturalny. Na przykład polietylen i polipropylen składają się wyłącznie z długołańcuchowych cząsteczek węglowodorów. Właściwości polimerów zależą od długości łańcucha węglowego, jego struktury (regularność, rozgałęzienie) oraz zastosowanych kopolimerów lub dodatków .
Siły Van der Waalsa działają między niepolarnymi łańcuchami węglowymi , tj. H. Indukowane dipole prowadzą do tworzenia słabych wiązań między poszczególnymi cząsteczkami, wiązań van der Waalsa. Widać to wyraźnie w przypadku alkanów, których temperatura wrzenia rośnie wraz z długością łańcucha.
Znaczenie dla nazewnictwa związków organicznych
W systematycznym nazewnictwie ( nomenklatura IUPAC ) organiczno-chemicznych czterech wiązań istotną rolę odgrywa określenie najdłuższego łańcucha węglowego (otwartego lub pierścieniowego). Nazwa rdzenia takiego związku pochodzi od nazwy najdłuższego łańcucha węglowego w cząsteczce, którą następnie precyzuje się za pomocą przedrostków , przyrostków, afiksów itp.
Dalsze elementy, które mogą tworzyć połączenia przypominające łańcuch:
linki internetowe
Indywidualne dowody
- ^ Siegfried Hauptmann : Organic Chemistry , 2nd edition, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, str. 24-27, ISBN 3-342-00280-8 .
