Centrum reakcji fotosyntezy
Centrum reakcji fotosyntezy jest centralnym składnikiem wszystkich organizmów przeprowadzających fotosyntezę . W każdym razie jest to kompleks białkowy złożony z kilku podjednostek. Zaabsorbowana energia świetlna prowadzi do rozdzielenia ładunku. Powstałe w ten sposób elektrony, które mają znacznie wyższy potencjał redoks , są następnie kierowane z centrum reakcji i po wielu pośrednich etapach wykorzystywane do produkcji związków węglowodorowych. Centrum reakcji prawie się nie zmieniło w toku ewolucji, podczas gdy otaczające je kompleksy zbierające światło przybierały różne formy. W bardziej nowoczesnych organizmach, tj. Roślinach, algach i sinicach , centrum reakcji wchodzi w skład większego kompleksu - fotosystemów . Centrum reakcji można wyizolować w bakteriach. W dalszej części wyjaśniono funkcję centrum reakcji na przykładzie centrum reakcji fioletowej bakterii Rhodopseudomonas viridis .
funkcjonalność
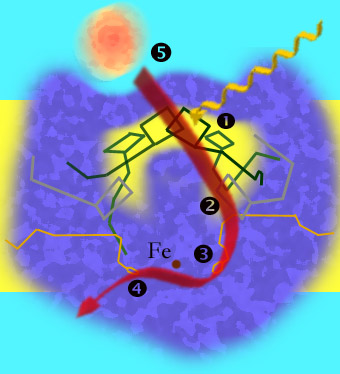
1 : wzbudzenie elektronów; 2 : przeniesienie elektronów do cząsteczki faeofityny; 3 : Elektrony są przejmowane przez cząsteczkę ubichinonu; 4 : przeniesienie elektronów do drugiej cząsteczki ubichinonu ; 5 : Cytochromy (pomarańczowe) wypełniają lukę elektronową w dodatnio naładowanym chlorofilu specjalnej pary .
Centrum reakcji purpurowych bakterii to kompleks trzech łańcuchów białkowych i różnych pigmentów zakotwiczonych w błonie komórkowej i otoczone pierścieniowym kompleksem zbierającym światło (LH1). Te trzy podjednostki są oznaczone literami L, M i H, przy czym ta ostatnia wystaje z błony. W przybliżeniu symetryczne jednostki L i M znajdują się w membranie.
Obie jednostki L i M zawierają po dwa bakteriochlorofile , a także faeofitynę i ubichinon . Cząsteczka ubichinonu z jednostki M może oderwać się od kompleksu. W zależności od bakteriochlorofilu, cząsteczki L i M-Unit są blisko siebie i tworzą tak zwaną „specjalną parę” ( specjalną parę ), w której następuje rozdzielenie ładunku. Bakteriochlorofil służy do poszerzania spektrum absorpcji, maksimum przesuwa się w zależności od rodzaju w obszarach o dłuższych falach światła, np. B. w P870 Rhodobacter sphaeroides do 870 nm oraz w P960 Rhodopseudomonas viridis do 960 nm.
Jedna z dwóch cząsteczek bakteriochlorofilu z tej specjalnej pary jest zwykle wzbudzana pośrednio przez pochłanianie energii z pigmentów anteny, co powoduje rozdzielenie ładunku. Cząsteczka faeofityny jednostki L przyjmuje elektron i jest w ten sposób redukowana do BPh - . Po 200 · 10-12 sekundach silnie związana cząsteczka ubichinonu przejmuje elektron. Po 200 x 10 -6 sekund elektronów wychodzi z cząsteczką ubichinon w jednostce M, która po uzyskaniu w ten sam sposób, drugie liście elektronów centrum reakcji i elektrony do cytochromu bc 1 kompleks transportowanego .
Brakujący elektron ze specjalnej pary jest uzupełniany przez cytochrom c , który dociera do centrum reakcji.
Zadanie jednostki H, która nie zawiera pigmentów, jest nadal niejasne dzisiaj (2006).
Hartmut Michel , Johann Deisenhofer i Robert Huber otrzymał w nagrodę Nobla w dziedzinie chemii za badania nad centrum reakcji w fioletowym bakterii Rhodopseudomonas viridis , która przeprowadza anoxygenic fotosyntezę .
Zobacz też
Indywidualne dowody
- ↑ Couglas C. Youvan i Barry L. Marrs: Molekularne mechanizmy fotosyntezy bakteryjnej . W: Spectrum of Science. Urodzony w 1987, nr 8, s. 62 i nast.
- ↑ Informacja z tej Fundacji Nobla na ceremonii rozdania nagród w 1988 roku do Hartmut Michel, Johann Deisenhofer i Robert Huber (English)
