Sulfonamidy

Sulfonamidy (dokładniej chemicznie sulfanilamidy ) to grupa syntetycznych związków chemicznych o działaniu przeciwbakteryjnym. Dlatego niektórzy przedstawiciele są wykorzystywani jako antybiotyki . Ich działanie polega na tym, że zapobiegają wytwarzaniu przez bakterie kwasu foliowego , który jest niezbędny do produkcji nukleotydów , podstawowego budulca materiału genetycznego . To nie zabija bakterii bezpośrednio, ale zapobiega ich rozmnażaniu, ponieważ nie mogą skopiować swojej informacji genetycznej. Strukturalnie sulfonamidy są potomkami amidu kwasu 4-aminobenzenosulfonowego ; należą do dużej grupy amidów kwasów sulfonowych , którą charakteryzuje grupa —SO 2 NHR–. Termin „ środek chemioterapeutyczny” , który nadal jest używany również w odniesieniu do takich składników aktywnych, pochodzi z początków chemiczno-syntetycznej produkcji substancji przeciwdrobnoustrojowych .
Substancje strukturalnie zbliżone do sulfonamidów to pochodne sulfonylomocznika , które są stosowane jako doustne leki przeciwcukrzycowe , oraz diuretyki tiazydowe .
Działanie sulfonamidów jako środków przeciwbakteryjnych w leczeniu chorób zakaźnych polega na tym, że działają one jako antymetabolity kwasu p - aminobenzoesowego (PABA). Konkurencyjnie hamują syntazę dihydropteroesanową szlaku metabolicznego syntezy kwasu foliowego u bakterii, która katalizuje powstawanie kwasu dihydropteroesowego. Nie ma to wpływu na komórki eukariotyczne (a zatem i ludzkie), ponieważ nie wytwarzają one kwasu foliowego. Skuteczność opiera się również na strukturalnym podobieństwie sulfonamidów do karboksyamidów , których grupa karbonylowa została zastąpiona grupą sulfonylową ; są więc analogi z amidów . Typowymi przedstawicielami są sulfametoksazol , długo działająca sulfadoksyna , sulfakarbamid o krótszym czasie działania lub sulfasalazyna , która nie jest wchłaniana w jelicie . Sam kwas sulfanilowy nie ma znaczącego wpływu na bakterie, ponieważ z powodu dużej polarności z trudem może przenikać przez błonę mikroorganizmów.
Produkcja
Opracowano różne syntezy do produkcji sulfonamidów. Dostępność chemikaliów wyjściowych oraz prosty i bezproblemowy przebieg etapów pośrednich są decydujące dla wybranego typu syntezy. Koncepcje syntezy elektrochemicznej otwierają ścieżki reakcji, z których niektóre pozwalają na bezpośrednie wprowadzenie grupy sulfonamidowej w mniej drastycznych warunkach.
Poniżej przedstawiono dwie możliwe syntezy sulfapirydyny jako przykład wytwarzania sulfonamidów .
- Kondensacja p -acetamino-benzeno-sulfochlorek z aminą, a następnie hydrolizie do grupy acetylowej :
lub jako druga opcja:
- Kondensacja z p chlorku kwasu -nitrobenzenesulfonic z aminą, a następnie redukcję do grupy nitrowej :
historia
Rozwój syntetycznych antybiotyków
Wraz z badaniami naukowymi i syntezą związków organicznych w XIX wieku rozpoczęto poszukiwania związków o właściwościach przeciwbakteryjnych. Paul Ehrlich był jednym z pierwszych chemików, którzy systematycznie badali związki chemiczne pod kątem ich wpływu na bakterie. Ehrlich skupiał się głównie na barwnikach azowych i podobnych związkach. Po badaniach nad barwnikiem azowym czerwienią trypanową i związkiem Atoxyl zawierającym arsen , podejrzewał, że szczególnie odpowiednie są struktury z grupami azowymi (-N = N-) oraz związkami arsenu (-As = As-). Z tego powodu w jego laboratorium zsyntetyzowano i przetestowano wiele nowych związków zawierających arsen.
W przypadku Salvarsana , który został opracowany w jego laboratorium w 1909 r. , Ehrlich i japoński bakteriolog Sahachiro Hata byli w stanie wykazać działanie przeciwbakteryjne na krętki i trypanosomy do 1910 r . W przypadku preparatu Salvarsan po raz pierwszy możliwe było leczenie przyczynowe i wyleczenie kiły z uzasadnionymi toksycznymi działaniami niepożądanymi. Salvarsan opracowany w Niemczech został opatentowany i znany jako jeden z pierwszych w pełni syntetycznych leków. Patent został skonfiskowany przez Stany Zjednoczone podczas I wojny światowej, a związek był nadal używany pod nazwą Arsphenamine .
Już w 1908 roku Paul Gelmo opracował sulfanilamid, pierwszy przedstawiciel z grupy sulfonamidów. Heinrich Hörlein , który już wcześniej stosował sulfonamidy o strukturze azowej (-N = N-) jako barwniki do tekstyliów, był motorem programu badawczego IG Farben mającego na celu systematyczne opracowywanie związków przeciwbakteryjnych z grupy barwników pochodzących z chemii smoły węglowej. na modelu Ehrlichs Salvarsan.
W 1932 roku chemicy Fritz Mietzsch i Josef Klarer zsyntetyzowali w ramach tego programu sulfonamid, który później stał się znany pod marką Prontosil . Jego działanie przeciwbakteryjne odkrył wkrótce potem (w grudniu 1932 r.) Lekarz Gerhard Domagk , który badał medyczne działanie barwników azowych dla IG Farben w głównym zakładzie firmy Bayer w Wuppertal (Elberfeld) i który ściśle współpracował ze swoim laboratorium patologii eksperymentalnej w Elberfeld chemicy pracowali razem. Poza organizmem żywym ( in vitro ) początkowo zsyntetyzowany KL 695 okazał się w dużej mierze nieskuteczny wobec paciorkowców, ale in vivo u myszy (KL 695 później nie przeszedł do testów klinicznych). To samo dotyczy wariantu Kl 730 , który został zsyntetyzowany i przetestowany wkrótce potem , później nazwany Streptozon i ostatecznie Prontosil . W szczególności dowód na efekt w modelach zwierzęcych był dzięki Domagkowi, który w grudniu 1933 r. Z powodzeniem leczył nowym lekiem swoją czteroletnią córkę , która miała posocznicę . Rozwój był początkowo trzymany w tajemnicy, o ile to możliwe, ale wniosek patentowy został złożony w Boże Narodzenie 1932 r. (Opublikowany w styczniu 1935 r.)
Dopiero w lutym 1935 roku Domagk opublikował swoje badania dotyczące medycznej skuteczności Prontosilu, a tym samym po raz pierwszy opis działania chemioterapeutycznego sulfonamidów. W 1939 r. Domagk za swoją pracę otrzymał Nagrodę Nobla , której nie mógł przyjąć ze względu na prawa czasów narodowego socjalizmu. Jedną z przyczyn opóźnienia w rozwoju był sprzeciw narodowych socjalistów, którzy doszli do władzy w 1933 roku, wobec eksperymentów na zwierzętach.
Mechanizm działania Prontosilu wyjaśnili w 1935 roku Jacques Tréfouël , Thérèse Tréfouël, Federico Nitti i Daniel Bovet w laboratorium Ernesta Fourneau : Prontosil jest metabolizowany w organizmie tylko do postaci farmakologicznie aktywnej, sulfanilamidu, co wyjaśnia jego nieskuteczność in vitro. . Później doszło do sporu, czy naukowcy firmy Bayer również uznali znaczenie składnika sulfanilamidowego dla działania przeciwbakteryjnego. Bovet był zdania, że wymyślili to dopiero dzięki pracy francuskich naukowców z Instytutu Pasteura, ponieważ wierzyli, że istnieje związek między właściwościami barwnika a działaniem przeciwbakteryjnym. Badania w laboratoriach bakteriologicznych rozpoczęto dopiero w 1936 r., Testy kliniczne w IG Farben rozpoczęto dopiero w marcu 1936 r., A później w 1936 r. Pojawił się na rynku jako album Prontosil ( album dla bezbarwnych). Z drugiej strony brytyjski bakteriolog Ronald Hare był zdania, że w 1970 r. Było to już znane naukowcom z firmy Bayer, ale szukali oni komponentu, który można by opatentować.
Sulfonamidy były pierwszymi antybiotykami o szerokim spektrum działania, które z powodzeniem zastosowano w medycynie. Dopiero później, podczas drugiej wojny światowej od 1940 roku, Florey i Dunn również wprowadzili penicylinę do terapii medycznej.
Do późnych lat trzydziestych XX wieku zsyntetyzowano ponad 1000 związków sulfonamidowych. Jednak tylko kilka z nich jest skutecznych farmakologicznie. Wszystkie badane do tej pory pochodne sulfanilamidu podstawione przez jądro są całkowicie nieskuteczne. Natomiast związki o następującej budowie są szczególnie skuteczne:
zawierać.
Szeroko stosowane były sulfonamidy (rok wprowadzenia w nawiasach), sulfapirydyna (1938), sulfatiazol (1940), sulfaguanidyna (1940), sulfadiazyna (synonim: sulfapirymidyna, 1941), ftalilosulfatiazol (1942) oraz mono- i dimetylowe pochodne sulfatiazyny. (1943).
Pierwszym lekiem z aktywnym składnikiem sulfonamidowym był Prontosil ( sulfamidochrysoidin ). Oprócz Prontosilu większość sulfonamidów jest skuteczna zarówno in vitro, jak i in vivo . Antybakteryjny mechanizm działania sulfonamidów jako antymetabolitów został wyjaśniony w 1940 roku przez Donalda D. Woodsa i Paula Fildesa .
W toku powszechnego stosowania sulfonamidów w terapii przeciwdrobnoustrojowej u niektórych przedstawicieli odkryto dalsze efekty, które uzasadniały rozwój kolejnych klas składników aktywnych. Więc odkrycia moczopędny (doprowadziło w 1940 diuretyk ) efekt, szczególnie sulfonamid sulfanilamidu do rozwoju nowej klasy leków o „ diuretyków tiazydowych ”. Znany jest również preparat Haflutan (6-chlorobenzeno-1,3-disulfonamid), który stymuluje przepływ moczu (odruch wielomocz ) . Ze względu na działanie obniżające poziom cukru we krwi sulfonamidokarbutamid pojawił się na rynku w 1956 r. Jako pierwszy przedstawiciel „ pochodnych sulfonylomocznika ” stosowanych w leczeniu cukrzycy .
Penicylina i różne inne związki tego typu w znacznym stopniu zastąpiły obecnie stosowane w medycynie sulfonamidy, ponieważ przy niższych dawkach są one bezpieczniejsze. Związki sulfametoksazol , sulfadiazyna srebra i sulfamerazyna należą do nielicznych sulfonamidów nadal stosowanych w medycynie do dziś . Z drugiej strony w weterynarii, zwłaszcza w leczeniu chorób wywołanych zarażeniem pasożytami , nadal szeroko stosuje się preparaty złożone z sulfonamidami.
Próby w czasach narodowego socjalizmu
W czasach narodowego socjalizmu na więźniach obozów koncentracyjnych w obozach koncentracyjnych Ravensbrück i Dachau prowadzono eksperymenty medyczne . Tło było takie, że Reinhard Heydrich zmarł na posocznicę, gdy był pod opieką osobistego lekarza Himmlera, Karla Gebhardta . Osobisty lekarz Hitlera, Morell, skrytykował, że Heydrich mógłby przeżyć, gdyby został użyty sulfonamid Ultraseptyl . Jednak w Heydrich podano inne sulfonamidy, Gebhardt wpadł w rozpacz i zainicjował eksperymenty. Więźniom obozów koncentracyjnych zadawano obrażenia i infekowano rany w celu wywołania posocznicy i zbadania skuteczności różnych sulfonamidów. Gebhardt został skazany m.in. na karę śmierci za te usiłowania na procesie norymberskich lekarzy .
Sulfonamidy stołowe
Poniższa tabela zawiera przegląd pierwszych prostszych związków i sulfonamidów, które są nadal używane. Mafenid jest również zawarty w sulfonamidach, chociaż nie ma struktury sulfanilamidowej. Ponadto, inni przedstawiciele tej klasy substancji czynnych nie wymienionych tutaj byli i są również wykorzystywani w medycynie. Jako antybiotyki stosuje się głównie mieszaniny 2 lub więcej sulfonamidów lub innych substancji czynnych. Prawie wszystkie poszczególne związki mają dużą liczbę synonimów - w niektórych przypadkach znacznie ponad 20 - używanych dla nazw.
| Struktura | Nazwa INN |
Nr CAS PubChem |
Formuła molekularna | Nazwa IUPAC | posługiwać się |
|---|---|---|---|---|---|
|
|
Sulfanilamid |
63-74-1 5333 |
C 6 H 8 N 2 O 2 S | 4-aminobenzenosulfonamid | Podstawowy składnik budulcowy sulfonamidów |
|
|
Sulfathiourea (synonim: sulfathiocarbamide) |
515-49-1 3000579 |
C 7 H 9 N 3 O 2 S 2 | (4-aminofenylo) sulfonylotiomocznik | prawie nie używany ( badional ) |
|
|
Sulfakarbamid |
547-44-4 11033 |
C 7 H 9 N 3 O 3 S 2 | (4-aminofenylo) sulfonylomocznik | w medycynie ludzkiej ( Euvernil ) |
|
|
Mafenid |
138-39-6 3998 |
C 7 H 10 N 2 O 2 S | 4- (aminometylo) benzenosulfonamid | w weterynarii i medycynie ludzkiej (oparzenia) |
|
|
Sulfaguanidyna |
57-67-0 5324 |
C 7 H 10 N 4 O 2 S | 4-amino- N - (diaminometyleno) benzenosulfonoamid | w weterynarii (rzadko stosowane) |

|
Sulfacetamid |
144-80-9 5320 |
C 8 H 10 N 2 O 3 S | N - [(4-aminofenylo) sulfonylo] acetamid | w medycynie ludzkiej (oczy) |
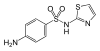
|
Sulfatiazol |
72-14-0 5340 |
C 9 H 9 N 3 O 2 S 2 | 4-amino- N - (1,3-tiazol-2-ilo) benzenosulfonamid | w weterynarii |
|
|
Sulfamethizole |
144-82-1 5328 |
C 9 H 10 N 4 O 2 S 2 | 4-amino- N - (5-metylo-1,3,4-tiadiazol-2-ilo) benzenosulfonamid | w weterynarii |

|
Sulfametrol | 32909-92-5 64939 |
C 9 H 10 N 4 O 3 S 2 | 4-amino- N - (4-metoksy-1,2,5-tiadiazol-3-ilo) benzenosulfonamid | w medycynie ludzkiej |

|
Sulfametylotiazol |
515-59-3 5328 |
C 10 H 11 N 3 O 2 S 2 | 4-amino- N - (4-metylo-1,3-tiazol-2-ilo) benzenosulfonamid | w medycynie ludzkiej |
|
|
Sulfachloropirydazyna |
80-32-0 6634 |
C 10 H 9 ClN 4 O 2 S | 4-amino- N - (6-chloropirydazyn-3-ylo) benzenosulfonoamid | w weterynarii |
|
|
Sulfachloropirazyna |
1672-91-9 164867 |
C 10 H 9 ClN 4 O 2 S | 4-amino- N - (5-chloropirazyn-2-ylo) benzenosulfonamid | w weterynarii dla drobiu |

|
Sulfadiazyna |
68-35-9 5215 |
C 10 H 10 N 4 O 2 S. | 4-amino- N -pirymidyn-2-ylobenzenosulfonamid | w medycynie (skórze) i weterynarii |
|
|
Sulfametoksazol |
723-46-6 5329 |
C 10 H 11 N 3 O 3 S | 4-amino- N - (5-metylo-1,2-oksazol-3-ilo) benzenosulfonamid | w medycynie i weterynarii |

|
Sulfapirydyna |
144-83-2 5336 |
C 11 H 11 N 3 O 2 S. | 4-amino- N -pirydyn-2-ylo-benzenosulfonoamid | w medycynie ludzkiej (skóra) |
|
|
Sulfamerazyna |
127-79-7 5325 |
C 11 H 12 N 4 O 2 S | 4-amino- N - (4-metylopirymidyn-2-ylo) benzenosulfonamid | w weterynarii |
|
|
Sulfaperyna |
599-88-2 68933 |
C 11 H 12 N 4 O 2 S | 4-amino- N - (5-metylopirymidyn-2-ylo) benzenosulfonamid | nieużywany |
|
|
Sulfametoksypirydazyna |
80-35-3 5330 |
C 11 H 12 N 4 O 3 S | 4-amino- N - (6-metoksypirydazyn-3-ylo) benzenosulfonamid | w weterynarii |
|
|
Sulfametoksydiazyna |
651-06-9 5326 |
C 11 H 12 N 4 O 3 S | 4-amino- N - (5-metoksypirymidyn-2-ylo) benzenosulfonamid | w medycynie ludzkiej |
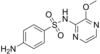
|
Sulfale |
152-47-6 9047 |
C 11 H 12 N 4 O 3 S | 4-amino- N - (3-metoksypirazyn-2-ylo) benzenosulfonamid | w weterynarii i medycynie ludzkiej |
|
|
Sulfamoksol |
729-99-7 12894 |
C 11 H 13 N 3 O 3 S | 4-amino- N - (4,5-dimetylo-1,3-oksazol-2-ilo) benzenosulfonamid | w medycynie ludzkiej |
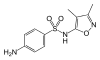
|
Sulfafurazol (synonim: sulfisoksazol ) |
127-69-5 5344 |
C 11 H 13 N 3 O 3 S | 4-amino- N - (3,4-dimetylo-1,2-oksazol-5-ilo) benzenosulfonamid | w medycynie ludzkiej |
|
|
Sulfadikramid |
115-68-4 8281 |
C 11 H 14 N 2 O 3 S | N - (4-aminofenylo) sulfonylo-3-metylobut-2-enamid | w medycynie ludzkiej (już prawie nie używane) |
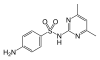
|
Sulfadymidyna |
57-68-1 5327 |
C 12 H 14 N 4 O 2 S | 4-amino- N - (4,6-dimetylopirymidyn-2-ylo) benzenosulfonamid | w weterynarii |
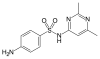
|
Sulfisomidyna |
515-64-0 5343 |
C 12 H 14 N 4 O 2 S | 4-amino- N - (2,6-dimetylopirymidyn-4-ylo) benzenosulfonamid | w medycynie ludzkiej |
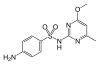
|
Sulfametomidyna |
3772-76-7 19596 |
C 12 H 14 N 4 O 3 S | 4-amino- N - (6-metoksy-2-metylopirymidyn-4-ylo) benzenosulfonamid | w medycynie ludzkiej |

|
Sulfadimetoksyna |
122-11-2 5323 |
C 12 H 14 N 4 O 4 S | 4-amino- N - (2,6-dimetoksypirymidyn-4-ylo) benzenosulfonamid | nadal w weterynarii. dawna nazwa handlowa Madribon |
|
|
Sulfadoksyna |
2447-57-6 17134 |
C 12 H 14 N 4 O 4 S | 4-amino- N - (5,6-dimetoksypirymidyn-4-ylo) benzenosulfonamid | w weterynarii |

|
Sulfaphenazole |
526-08-9 5335 |
C 15 H 14 N 4 O 2 S | 4-amino- N - (1-fenylo- 1H -pirazol-5-ilo) benzenosulfonamid | w weterynarii |
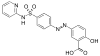
|
Sulfasalazyna |
599-79-1 5359476 |
C 18 H 14 N 4 O 5 S | Kwas 2-hydroksy-5 - [( E ) -4- (pirydyn-2-ylosulfamoilo) fenylodiazenylo] benzoesowy | w medycynie i weterynarii |
nieruchomości
Sulfonamidy mają działanie bakteriostatyczne . Jeśli są używane pojedynczo, opory szybko się rozwijają . Dlatego korzystnie łączy się je z inhibitorami reduktazy kwasu dihydrofoliowego , takimi jak trimetoprim ( kotrimoksazol, patrz poniżej). Sulfonamidy są stosunkowo hydrofilowe, można je podawać doustnie (np. W postaci tabletek ) i są wydalane głównie przez nerki z różnym okresem półtrwania . Dzielą proces wydzielania w kanalikach nerkowych z innymi kwasami , które utrudniają sobie nawzajem wydalanie: kwas moczowy , leki urykozuryczne i urykostatyki , kwas acetylosalicylowy , diuretyki tiazydowe , penicylina i makrolidy . Droga wydalania oznacza również, że odkładają się one w układzie moczowym, który jest również głównym obszarem ich zastosowania.
podanie
Sulfonamidy działają przeciwko bakteriom jelitowym , na przykład Escherichia coli , Pseudomonas , Salmonella , Shigella . Są również skuteczne przeciwko Staphylococcus , Streptococcus , Neisseria , Pneumocystis jirovecii , Toxoplasma gondii , Neospora caninum i Plasmodia . Stosuje się je głównie jako ko-trimoksazol przeciwko niepowikłanym infekcjom dróg moczowych i zapaleniom płuc wywołanym przez Pneumocystis jirovecii (dawniej: P. carinii ), tutaj jako jedyny lek. Są również stosowane w różnych kombinacjach przeciw toksoplazmozie lub malarii wymagającej terapii. Jednak sulfonamidy są nieskuteczne wobec Bacteroides , Enterococcus , mykoplazmy , grzybów , Pseudomonas aeruginosa , większości pierwotniaków , riketsji i wirusów .
W weterynarii sulfonamidy są powszechnymi antybiotykami stosowanymi w chorobach układu oddechowego, przewodu pokarmowego i dróg moczowych. Ponadto często są środki z wyboru do leczenia z gryzoni , gdyż z reguły mają szeroki nietolerancję na antybiotyki (zwłaszcza penicylina ). W sektorze drobiarskim sulfonamidy od dawna są środkiem zwalczania kokcydiów .
Sulfonamidy są najczęściej stosowane w połączeniu z diaminopirymidynami . Ustalona kombinacja substancji sulfametoksazolu i trimetoprimu w stosunku 5 do 1 nazywana jest kotrimoksazolem . Połączenie ma na celu zapobieganie rozwojowi oporności na antybiotyki , a siła działania antybiotyków, które blokują ten sam szlak metaboliczny w różnych punktach, wzrasta. W Niemczech tylko sulfadiazyna jest stosowana w monoterapii w leczeniu ostrej i nawracającej toksoplazmozy .
Legalne prowizje
Grupę sulfonamidów podsumowano w tabeli 1 rozporządzenia (UE) nr 37/2010 w sprawie substancji farmakologicznie czynnych i ich klasyfikacji w odniesieniu do najwyższych dopuszczalnych poziomów pozostałości w żywności pochodzenia zwierzęcego i jako takie mogą występować tylko w określonych maksymalnych ilościach w różnych żywność dla zwierząt. Poniższa tabela zawiera podsumowanie wymagań prawnych.
| Substancja (-e) farmakologicznie czynna (-e) | Pozostałość po znaczniku | Gatunki zwierząt | Maksymalne poziomy pozostałości | Tkanka docelowa | Inne przepisy (zgodnie z art. 14 ust. 7 rozporządzenia (WE) nr 470/2009 ) | Klasyfikacja terapeutyczna |
|---|---|---|---|---|---|---|
| Sulfonamidy (wszystkie substancje z grupy sulfonamidów) | Związek macierzysty | Wszystkie rodzaje używane do produkcji żywności | 100 µg / kg | mięsień
tłuszcz wątroba Nerki |
Pozostałości wszystkich substancji z grupy sulfonamidów nie mogą łącznie przekraczać 100 µg / kg.
W przypadku ryb NDP odnosi się do „mięśni i skóry w naturalnych proporcjach”. Maksymalne limity pozostałości w tłuszczu, wątrobie i nerkach nie mają zastosowania do ryb. Nie stosować u zwierząt, których jaja są przeznaczone do spożycia przez ludzi. |
Środki przeciw infekcjom / środki chemioterapeutyczne |
| Bydło, owce, kozy | 100 µg / kg | mleko |
Interakcje
W przypadku miejscowych środków znieczulających z grupy obejmującej para- estrów kwasu aminobenzoesowego (np prokaina lub tetrakaina ) są podawane w tym samym czasie, antagonizm występuje , gdyż znoszą efektu sulfonamidów. Występują również niepożądane interakcje z metenaminą i, w niektórych przypadkach, z fenylobutazonem .
Skutki uboczne
Sulfonamidy nie są dopuszczone do stosowania w ciąży , zwłaszcza w okolicach terminu porodu , ponieważ mogą powodować niebezpieczną hiperbilirubinemię u noworodka . Z drugiej strony mogą wystąpić alergie , zwłaszcza na skórze - tutaj także sulfonamidy mogą wywołać silną fototoksyczność . Zmiany w morfologii krwi lub cholestaza wątrobowa , tak jak w przypadku pochodnych sulfonylomocznika, są rzadkie . U pacjentów z dziedziczną methemoglobinemią „leczenie sulfonamidami prowadzi do poważnych kryzysów hemolitycznych”.
Ponadto hamowane jest tworzenie cieczy wodnistej , ponieważ sulfonamidy hamują działanie anhydrazy węglanowej . Prowadzi to do skutecznego obniżenia ciśnienia w oku . Krople do oczu ze zmodyfikowanymi sulfonamidami są więc dziś stosowane jako pierwszy wybór w leczeniu jaskry .
Uwagi
- ↑ SY Hwang, DA Berges, JJ Taggart, C. Gilvarg: Transport w transporcie sulfanilamidu i kwasu sulfanilowego . W: Journal of Medicinal Chemistry . taśma 32 , nie. 3 , marzec 1989, s. 694-698 , doi : 10.1021 / jm00123a034 , PMID 2645404 .
- ↑ Stephan P. Blum, Tarik Karakaya, Dieter Schollmeyer, Artis Klapars, Siegfried R. Waldvogel: Elektrochemiczna synteza sulfonamidów bez metali bezpośrednio z (hetero) arenów, SO 2 i amin . W: Angewandte Chemie International Edition . taśma 60 , nie. 10 , 1 marca 2021, ISSN 0570-0833 , s. 5056-5062 , doi : 10.1002 / anie.202016164 ( wiley.com [dostęp 9 kwietnia 2021]).
- ↑ a b c d e f L. F. Fieser, M. Fieser: W: Podręcznik chemii organicznej. 3. Wydanie. Verlag Chemie, Weinheim ad Bergstrasse 1957, s. 1191.
- ↑ a b L. F. Fieser, M. Fieser In: Podręcznik chemii organicznej. 3. Wydanie. Verlag Chemie, Weinheim ad Bergstrasse 1957, s. 1193.
- ↑ LF Fieser, M. Fieser In: Podręcznik chemii organicznej. 3. Wydanie. Verlag Chemie, Weinheim ad Bergstrasse 1957, s. 1182.
- ↑ Brockhaus nauk przyrodniczych i technologii. Wydanie 4. Brockhaus, Wiesbaden 1958, s. 480.
- ↑ LF Fieser, M. Fieser: W: Podręcznik chemii organicznej. 3. Wydanie. Verlag Chemie, Weinheim ad Bergstrasse 1957, s. 1183.
- ↑ Brockhaus nauk przyrodniczych i technologii. Wydanie 4. Brockhaus, Wiesbaden 1958, s. 553.
- ↑ Wolf-Dieter Müller-Jahncke : Sulfonamidy. W: Werner E. Gerabek , Bernhard D. Haage, Gundolf Keil , Wolfgang Wegner (red.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin / Nowy Jork 2005, ISBN 3-11-015714-4 , s. 1367.
- ↑ Rozwój Prontosilu przedstawiono w John Lesch, The first miracle drugs , Oxford UP 2007, str. 57 i nast.
- ^ W-Dieter Müller-Jahncke: Sulfonamidy. 2005, s. 1367.
- ↑ Lesch, Pierwsze cudowne leki, str.82.
-
↑ Domagk przyczynia się do chemioterapii zakażeń bakteryjnych. In: niemiecki. Med. Tygodnik. Tom 61, 15 lutego 1935, s. 250-253; Chemioterapia zakażeń bakteryjnych
Domagk . W chemii stosowanej . Tom 46, 1935, strony 657-667. - ↑ O historii sulfonamidów, patrz także John Lesch The cudowne leki. Oxford University Press 2006.
- ↑ Lesch, Cudowne leki, rozdział 4, W wir, str. 71 i nast
- ↑ J. i Th. Tréfouël, F. Nitti, D. Bovet, „Activité du p.aminophénylsulfamide sur l'infection streptococcique expérimentale de la souris et du lapin”, CR Soc. Biol. 120, 23 listopada 1935, s. 756.
- ^ Lesch, Tworzenie pierwszych cudownych leków, s.84.
- ↑ Lesch, Pierwsze cudowne leki, str. 83 i nast.
- ↑ Brockhaus nauk przyrodniczych i technologii. Wydanie 4. Brockhaus, Wiesbaden 1958, s. 411.
- ↑ LF Fieser, M. Fieser: W: Podręcznik chemii organicznej. 3. Wydanie. Verlag Chemie, Weinheim ad Bergstrasse 1957, s. 1196. Nie Dunn, ale Chain jest wymieniony jako drugi badacz.
- ↑ LF Fieser, M. Fieser: Podręcznik chemii organicznej. 3. Wydanie. Verlag Chemie, Weinheim ad Bergstrasse 1957, s. 1194.
- ^ Günter Clauser : Funkcjonalne zaburzenia równowagi wodnej. W: Ludwig Heilmeyer (red.): Podręcznik chorób wewnętrznych. Springer-Verlag, Berlin / Göttingen / Heidelberg 1955; Wydanie 2, tamże 1961, s. 1255 i n., Tu: s. 1255.
- ↑ H. Auterhoff : Podręcznik chemii farmaceutycznej. WVG 1978, 472 i nast.
- ↑ Herder Lexicon Chemistry. Wydanie licencjonowane dla Bertelsmann Club, Gütersloh, książka nr. 03838 0, 232.
- ↑ Wpis dotyczący antybiotyków sulfonamidowych w Flexikon , wiki z DocCheck , dostęp 25 listopada 2015 r. (Punkt 3).
- ^ Zámečník: To był Dachau. Foundation Comité International de Dachau, Luksemburg 2002, s. 285 i nast.
- ↑ wszystkie informacje z bazy danych CliniPharm , o ile nie określono inaczej
- ↑ PubChem: Sulfathiourea .
- ↑ Frank A. Plumer i in.; W: N Engl. J. Med .; 1983, 309, str. 67-71.
- ↑ wpis do sulfamerazyny w Vetpharm, dostęp 23 czerwca 2012 znaleziony.
- ↑ Wyniki kliniczne sulfamoksolu, nowa analiza sulfonamidów 1240 opisów przypadków ( strona nie jest już dostępna , wyszukiwanie w archiwach internetowych ) Informacje: Łącze zostało automatycznie oznaczone jako wadliwe. Sprawdź łącze zgodnie z instrukcjami, a następnie usuń to powiadomienie. .
- ↑ www.vetpharm.uzh.ch .
- ↑ Informacje o leku MedlinePlus: erytromycyna i sulfizoksazol .
- ↑ Anderson EA, Knouff EG, Bower AG; W: Calif. Med. 1956 maj; 84 (5): 329-30.
- ↑ Junyi Xu, Claudia Gallert i Josef Winter, Appl Microbiol Biotechnol (2007) 74: 493-500.
- ↑ Wstęp na temat sulfonamidów. W: Römpp Online . Georg Thieme Verlag, ostatnia wizyta 25 czerwca 2011.
- ↑ Rozporządzenie Komisji (UE) nr 37/2010 z dnia 22 grudnia 2009 r. W sprawie substancji farmakologicznie czynnych i ich klasyfikacji w odniesieniu do najwyższych dopuszczalnych poziomów pozostałości w żywności pochodzenia zwierzęcego. Źródło 6 lutego 2019 r.
- ↑ M. Buchta: Molekularne podstawy genetyki człowieka . W: M. Buchta, DW Höper, A. Sönnichsen: Das Hammerexamen. Kurs powtórkowy do II sekcji badania lekarskiego. Wydanie 1. Elsevier, Monachium 2006, s. 1426.