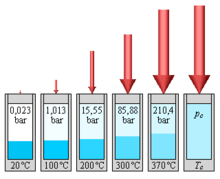
Ciśnienie pary
Ciśnienie pary jest ciśnienie , które tworzy się, gdy pary z przyporządkowanym w fazie ciekłej, w stanie równowagi termodynamicznej w układzie zamkniętym . Prężność par rośnie wraz ze wzrostem temperatury i zależy od występującej substancji lub mieszaniny. Jeśli ciśnienie pary cieczy w układzie otwartym jest równe ciśnieniu otoczenia, ciecz zaczyna wrzeć .
Wyjaśnienie
W cieczy, w temperaturze powyżej zera absolutnego , tj. Wyższej niż zero kelwinów, cząstki mają tendencję do opuszczania ciekłego związku. Przeciwdziała temu napięcie powierzchniowe i ciśnienie zewnętrzne działające na ciecz. Napięcie powierzchniowe spada wraz ze wzrostem temperatury, co powoduje wzrost prężności pary. W punkcie krytycznym napięcie powierzchniowe wynosi zero, a prężność pary jest równa ciśnieniu zewnętrznemu.
Definicje
Substancje mogą występować w trzech klasycznych fizycznych ciał stałych, ciekłych i gazowych. Jeśli substancja istnieje równolegle w fazie gazowej i ciekłej, fazę gazową nazywamy parą . Zatem ciśnienie pary jest ciśnieniem w systemie wielofazowym.
W systemie zamkniętym równowaga ustala się między fazą ciekłą a gazową. Ciśnienie cząstkowe składnika jest następnie dalej do ciśnienia pary. Aby podkreślić, że równowaga została w pełni ustalona, używa się również terminu prężność pary nasyconej .
Jeśli nie ma fazy ciekłej, a tylko fazę gazową, nie chodzi o prężność pary, ale o ciśnienie cząstkowe - w przypadku tylko jednego składnika w fazie gazowej jest to równe ciśnieniu gazu .
Jeżeli w rozważanym układzie znajdują się różne substancje, na zmierzone ciśnienie fazy gazowej składają się ciśnienia cząstkowe różnych substancji. Warunek jest taki, że zachowują się one jak gazy idealne ( prawo Daltona ).
Definicja z punktu widzenia fizyki
W fizyce i chemii prężność par opisuje ciśnienie cząstkowe gazu (układu wieloskładnikowego), który jest w równowadze termodynamicznej z fazą ciekłą lub stałą ; można je obliczyć przy użyciu prawa Raoulta . W układzie jednoskładnikowym ciśnienie to nazywane jest ciśnieniem równowagowym.
Definicja z punktu widzenia meteorologii
W meteorologii pod pojęciem prężności pary rozumie się ciśnienie cząstkowe gazu (w tym przypadku zwykle ciśnienie pary wodnej ). Maksymalna prężność pary przeważająca przy nasyceniu jest identyczna z definicją prężności pary w przemyśle chemicznym jako prężność pary nasyconej .
Ciśnienie pary wodnej
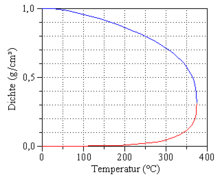
Jeśli woda i para wodna współistnieją w równowadze termodynamicznej, to ciśnienie jest czystą funkcją temperatury:
To ciśnienie zależne od temperatury i specyficzne dla substancji nazywa się prężnością pary, a wykres tej funkcji nazywany jest krzywą prężności pary. Krzywa prężności pary kończy się w punkcie krytycznym.
Wraz ze wzrostem temperatury ciśnienie i gęstość pary gwałtownie rosną, a gęstość cieczy maleje. Właściwości wody i pary stają się coraz bardziej podobne wraz ze wzrostem temperatury, aż w punkcie krytycznym przy T = T c = 373,946 ° C ip = p c = 22,064 MPa różnica całkowicie zanikła i nadal istnieje tylko jedna faza. Gdy zbliża się punkt krytyczny, ciepło parowania znika i występują silne fluktuacje gęstości, rozpoznawane jako krytyczna opalescencja .
Praktyczne znaczenie
W otwartym naczyniu podgrzana woda wrze, gdy jej ciśnienie pary przekracza ciśnienie otaczającego powietrza. Dlatego temperatura wrzenia wody jest zależna od ciśnienia powietrza i zmniejsza się wraz ze wzrostem wysokości, ponieważ naturalne ciśnienie powietrza na ziemi maleje wraz ze wzrostem odległości od poziomu morza. Na wysokości 2000 m woda wrze w 93 ° C, na wysokości 8000 m wrze w 74 ° C.
Fizyczne prawa prężności i parowania pary (krzywa prężności pary, równanie Clausiusa-Clapeyrona itp.) Zostały najpierw zbadane i sformułowane w związku z maszyną parową . Tutaj także istnieje współistnienie cieczy i gazu. Silnik parowy wykorzystywał fakt, że ciśnienie pary jest niezależne od objętości, o ile poruszamy się w układzie dwufazowym „ciecz-gaz”. Jedyną rzeczą, która zmienia się przy stałej temperaturze, jest stosunek „ciecz-gaz”. Ciśnienie w zbiorniku, które porusza tłok, nie zmienia się w wyniku ruchu tłoka (ruch tłoka, zmiana objętości w cylindrze). Nie wolno jednak zmieniać położenia tłoka na tyle, aby jedna z faz zniknęła.
obliczenie
Ciśnienie pary nasyconej można obliczyć na przykład metodami Lee-Keslera i Ambrose-Waltona . Obie metody opierają się na zasadzie zgodności , w której wykorzystuje się dane krytyczne i współczynnik acentryczny .
Równania prężności pary, które wykorzystują parametry specyficzne dla substancji dostosowane do danych eksperymentalnych, takie jak równania Wagnera i Antoine'a, spełniają wyższe wymagania dotyczące dokładności .
Ciśnienie pary wodnej w meteorologii
W meteorologii termin prężność pary jest zwykle rozumiany jako prężność pary wodnej (prężność pary wodnej), a tym samym jej ciśnienie cząstkowe. Gęstość par odpowiada absolutnej wilgotności .
Prężność par zgodnie z definicją meteorologii, tj. Ciśnienie cząstkowe gazu w mieszaninie gazów, można w przybliżeniu obliczyć , przekształcając ogólne równanie gazu z następującego wzoru:
Poszczególne symbole oznaczają następujące wielkości :
- e - ciśnienie pary,
- ρ i - gęstość pary (wilgotność bezwzględna),
- R i - indywidualna stała gazowa (dla pary wodnej: 461,5 J / (kg K)),
- T - temperatura bezwzględna .
Przy temperaturze powietrza 20 ° C ( T = 293,15 K) i maksymalnej wilgotności w tej temperaturze i normalnym ciśnieniu ( ρ i = 0,017 kg / m³) obliczone w ten sposób ciśnienie pary wynosi około 23,39 hPa.
Ponieważ ciśnienie cząstkowe pary wodnej stanowi tylko niewielką część ciśnienia powietrza , równowaga termodynamiczna pojawia się dopiero po bardzo długim okresie czasu, dzięki czemu możliwe jest znaczne niedosycenie w ziemskiej atmosferze bez natychmiastowego wrzenia istniejącej wody w stanie ciekłym. Z tego powodu i dużej dynamiki atmosfery stany stabilne termodynamicznie są zwykle rzadko lub tylko krótkotrwałe, szczególnie w strefach atmosfery ziemskiej bardzo aktywnych na warunki atmosferyczne. Ze względu na lokalnie stosunkowo wyższą prężność pary powyżej fazy ciekłej, gdy woda i lód są jednocześnie obecne w chmurze, cząsteczki lodu rosną kosztem kropelek wody.
Prężność pary na nieprzegrzanej fazie stałej jest niższa niż w fazie ciekłej o tej samej temperaturze. Jeśli obie fazy stykają się ze sobą poprzez otaczające je gazy, udział ciał stałych wzrasta kosztem cieczy . Wynika to z faktu, że silniejsze wiązanie cząstek w ciele stałym i wynikające z tego ciepło topnienia w przypadku sublimacji , czyli przejścia fazowego ciało stałe-gaz, musi być również przezwyciężone lub zastosowane. Konsekwencją tego jest to, że parowanie lub parowanie cząstek w fazie ciekłej zachodzi łatwiej, a zatem częściej niż sublimacja cząstek powyżej fazy stałej. Dlatego więcej cząstek w stanie gazowym znajduje się nad cieczą niż nad ciałem stałym, co lokalnie zwiększa prężność pary i prowadzi do wzrostu fazy stałej.
Zobacz też
literatura
Tabele wartości prężności par dla różnych substancji:
- K. Scheffler, J. Straub i U. Grigull: Wasserdampftafeln. Właściwości termodynamiczne wody i pary do 800 ° C i 800 bar. Springer-Verlag, Berlin 1981, ISBN 3-540-10930-7 .
- U. Grigull, J. Straub i P. Schiebener: Stoły parowe w jednostkach SI. Płyty parowe. Springer-Verlag, Berlin 1990, ISBN 3-540-51888-6 .
- BI Lee, MG Kesler: Uogólniona korelacja termodynamiczna oparta na trzech parametrach odpowiadających stanach . W: AIChE J. 21, 1975, s. 510, doi: 10.1002 / aic.690210313 .
- KS Pitzer, DZ Lippmann, RF Curl, Jr., CM Huggins, DE Petersen: The Volumetric and Thermodynamic Properties of Fluids. II Współczynnik ściśliwości, prężność par i entropia parowania . W: J. Am. Chem. Soc. 77, 1955, s. 3433, doi: 10.1021 / ja01618a002 .
- W. Wagner, J. Ewers, W. Pentermann: Nowe pomiary prężności par i nowe racjonalne równanie prężności pary dla tlenu . W: J. Chem. Thermodyn. 8. 1976, str. 1049, doi: 10.1016 / 0021-9614 (76) 90136-1 .
- D. Ambrose, J. Walton: Prężności par do ich temperatur krytycznych normalnych alkanów i 1-alkanoli . W: Pure Appl. Chem. 61, 1989, str. 1395, doi: 10,1351 / pac198961081395 .
linki internetowe
- IAPWS (Międzynarodowe Stowarzyszenie Właściwości Wody i Pary)
- Obliczanie wielkości termodynamicznych za pomocą książki internetowej NIST Chemistry (w języku angielskim) http://webbook.nist.gov/chemistry/fluid/
- Wideo: prężność par, przykład równowagi fazowej . Jakob Günter Lauth (SciFox) 2019, udostępnione przez Technical Information Library (TIB), doi : 10.5446 / 40353 .
Indywidualne dowody
- ↑ Chemia fizyczna Wprowadzenie oparte na nowej koncepcji z licznymi eksperymentami . Wiesbaden 2011, ISBN 978-3-8348-9834-0 .
- ^ Karl Stephan, Franz Mayinger: Termodynamika. Tom 1: Systemy jednoskładnikowe. Podstawy i zastosowania techniczne. Springer, Berlin / Heidelberg 1998 doi: 10.1007 / 978-3-662-13213-5 , ( Załącznik: Tabele pary - Tabela I. Zmienne stanu wody i pary w nasyceniu (tabela temperatur) ).