Konfiguracja elektronów
Konfiguracja elektronowa wskazuje rozkład elektronów do różnych stanów energii , a tym samym saloników ( orbitali atomowych ) w ramach modelu płaszcza z powłoki elektronowej .
Liczby kwantowe i pociski
Stan każdego elektronu w powłoce jest określony przez cztery liczby kwantowe według atomowej modelu Bohra-Sommerfeld i modelu orbitalnego :

| Liczba kwantowa | postać | Zakres wartości | opis | Przykłady |
|---|---|---|---|---|
| Główna liczba kwantowa | 1, 2, 3, ... | K, L, M, ... | 3 | |
| Mniejsza liczba kwantowa | 0,…, n - 1 | s, p, d, f, ... | 0, 1, 2 | |
|
liczba kwantowa magnetycznego momentu pędu |
, ..., | s, p x, y, z , d yz, xz, xy, z², x²-y² , ... |
−2, −1, ± 0, +1, +2 | |
|
liczba kwantowa spin magnetyczny |
−½, + ½ | ↓, ↑ | −½, + ½ |
Zgodnie z zasadą Pauliego żadne dwa elektrony w atomie nie mogą mieć tego samego stanu we wszystkich czterech liczbach kwantowych. Dzięki tej zasadzie można wykazać, że elektrony są rozprowadzane do różnych dozwolonych stanów, a tym samym do powłok i podpowłok.
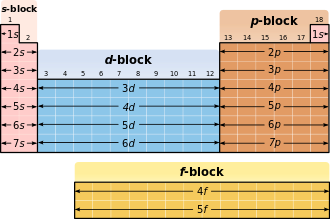
Główne liczby kwantowe określają powłoki, drugorzędne liczby kwantowe określają podpowłoki. Każdy powłoki, w zależności od ograniczeń , i wypełnia z maksimum 2n² elektronów. Powłoki są oznaczone w kolejności rosnącej, zaczynając od powłoki rdzenia, dużymi literami: K, L, M, N, O, P, Q ... Orbitale są nazwane zgodnie z serią linii widmowych, które emituje wzbudzony elektron kiedy znajduje się w pierwotnym orbicie, cofa się; Ze względów historycznych pierwsze cztery serie nazywane są s („ostry”), p („główny”), d („rozproszony”) if („podstawowy”).
Najbardziej zewnętrzna zajęta skorupa (skorupa walencyjna ) określa zachowanie chemiczne i dlatego decyduje o klasyfikacji w układzie okresowym .
Napełnianie misek zgodnie z zasadą nakładania

Wraz ze wzrostem liczby elektronów w pierwiastkach , zajęte są możliwe stany - zaczynając od niższych energii . Zgodnie z regułą Hunda orbitale o tej samej energii są przypisywane najpierw raz, a następnie dwukrotnie.
Podpowłoki wypełniane są w następującej kolejności (w rzędach, czyli w okresach):
- 1. okres : 1 s
- 2. okres : 2s 2p
- 3. tercja: 3s 3p
- 4. okres : 4s 3d 4p
- Piąty okres : 5s 4d 5p
- Szósty okres : 6s 4f 5d 6p
- 7. okres : 7s 5f 6d ...
Stosunek do układu okresowego
W układzie okresowym zajęcie orbity s nowej powłoki odpowiada skokowi w nowy okres .
| Orbital / blok |
Liczba elektronów |
zawiera elementy ... |
|---|---|---|
| s | 2 | Pierwiastki I i II grupy głównej oraz hel |
| p | 6th | pozostałe główne elementy grupy |
| re | 10 | wszystkie elementy podgrupy |
| fa | 14 | wszystkie lantanowce i aktynowce |
notacja
| 2p |
|
||||
|---|---|---|---|---|---|
| L. | 2s |
|
|||
| K. | 1s |
|
|||
| 1s 2 2s 2 2p 4 [He] 2s 2 2p 4 | |||||
Konfigurację elektronową atomu opisują zajmowane podpowłoki:
- Po numerze powłoki następuje litera oznaczająca dolną powłokę, a indeks górny oznacza liczbę elektronów w dolnej powłoce. Więc z. B. dla drugiej dolnej powłoki (l = 1 lub p) trzeciej powłoki (n = 3 lub M) zajmowanej przez 5 elektronów zapis 3p 5 .
- Jeśli istnieje kilka podpowłok, wspólna powłoka jest pomijana: 2s 2 2p 3 staje się 2s 2 p 3 .
- W przypadku dalszej notacji skróconej, skrót gazu szlachetnego z następną niższą liczbą porządkową umieszcza się w nawiasach kwadratowych, wskazując brakujące podpowłoki wyświetlanego elementu.
Przykład chloru : 1s 2 2s 2 2p 6 3s 2 3p 5 → [Ne] 3s 2 3p 5 .
Podpowłok nie należy określać zgodnie z zasadą konstrukcji, ale w kolejności głównej liczby kwantowej; więc z. B. dla europu : [Xe] 4f 7 6s 2 .
Ponadto notacja komórkowa lub notacja Paulinga jest powszechna jako wyraźna reprezentacja graficzna.