Chlorek złota (III)
| Formuła strukturalna | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Generał | ||||||||||||||||
| Nazwisko | Chlorek złota (III) | |||||||||||||||
| inne nazwy |
Trójchlorek złota |
|||||||||||||||
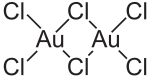
| Formuła molekularna | AuCl 3 (Au 2 Cl 6 ) | |||||||||||||||
| Krótki opis |
igły ciemnopomarańczowo-czerwone kryształowe |
|||||||||||||||
| Identyfikatory zewnętrzne / bazy danych | ||||||||||||||||
| ||||||||||||||||
| nieruchomości | ||||||||||||||||
| Masa cząsteczkowa | 303,33 g mol- 1 | |||||||||||||||
| Stan fizyczny |
mocno |
|||||||||||||||
| gęstość |
3,9 g cm- 3 |
|||||||||||||||
| Temperatura topnienia |
254 °C (rozkład) |
|||||||||||||||
| rozpuszczalność |
dobry w wodzie (680 g l -1 w 20 ° C) |
|||||||||||||||
| instrukcje bezpieczeństwa | ||||||||||||||||
| ||||||||||||||||
| MAK |
jeszcze nie zdecydowane |
|||||||||||||||
| Właściwości termodynamiczne | ||||||||||||||||
| AH f 0 |
-117,6 kJ / mol |
|||||||||||||||
| W miarę możliwości i zwyczajowo stosowane są jednostki SI . O ile nie zaznaczono inaczej, podane dane dotyczą warunków standardowych . | ||||||||||||||||
Chlorek złota (III), przy stosunku wzorze AuCl 3 (i empirycznym wzorze Au 2 Cl 6 ) jest jednym z najważniejszych związków złota . Inne złote chlorki są AuCl i AuCl 2 . Jednakże AuCl 2 nie jest złoto (II), związek, ale mieszanej wartościowości Au (I), - / Au (III) w związek.
Ekstrakcja i prezentacja
Chlorek złota (III) jest wytwarzany przez przepuszczenie gazowego chloru przez drobno rozdrobnione złoto w temperaturze 250 ° C.
nieruchomości
Właściwości fizyczne
AuCl 3 jest obecna zarówno w postaci stałej i w fazie gazowej , jak dimer Au 2 Cl 6 . To samo dotyczy bromku złota AuBr 3 . W przeciwieństwie do również dimerycznego chlorku glinu , złota (III), chlorek dimery są ułożone płasko; AuCl 4 urządzenie jest kwadratu płaszczyznowa. W przypadku (AlCl 3 ) 2, to ma czworościennych strukturę i mostkowe atomy znajdują się powyżej i poniżej płaszczyzny. Struktura krystaliczna jest jednoskośna z grupą przestrzenną P 2 1 / c (grupa przestrzenna nr 14) i parametrami sieciowymi a = 6,57 Å , b = 11,04 Å , c = 6,44 Å i β = 113,3 °. Wiązanie Au-Cl ma silną strukturę kowalencyjną , co wynika z (stosunkowo) wysokiej elektroujemności złota i wysokiego stopnia utlenienia.
Chlorek złota (III) jest bardzo higroskopijny i łatwo rozpuszczalny w wodzie i etanolu.
Właściwości chemiczne
Przy +3 jest to najbardziej stabilny stopień utlenienia złota w związkach i kompleksach .
W temperaturach powyżej 250 ° C AuCl 3 rozkłada się na AuCl i Cl 2 .
AuCl 3 jest kwasem Lewisa i tworzy wiele kompleksów w postaci M + AuCl 4 - (tetrachloroaurynian). M może na przykład oznaczać potas ( tetrachlorozłoniak (III) potasu ). Jon AuCl 4 - nie jest bardzo stabilny w roztworze wodnym.
Z kwasem solnym w celu rozpuszczenia AuCl 3 z wytworzeniem Kwas Chlorozłotowy .
W roztworze wodnym AuCl 3 wchodzi w reakcję z wodorotlenkami metali alkalicznych ( na przykład sodu, wodorotlenek ) tworząc Au (OH) 3 . Po ogrzaniu na powietrzu reaguje, tworząc tlenek złota (III) Au 2 O 3, a następnie metaliczne złoto .
posługiwać się
Chlorek złota (III) jest często używany jako materiał wyjściowy do produkcji innych związków i kompleksów złota. Jednym z przykładów jest przygotowanie kompleksu cyjankowego KAu (CN) 4
Zastosowania w chemii organicznej :
Złota (III), sole , zwłaszcza NaAuCl 4 (od AuCl 3 i chlorku sodu ), można stosować w syntezie organicznej jako katalizatora w reakcjach z alkinów . Tam służą jako nietoksyczny substytut soli rtęci (II). Ważnym przykładem jest hydratacja terminalnych alkinów do ketonów metylowych z wysoką wydajnością. W podobny sposób można również wytwarzać aminy.
Chlorek złota (lll) mogą być użyte jako łagodny katalizator alkilowania z aromatycznych i heteroaromatycznych związków. Jednym z przykładów jest alkilowania 2-metylofuranu z metylowinyloketonu .
Fenol może powstać z pochodnych furanu i alkinów w przegrupowaniu z katalizą chlorkiem złota (III) .
literatura
- Merck Index . Encyklopedia chemikaliów, leków i biologii . Wydanie 14, 2006, ISBN 978-0-911910-00-1 , s. 780.
Indywidualne dowody
- ↑ b c d Wejście na chlorek złota (III) na bazie substancji o GESTIS w IFA , dostępne 8 stycznia 2021 r. (wymagany JavaScript)
- ↑ a b c karta katalogowa chlorek złota (III) firmy AlfaAesar, dostęp 18.01.2010 ( PDF )(Wymagany JavaScript) .
- ↑ David R. Lide (red.): CRC Handbook of Chemistry and Physics . Wydanie 90. (Wersja internetowa: 2010), CRC Press / Taylor and Francis, Boca Raton, FL, Standardowe właściwości termodynamiczne substancji chemicznych, s. 5-5.
- ↑ Georg Brauer (red.), Przy współpracy Marianne Baudler i innych: Podręcznik preparatywnej chemii nieorganicznej. Wydanie trzecie, poprawione. Tom II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3 , s. 1013.
- ^ ES Clark, DH Templeton, CH MacGillavry: Struktura krystaliczna chlorku złota (III). W: Acta Crystallographica , 11, 1958, s. 284-288, doi: 10.1107 / S0365110X58000694 .
- ↑ Y. Fukuda, K. Utimoto: Skuteczna przemiana nieaktywowanych alkinów w keton lub acetal za pomocą katalizatora Au(III) . W: J. Org. Chem. , 1991, 56, str. 3729-3731, doi: 10.1021/jo00011a058 .
- ↑ G. Dyker: Eldorado dla katalizy jednorodnej? W: Podsumowanie syntezy organicznej V , H.-G. Schmalz, T. Wirth (red.), Wiley-VCH, Weinheim 2003, s. 48-55.
- ↑ ASK Hashmi, TM Frost, JW Bats: wysoce selektywna synteza areny katalizowana złotem. W: J. Am. Chem.Soc. , 2000, 122, s. 11553-11554, doi: 10.1021/ja005570d









