Tlenek złota (III)
| Struktura krystaliczna | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| __ Au 3+ __ O 2− | |||||||||||||||||||
| Generał | |||||||||||||||||||
| Nazwisko | Tlenek złota (III) | ||||||||||||||||||
| Wzór na współczynnik | Au 2 O 3 | ||||||||||||||||||
| Krótki opis |
brązowy proszek |
||||||||||||||||||
| Zewnętrzne identyfikatory / bazy danych | |||||||||||||||||||
| |||||||||||||||||||
| nieruchomości | |||||||||||||||||||
| Masa cząsteczkowa | 441,93 g · mol -1 | ||||||||||||||||||
| Stan fizyczny |
mocno |
||||||||||||||||||
| gęstość |
3,6 g cm -3 |
||||||||||||||||||
| Temperatura topnienia |
Rozkłada się na Au i O 2 w temp. Ok. 150 ° C |
||||||||||||||||||
| rozpuszczalność |
prawie nierozpuszczalny w wodzie |
||||||||||||||||||
| instrukcje bezpieczeństwa | |||||||||||||||||||
| |||||||||||||||||||
| O ile to możliwe i zwyczajowe, stosuje się jednostki SI . O ile nie zaznaczono inaczej, podane dane dotyczą warunków standardowych . | |||||||||||||||||||
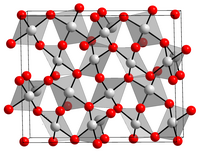
Złota (III), tlenek (Au 2 O 3 ) jest najbardziej stabilny znany tlenek na pierwiastek chemiczny złota . Jest to czerwono-brązowe, krystaliczne, wrażliwe na światło ciało stałe. Związek jest nietrwały termicznie i rozkłada się z powrotem na pierwiastki powyżej około 160 ° C. Au 2 O 3 ma zniekształconą kwadratowo-płaską strukturę kryształu składającą się z jednostek AuO 4 .
prezentacja
Ze względu na szlachetny charakter pierwiastkowego złota, połączenie nie może być ustanowione przez utlenienie go z tlenem . Jednak może to być reprezentowane przez bezpośrednią reakcję złota z plazmą tlenową . Chemicznie, rozpoczyna się od trichlorogold hydrat AuCl 3 -H 2 O (faktycznie wodoru trichlorohydroxidoaurate (III) H [AuCl 3 (OH)]) lub kwas tetrachloridogauric H [AuCl 4 ] · 4H 2 O, który jest trwały w wodnym roztworze soli sodowej węglan dodaje się, gdy wydziela się brązowy osad Au 2 O 3 · x H 2 O. Po wysuszeniu na żelu krzemionkowym ta woda oddziela się i tworzy Au 2 O 3 · 2-3 H 2 O. Można go następnie dalej oczyszczać przez hartowanie w wodzie przez cztery tygodnie w 280 ° C i ciśnieniu 3000 barów (patrz zasada najmniejszy przymus ) polikrystaliczny i bezwodny tlenek złota (III) Au 2 O 3 są przekształcane.
posługiwać się
Do barwienia szkieł ( złoty rubinowy szkło ) można stosować tlenek złota , możliwe są również specjalne zastosowania w optoelektronice .
Indywidualne dowody
- ^ AF Holleman , E. Wiberg , N. Wiberg : Podręcznik chemii nieorganicznej . Wydanie 102. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1 .
- ↑ a b c karta katalogowa tlenku złota (III) firmy AlfaAesar, dostęp 2 lutego 2010 ( PDF )(Wymagany JavaScript) . .
- ↑ a b Arkusz danych Wodzian tlenku złota (III) firmy Sigma-Aldrich , dostęp 3 kwietnia 2011 ( PDF ).
- ↑ Georg Brauer (red.), We współpracy z Marianne Baudler i innymi: Handbook of Preparative Inorganic Chemistry. Wydanie poprawione 3. Tom II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3 , s.1090 .
linki internetowe
- Jörg Michael Gottfried: Utlenianie CO na złocie, adsorpcja i reakcja tlenu, tlenku węgla i dwutlenku węgla na powierzchni Au (110) - (1x2) , praca doktorska na Wolnym Uniwersytecie w Berlinie
- Obrazy 3D za pomocą tlenku złota

