Kwasy organiczne
Kwasy organiczne to związki chemiczne zawierające jedną lub więcej grup funkcyjnych lub inne elementy strukturalne, którewchodzą w reakcje równowagiz uwolnieniem protonów z wodą lub innymi rozpuszczalnikami, które mogą być protonowane. W ten sposób powstają odpowiednie aniony omawianych kwasów organicznych, a protony sąabsorbowaneprzez wodę rozpuszczalnika, któradziałajako akceptor protonów ( zasada ), z utworzeniem jonów oksoniowych H 3 O + . Stężenie jonów oksoniowych w roztworze jest wtedy większe niż stężenie jonów wodorotlenowych , tak że roztwórstaje się kwaśny :
Oprócz kwasów organicznych, które już reagują z wodą jako kwasy, istnieje wiele innych związków organicznych, które nie są odporne na słaby akceptor protonów w wodzie, ale raczej na silniejsze akceptory protonów - takie jak. B. wodorek anion H - lub anion amidowy NH 2 - może reagować jako kwasy. W obu przypadkach nie ma równowagi, ale powstaje gazowy wodór lub amoniak, który ulatnia się:
Takie reakcje są również reakcjami kwasowo-zasadowymi , ale muszą być prowadzone bez wody i w rozpuszczalniku, który sam nie może oddawać protonów (np. w eterze dietylowym ). W przeciwnym razie bardzo silnie zasadowe aniony, wodorki lub amidy, byłyby protonowane przez wodę lub nieodpowiedni rozpuszczalnik i tym samym ulegały zniszczeniu.
Grupowanie kwasów organicznych
Uwagi wstępne, moc kwasu
Środek kwasowości związku chemicznego jest stałe kwas lub związane z nim pk s wartość . Wartość stałej kwasowej wskazuje jak silnie związek reaguje ( protolizuje ) z wodą jako kwas w powyższej reakcji równowagowej , tj. H. jak daleko powyższa równowaga jest przesunięta w prawo. Im pK mniejsze: gdzie wartość s , tym większa jest moc kwasu organicznego.
Termin kwas organiczny jest często pochopnie i po prostu utożsamiany z kwasem karboksylowym , tj. ze związkami zawierającymi jedną lub więcej grup karboksylowych (-COOH). Istnieje jednak bardzo wiele związków organicznych, które mogą reagować jako kwasy, ale nie zawierają w ogóle żadnych grup karboksylowych, ale inne grupy, które również mniej lub bardziej oddają proton, np. H. może reagować kwaśno. Mogą to być grupy takie jak B. grupę hydroksylową w alkoholu R-OH lub grupę sulfanylową -SH w ( tiole ) lub grupą -SO 3 H, w organicznych ( kwasu sulfonowego ).
Wyzwolenie protonu jest tym prostsze, tj. H. związek jest im silniejszy kwas, tym lepiej powstały anion jest stabilizowany przez mezomerię lub inne dodatkowe efekty. Szczególnie drastycznym tego przykładem jest związek kwasu askorbinowego ( witamina C ). Nie ma grupę karboksylową w cząsteczce, a jednak związek ten p K S 4,25 się mocniejszym kwasem niż kwas octowy z P K S 4,75, ponieważ anion kwasu askorbinowego są stabilizowane , ponieważ z enolowej grupy obecne i ewentualne tautomeryczne efektów.
Należy zauważyć, że protony związane z atomami C lub N mogą również zostać uwolnione, jeśli utworzone aniony są stabilizowane mezomerycznie. Takie związki są również określane jako związki kwasowe CH lub kwasowe NH . W przypadku tych związków, pod nieobecność wody jako rozpuszczalnika, całkowite uwolnienie protonu można wymusić przez dodanie silnego środka redukującego sodu , przy czym protony są redukowane do pierwiastkowego wodoru i w ten sposób usuwane z równowagi. Następnie można przeprowadzić syntezę chemiczną z wytworzonymi w ten sposób anionami związku kwasowego CH lub NH.
Kwasy karboksylowe
Kwasy karboksylowe o wartościach p K S od 3,8 (kwas mrówkowy) i wyższych są znacznie mocniejszymi kwasami niż alkohole o wartościach p K S od 15,9 (etanol) i wyższych. Siła kwasowa kwasów karboksylowych wzrasta jeszcze bardziej, jeśli w sąsiedztwie grupy karboksylowej (w pozycji α, β lub γ) znajdują się dalsze grupy elektronoakceptorowe. Podobnie jak z. B. Kwas trifluorooctowy z p K S 0,23 można opisać jako silnego kwasu, w porównaniu z niepodstawionym słabego kwasu octowego p K S 4,75. Oba kwasy są mocniejszymi kwasami niż kwas 2-hydroksypropionowy kwas mlekowy o p K S 3,9, który z kolei jest tylko nieco mocniejszym kwasem niż normalny kwas propionowy o p K S 4,1.
Alkohole, fenole, enole
Un podstawione alkohole (pk s większy niż 16) mają bardzo niskie kwasowości, natomiast fenole i naftole powodu mesomerism stabilizację otrzymanych fenolany wyraźnie kwaśny fenol jest pKa s wartość od 9,9 do 10-krotnie 6 bardziej kwaśnym, a Z . B. etanolu (o pKa e 16). Podstawniki w aromatycznych układach pierścieni fenoli, które wywierają efekt -I lub -M, mogą znacznie zwiększyć kwasowość fenoli i naftoli poprzez stabilizowanie ujemnego ładunku utworzonych anionów. Jeśli obecnych jest kilka takich podstawników, może to prowadzić do związków silnie kwasowych, takich jak. B. kwasem pikrynowym (pK s 0,3) z trzema grupami nitrowymi (efekt −M) na pierścieniu aromatycznym lub pentachlorofenolem (pK s 4,7) (efekt −I). W przypadku określonej z enediol kwasu askorbinowego , którego pKa a jest bardziej kwasowa niż 4,2 kwasem octowym (PK e 4.8) został już wykonany.
Tiole
Tiole mają wyższą kwasowość niż odpowiednie alkohole; powstałe tiolany są bardziej stabilne niż alkoholany . Jest to widoczne przy porównaniu z analogicznym związków etanolu (PK e 16) i etanotiolu (również merkaptan etylowy , PK e 12).
Estry kwasu siarkowego i kwasy sulfonowe
Monoester kwasu siarkowego oraz kwasy sulfonowe, ma pKa s wartość, która jest porównywalna z uwagi na podobną strukturę o pK s wartości drugiego etapu dysocjacji kwasu siarkowego (pk s wartość 1,9). Kwasu p-toluenosulfonowego jako mające wartość pKa a 0,7. Mono-estrów kwasu siarkowego z alkoholem laurylowym , tak zwane laurylowy siarczan jest bardziej kwasowa niż kwas, ma pKa s wartość -0.09 i dlatego jest znacznie mniej kwaśny od protonu pierwszego etapu dysocjacji kwasu siarkowego ( wartość pK s -3).
Estry kwasu fosforowego i kwasy fosfonowe
Mono- i diestry kwasu fosforowego ( estry kwasu fosforowego ) oraz organiczne pochodne kwasu fosfonowego (potocznie zwane fosfonianami ) są kwasami od średnich do słabych, w zależności od etapu dysocjacji.
związki kwasowe CH- i NH-
Nawet węglowodory bez grupy karboksylowej, hydroksylowej lub sulfanylowej mogą działać jak kwasy ze względu na ich kwasowość CH lub NH. Przyczyną kwasowości jest występowanie wiązań wielokrotnych i sąsiednich grup funkcyjnych lub heteroatomów. Najbardziej znanym Związek CH-kwasowy jest acetylen ( acetylen ), co wynika z potrójnego wiązania pK a ma wartość 25 (etan: 50). Kolejnymi przykładami są nitroetan (pK s 8,6) i nitrocyklopentadien , który jest bardziej kwaśny (pK s 3,3) niż kwas mrówkowy (3,75). Podczas deprotonowania z nitrocyklopentadienu powstaje pochodna aromatycznego anionu cyklopentadienylowego . Tutaj również efekty mezomeryczne wraz z efektami indukcyjnymi determinują kwasowość związków. Acetonitryl jest kolejnym przykładem prostego związku kwasowego CH. Znane związki NH-kwasowe ftalimid (PK y = 8,3) i sulfonylomoczniki ( tolbutamid ma wartość pKa wynoszącą 5.16).
Przegląd
Klasa substancji kwasowa grupa funkcyjna przykład Wartość pK s w 25 ° C Kwasy karboksylowe Grupa karboksylowa : R-COOH  kwas octowy
kwas octowy
4,8 Podstawione
kwasy karboksyloweGrupa karboksylowa: R-CH x X y -COOH  Kwas trifluorooctowy
Kwas trifluorooctowy
0,23 aromatyczne
kwasy karboksyloweGrupa karboksylowa: Ar-COOH  Kwas benzoesowy
Kwas benzoesowy
4.2 Alkohole Grupa hydroksylowa : R-OH  Etanol
Etanol
16 Fenole Grupa hydroksylowa: Ar – OH
(Ar = aryl ) fenol
fenol
9,9 Naftole Grupa hydroksylowa: Ar – OH
(Ar = aryl )α-naftol 9,3 Podstawione fenole
(podstawniki z efektem -I,
takie jak halogeny , grupy nitrowe )Grupa hydroksylowa: O 2 N – Ar – OH
(Ar = aryl ) Kwas pikrynowy
Kwas pikrynowy
0,4 Enole Grupa hydroksylowa (enol): C = C-OH  Kwas askorbinowy
Kwas askorbinowy
4.2 Tiole R-SH  Etanotiol (C 2 H 5 -SH)
Etanotiol (C 2 H 5 -SH)12. Ester kwasu siarkowego
( siarczan )R-O-SO 3 H Ester dodecylowy kwasu siarkowego Wartość -0,09
dla kwasowościKwasy sulfonowe
( kwasy alkilosulfonowe)R-SO 3 H H 3 C-SO 3 H Ester -0,6 Kwasy sulfonowe
(kwasy arenosulfonowe)R – Ar – SO 3 H
(Ar = aryl )H 3 C-C 6 H 4- SO 3 H kwas p- toluenosulfonowy 0,7 Fosforany
(= ester kwasu fosforowego )R-O-PO (OH) 2 Monofosforan adenozyny 3,3 org. Kwasy fosforowe
(patrz fosfoniany )R-PO (OH) 2 Kwas H 3 C-PO (OH) 2 metylofosfonowy 2,35 związki kwasowe CH-
alkinyH-C C-R 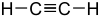 Etyna
Etyna
25. związki kwasowe CH
nitroalkanyO 2 N-CRR'-H 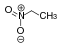 Nitroetan
Nitroetan
8,6 Związki CH-kwasowe
β-dikarbonyleRC = OCH 2 C = LUB '  Acetyloaceton
Acetyloaceton
9 Związki NH-kwasowe
imidyR- (CO) 2 NH  ftalimid
ftalimid
8,3 Dla porównania kwasy nieorganiczne Kwasy mineralne HO-SO 2 -OH  Kwas Siarkowy
Kwas Siarkowy
-3
Indywidualne dowody
- ↑ Alfons Hädener, Heinz Kaufmann: Podstawy chemii organicznej. Springer, 2006, ISBN 978-3-7643-7040-4
- ^ B Hans Beyer i Wolfgang Walter : Organische Chemie , S. Hirzel Verlag, Stuttgart, 1984, str 521, ISBN 3-7776-0406-2 .
- ↑ Wpis dotyczący tolbutamidu w bazie danych ChemIDplus Narodowej Biblioteki Medycznej Stanów Zjednoczonych (NLM), dostęp 25 marca 2021 r.
- ↑ b c d chem.wisc.edu: pKa danych , opracowanej przez R. Williams (PDF 78 KB).
- ↑ a b CRC Handbook of Tables for Organic Compound Identification , wydanie trzecie, 1984, ISBN 0-8493-0303-6 .
- ↑ Rappoport, Zvi., Frankel, Max.: Podręcznik tabel do identyfikacji związków organicznych . Wydanie 3D. Chemical Rubber Co, Cleveland 1967, ISBN 0-8493-0303-6 .
- ↑ ChemieOnline litera E (merkaptan etylowy) .
- ^ PH Stahl, CG Wermuth: Handbook of Pharmaceutical Salts: Properties, Selection and Use , 2002, Helvetica Chimica Acta, ISBN 3-906390-26-8 .
- ↑ ChemieOnline litera P
- ↑ ChemieOnline litera N
- ↑ ChemieOnline litera A








