Hydrochinon
| Formuła strukturalna | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||||||||
| Generał | ||||||||||||||||||||||
| Nazwisko | Hydrochinon | |||||||||||||||||||||
| inne nazwy |
|
|||||||||||||||||||||
| Formuła molekularna | C 6 H 6 O 2 | |||||||||||||||||||||
| Krótki opis |
bezbarwne i bezwonne, krystaliczne ciało stałe |
|||||||||||||||||||||
| Zewnętrzne identyfikatory / bazy danych | ||||||||||||||||||||||
| ||||||||||||||||||||||
| nieruchomości | ||||||||||||||||||||||
| Masa cząsteczkowa | 110,11 g mol -1 | |||||||||||||||||||||
| Stan fizyczny |
mocno |
|||||||||||||||||||||
| gęstość |
|
|||||||||||||||||||||
| Temperatura topnienia |
170 ° C (forma α) |
|||||||||||||||||||||
| temperatura wrzenia |
286 ° C |
|||||||||||||||||||||
| Ciśnienie pary |
15 m Pa (20 ° C) |
|||||||||||||||||||||
| wartość pK s |
|
|||||||||||||||||||||
| rozpuszczalność |
rozpuszczalny w wodzie: 72 g l −1 (20 ° C) |
|||||||||||||||||||||
| instrukcje bezpieczeństwa | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK |
|
|||||||||||||||||||||
| O ile to możliwe i zwyczajowe, stosuje się jednostki SI . O ile nie zaznaczono inaczej, podane dane dotyczą warunków standardowych . | ||||||||||||||||||||||
Hydrochinon ( 1,4-dihydroksybenzen ) jest fenolem i obok pirokatechiny (1,2-dihydroksybenzenu) i rezorcyny (1,3-dihydroksybenzenu) jest trzecim możliwym dihydroksybenzenem. Tutaj dwie grupy hydroksylowe znajdują się w pozycji para .
odkrycie
W 1844 roku Friedrich Wöhler otrzymał mieszaninę produktów z suchej destylacji (> 280 ° C) kwasu chinowego, która oprócz benzenu , kwasu benzoesowego i kwasu salicylowego zawierała jako główny składnik nowy bezbarwny związek. Po rozpuszczeniu destylatu w wodzie, odfiltrowaniu nierozpuszczalnych składników i oddestylowaniu bardziej lotnych składników, kwas benzoesowy wykrystalizował najpierw z pozostałego roztworu, a na koniec hydrochinon z jego ługu macierzystego, który uzyskał w czystej postaci przez wielokrotną rekrystalizację w postaci bezbarwnej , sześcioboczne pryzmaty.
Występowanie
Hydrochinon występuje w ok. 10% roztworze wraz z 28% nadtlenkiem wodoru w gruczołach obronnych chrząszczy bombardiera . W przypadku obrony, do mieszaniny dodaje się katalazę , a napastnika rozpyla się jako gorący, żrący repelent o temperaturze 100 ° C. Liście mącznicy lekarskiej oraz gruszki zawierają glikozyd arbutyny , czyli hydrochinono-β-D-glukozyd, związek hydrochinonu z glukozą .
prezentacja
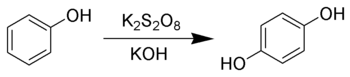
Hydrochinon można syntetyzować z fenolu przez utlenianie Elbs .
nieruchomości
Hydrochinon jest bezbarwną substancją stałą, która może występować w czterech polimorficznych formach krystalicznych. Formy α, β i γ istnieją pod normalnym ciśnieniem . Formy α i β krystalizują w heksagonalnej sieci krystalicznej, forma γ w sieci jednoskośnej . W temperaturze pokojowej forma α jest formą stabilną termodynamicznie. Formy β i γ są metastabilne i mogą samoistnie przekształcić się w formę α. Forma α odpowiada produktowi handlowemu. Postać β można uzyskać z klatratów o małych cząsteczkach, takich jak metanol . Postać γ można uzyskać poprzez sublimację lub szybkie odparowanie. Przy wyższych ciśnieniach powyżej 40 MPa, forma δ może być wykryta jako czwarta postać krystaliczna. Temperatura topnienia formy δ wynosi 78,5 MPa w 191 ° C. Punkt potrójny między α, δ i fazą ciekłą to 176 ° C i 15,7 MPa.
Hydrochinon jest silniejszym środkiem redukującym niż katechol, ponieważ o-benzochinon wytwarzany z katecholu jest bardziej energetyczny, a zatem silniejszy utleniacz. Przyczyną tego ostatniego jest elektrostatyczne odpychanie sąsiednich grup karbonylowych.
Można go przekształcić w benzochinon ( chinon ) przez utlenianie :
W tej reakcji jako produkt pośredni tworzy się głęboko zabarwiony, słabo rozpuszczalny w wodzie chinhydron z przenoszącym ładunek kompleksowy (niepokazany).
Reakcje
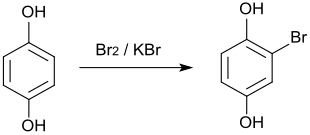
Proste bromowanie hydrochinonu bromkiem potasu i bromem w czterochlorku węgla prowadzi do bromohydrochinonu .
Pełne bromowanie do analitycznego oznaczania zapewnia 2,5-dibromohydrochinon , którego temperatura topnienia wynosi 186 ° C. Znany jest również tetrabromohydrochinon , który jednak występuje w przypadku benzochinonu.
W wyniku metylowania siarczanem dimetylu otrzymuje się 1,4-dimetoksybenzen , którego temperatura topnienia wynosi 56 ° C.
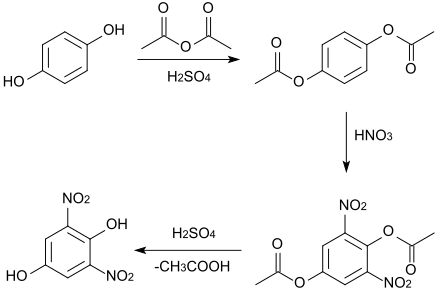
Bezpośrednia nitracja hydrochinonu nie jest możliwa, ponieważ rozkłada się on w trakcie. Grupy hydroksylowe, musi być chroniony z grup acetylowych przez reakcję z bezwodnikiem kwasu octowego i kwasu siarkowego jako katalizatora , po czym nitrowanie odbywa się w pozycjach 2 i 6. Zmydlanie powstałego dinitrodiacetylohydrochinonu ostatecznie prowadzi do 2,6-dinitrohydrochinonu (temperatura topnienia 135-136 ° C).
posługiwać się
W technologii laboratorium fotograficznego hydrochinon jest stosowany jako środek redukujący do wywoływania filmów i obrazów. Ze względu na zagrożenia dla środowiska i zdrowia podejmuje się wysiłki, aby w miarę możliwości zastąpić substancję do tych zastosowań mniej ryzykownymi substancjami. Jest również stosowany jako inhibitor reakcji rodnikowych, zapobiegających tworzeniu się nadtlenków eteru.
Stosowanie kosmetyków w kremach do skóry, na przykład do rozjaśniania skóry , jest zabronione w krajach UE.
toksykologia
Nie ma badań dotyczących bezpośredniej toksyczności hydrochinonu u ludzi. Jednak kilka badań na zwierzętach wykazało, że hydrochinon jest toksyczny dla nerek. Ponadto hydrochinon jest immunotoksyczny i przypuszczalnie również odgrywa ważną rolę w immunotoksyczności benzenu .
Jeśli hydrochinon zostanie zastosowany na skórę, mogą wystąpić alergiczne i systematyczne reakcje alergiczne.
Rakotwórczość
Dostępne są dwa badania kohortowe na ludziach, jedno przeprowadzone przez litografów duńskich, a drugie przez pracowników przemysłowych, w których zbadano związek między narażeniem na hydrochinon a występowaniem raka w ogóle, a także konkretnych nowotworów. W żadnym z dwóch badań nie można było ustalić związku, nawet jeśli wśród litografów wzrosła częstość występowania czerniaka .
W doświadczeniach na szczurach wielokrotne podawanie hydrochinonu wykazało zwiększoną częstość występowania niektórych guzów wątroby i nerek.
Dlatego przyjmuje się, że hydrochinon, podobnie jak inne dihydroksybenzeny (np. Katechol), jest rakotwórczy i genotoksyczny.
Możliwe mechanizmy działania
W eksperymentach na komórkach wątroby hydrochinon doprowadził do wyczerpania przeciwutleniaczy w komórce, w szczególności glutationu . Ponadto w hodowli komórkowej można wykazać, że hydrochinon tworzy addukty DNA i zwiększa tworzenie 8-OHdG , standardowego markera uszkodzeń DNA. Uważa się, że to uszkodzenie DNA jest związane z tworzeniem się RFT.
metabolizm
U ludzi hydrochinon jest metabolizowany głównie do koniugatów siarczanu i glukoronidu. Oprócz reaktywnych produktów pośrednich, takich jak semichinony i RFT , w ramach tych szlaków metabolicznych powstaje również 1,4-benzochinon . Ten metabolizm jest katalizowany przez szereg oksydaz . Zatem metabolizm hydrochinonu jest podobny do metabolizmu katecholu .
Ocena zagrozenia
Hydrochinon został włączony przez UE w 2012 r. Zgodnie z rozporządzeniem (WE) nr 1907/2006 (REACH) jako część oceny substancji w bieżącym planie działań Wspólnoty ( CoRAP ). Wpływ substancji na zdrowie ludzi i środowisko podlega ponownej ocenie i, jeśli to konieczne, podejmuje się działania następcze. Spożycie hydrochinonu było spowodowane obawami dotyczącymi jego klasyfikacji jako substancji CMR , stosowania przez konsumentów , wysokiego (zagregowanego) tonażu, współczynnika charakterystyki wysokiego ryzyka (RCR) i powszechnego stosowania. Ponowna ocena miała miejsce od 2012 r. I została przeprowadzona przez Włochy . Następnie opublikowano raport końcowy.
Indywidualne dowody
- ↑ Wpis na hydrochinonu w bazie Cosing z Komisji Europejskiej, dostępne w dniu 14 maja 2020 r.
- ↑ a b c d e f g h i Wpis nr CAS 123-31-9 w bazie substancji GESTIS z tej IFA , dostępne w dniu 6 grudnia 2015 r. (Wymagany JavaScript)
- ^ A b S. C. Wallwork, HM Powell: Struktura krystaliczna formy α chinolu. W: J. Chem. Soc. Perkin Trans. Vol. 2, 1980, str. 641-646, doi: 10.1039 / P29800000641 .
- ↑ a b c S. V. Lindemann, VE Shklover, Yu. T. Struchkov: β-modyfikacja hydrochinonu, C6H6O2. W: Cryst. Struct. Commun. Tom 10, 1981, str. 1173-1179.
- ↑ a b c K. Maartmann-Moe: Struktura krystaliczna γ-hydrochinonu. W: Acta Cryst. Tom 21, 1966, str. 979-982, doi: 10.1107 / S0365110X66004286 .
- ↑ a b wpis na hydrochinonu. W: Römpp Online . Georg Thieme Verlag, ostatnia wizyta 2 sierpnia 2018.
- ↑ Wpis na hydrochinon w wykazie klasyfikacji i oznakowania w Europejskiej Agencji Chemikaliów (ECHA), dostępne w dniu 1 lutego 2016 roku producenci lub dystrybutorzy mogą rozwinąć się zharmonizowanej klasyfikacji i oznakowania .
- ↑ Swiss Accident Insurance Fund (Suva): Limit values - aktualne wartości MAK i BAT (szukaj 123-31-9 lub hydrochinon ), dostęp 2 listopada 2015 r.
- ↑ F. Wöhler: O chinonie. W: Pharmaceutisches Centralblatt . Nr 39, 1844, strony 609-615. ( ograniczony podgląd w wyszukiwarce Google Book).
- ↑ H. Schildknecht, K. Holoubekal: Chrząszcze bombardierów i ich chemia wybuchowa. W: Angewandte Chemie . 73 (1), 1961, str. 1-7. doi: 10.1002 / anie.19610730102 .
- ↑ Werner Nachtigall, A. Wisser: Projekt biologiczny. Wydanie 1. Springer-Verlag, Berlin 2005, ISBN 3-540-22789-X . ( ograniczony podgląd w wyszukiwarce Google Book).
- ↑ Gerhard G. Habermehl: Trujące zwierzęta i ich broń. Piąty, zaktualizowany i exp. Wydanie. Springer-Verlag, Berlin 1994, ISBN 3-540-56897-2 . ( ograniczony podgląd w wyszukiwarce Google Book).
- ↑ K. Elbs: O nitrohydrochinonie. W: J. Prakt. Chem. 48, 1893, str. 179-185. doi: 10.1002 / prac.18930480123 .
- ↑ WA Caspari: Struktura krystaliczna chinolu. Część I. W: J. Chem. Soc. 1926, s. 2944-2248. doi: 10.1039 / JR9262902944 .
- ↑ a b c W. A. Caspari: Struktura krystaliczna chinolu. Część II W: J. Chem. Soc. 1927, s. 1093-1095. doi: 10.1039 / JR9270001093 .
- ↑ a b c d e M. Naoki, T. Yoshizawa, N. Fukushima, M. Ogiso, M. Yoshino: A New Phase of Hydroquinone and Its Thermodynamic Properties. W: J. Phys. Chem. B 103, 1999, str. 6309-6313. doi: 10.1021 / jp990480k .
- ^ DE Palin, HM Powell: Hydrogen Bond Linking of Quinol Molecules. W: Nature . Tom 156, 1948, str. 334. doi: 10.1038 / 156334a0 .
- ^ DE Palin, HM Powell: Struktura związków molekularnych. Część III. Struktura krystaliczna kompleksów addycyjnych chinolu z niektórymi związkami lotnymi. W: J. Chem. Soc. 1947, s. 208-221. doi: 10.1039 / JR9470000208 .
- ^ DE Palin, HM Powell: Struktura związków molekularnych. Część VI. Związki klatratowe typu β chinolu. W: J. Chem. Soc. 1948, s. 815-821. doi: 10.1039 / JR9480000815 .
- ^ Stowarzyszenie autorów: Organikum . Wydanie XIX. Johann Ambrosius Barth, Leipzig / Berlin / Heidelberg 1993, ISBN 3-335-00343-8 , s. 331.
- ↑ M. Kohn, LW Guttmann: O wiedzy o produktach podstawienia bromu w hydrochinonie. W: Miesięcznik dla chemii . 45 (10), 1924, str. 573-588. doi: 10.1007 / BF01524599 .
- ^ Stowarzyszenie autorów: Organikum . Wydanie XIX. Johann Ambrosius Barth, Leipzig / Berlin / Heidelberg 1993, ISBN 3-335-00343-8 , s.653 .
- ↑ a b Gustav Walther: eter metylowy 2,6-dinitrohydrochinonu i niektóre pochodne. Rozprawa. Uniwersytet w Bazylei, 1904.
- ↑ H. Bock, S. Nick, C. Näther, JW Nietoperze: Nitranilan disodu i dipotasu: Cyjaninowe zniekształcenie sześcioczłonowych pierścieni węglowych. W: Journal of Nature Badań B . 49, 1994, s. 1021-1030 ( PDF , pełny tekst dowolny).
- ↑ https://ec.europa.eu/growth/tools-databases/cosing/index.cfm?fuseaction=search.results&annex_v2=II&search
- ↑ National Toxicology Program: NTP Toxicology and Carcinogenesis Studies of Hydrquinone (CAS No. 123-31-9 ) in F344 / N Rats and B6C3F1 Myszy (badania przez zgłębnik) . W: National Toxicology Program Technical Report Series . taśma 366 , październik 1989, ISSN 0888-8051 , s. 1-248 , PMID 12692638 .
- ↑ Masa-Aki Shibata, Masao Hirose, Hikaru Tanaka, Emiko Asakawa, Tomoyuki Shirai: Indukcja guzów nerkowokomórkowych u szczurów i myszy oraz wzmocnienie rozwoju guza wątrobowokomórkowego u myszy po długotrwałym leczeniu hydrochinonem . W: Japanese Journal of Cancer Research . taśma 82 , nie. 11 , 1991, ISSN 1349-7006 , str. 1211-1219 , doi : 10.1111 / j.1349-7006.1991.tb01783.x , PMID 1752780 , PMC 5918322 (pełny tekst dowolny).
- ↑ a b Międzynarodowa Agencja Badań nad Rakiem.: Ponowna ocena niektórych organicznych chemikaliów, hydrazyny i nadtlenku wodoru. Światowa Organizacja Zdrowia, Międzynarodowa Agencja Badań nad Rakiem, Lyon, Francja 1999, ISBN 978-92-832-1271-3 .
- ↑ A. Barbaud, P. Modiano, M. Cocciale, S. Reichert, J.-L. Brud: Miejscowe zastosowanie rezorcyny może wywołać ogólnoustrojową reakcję alergiczną . W: British Journal of Dermatology . taśma 135 , nie. 6 , 1996, ISSN 1365-2133 , s. 1014-1015 , doi : 10.1046 / j.1365-2133.1996.d01-1121.x .
- ↑ JW Pifer, FT Hearne, FA Swanson, JL O'Donoghue: Badanie śmiertelności pracowników zaangażowanych w produkcję i stosowanie hydrochinonu . W: Międzynarodowe Archiwa Zdrowia Zawodowego i Środowiskowego . taśma 67 , nie. 4 , 1995, ISSN 0340-0131 , s. 267-280 , doi : 10.1007 / BF00409409 , PMID 7591188 .
- ^ Vol Carlton, H Shah: Re: „Malignant czerniak wśród litografów” autorstwa H Nielsena, L Henriksena, JH Olsena. Scand J Work Environ Health 1996; 22: 108-11 . W: Scandinavian Journal of Work, Environment & Health . taśma 23 , nie. 4 , sierpień 1997, ISSN 0355-3140 , s. 308 , doi : 10.5271 / sjweh.224 .
- ↑ a b U. Stenius, M. Warholm, A. Rannug, S. Walles, I. Lundberg: Rola zubożenia GSH i toksyczności w rozwoju ognisk zmienionych enzymatycznie wywołanym przez hydrochinon . W: Carcinogenesis . taśma 10 , nie. 3 , marzec 1989, ISSN 0143-3334 , s. 593-599 , doi : 10.1093 / carcin / 10.3.593 , PMID 2564322 .
- ↑ Junzo Suzuki, Yuichiro Inoue, Shizuo Suzuki: Zmiany poziomu 8-hydroksyguaniny w moczu pod wpływem ekspozycji na reaktywne substancje wytwarzające tlen . W: Free Radical Biology and Medicine . taśma 18 , nie. 3 , 1 marca 1995, ISSN 0891-5849 , s. 431-436 , doi : 10.1016 / 0891-5849 (94) 00152-A ( sciencedirect.com [dostęp 30 czerwca 2020]).
- ↑ G. Lévay, WJ Bodell: Rola nadtlenku wodoru w tworzeniu adduktów DNA w komórkach HL-60 traktowanych metabolitami benzenu . W: Biochemical and Biophysical Research Communications . taśma 222 , nie. 1 , 6 maja 1996, ISSN 0006-291X , s. 44-49 , doi : 10.1006 / bbrc.1996.0695 , PMID 8630072 .
- ^ G. Levay, K. Pongracz, WJ Bodell: Wykrywanie adduktów DNA w komórkach HL-60 traktowanych hydrochinonem i p-benzochinonem przez znakowanie 32P . W: Carcinogenesis . taśma 12 , nie. 7 , lipiec 1991, ISSN 0143-3334 , str. 1181-1186 , doi : 10.1093 / carcin / 7.12.1181 , PMID 2070482 .
- ↑ Światowa Organizacja Zdrowia: hydrochinon . W: Światowa Organizacja Zdrowia (red.): Kryteria zdrowia środowiskowego . taśma 157 . Genewa 1994.
- ^ BA Hill, HE Kleiner, EA Ryan, DM Dulik, TJ Monks: Identyfikacja multi-S-podstawionych koniugatów hydrochinonu metodą HPLC-kulometrycznej analizy macierzy elektrod i spektroskopii mas . W: Badania chemiczne w toksykologii . taśma 6 , nie. 4 , lipiec 1993, ISSN 0893-228X , s. 459-469 , doi : 10.1021 / tx00034a012 , PMID 8374043 .
- ↑ Vangala V. Subrahmanyam, Prema Kolachana, Martyn T. Smith: Metabolizm hydrochinonu przez ludzką mieloperoksydazę: Mechanizmy stymulacji przez inne związki fenolowe . W: Archiwa Biochemii i Biofizyki . taśma 286 , nie. 1 , 1 kwietnia 1991, ISSN 0003-9861 , s. 76-84 , doi : 10.1016 / 0003-9861 (91) 90010-G ( sciencedirect.com [dostęp 30 czerwca 2020]).
- ↑ Europejska Agencja Chemikaliów (ECHA): Wnioski z oceny substancji i raport z oceny .
- ↑ Wspólnotowy kroczący plan działań ( CoRAP ) Europejskiej Agencji Chemikaliów (ECHA): Hydrochinon , dostęp 26 marca 2019 r.