Hydroksymetylofurfural
| Formuła strukturalna | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||||||||
| Generał | ||||||||||||||||||||||
| Nazwisko | Hydroksymetylofurfural | |||||||||||||||||||||
| inne nazwy |
|
|||||||||||||||||||||
| Formuła molekularna | C 6 H 6 O 3 | |||||||||||||||||||||
| Krótki opis |
białe ciało stałe |
|||||||||||||||||||||
| Identyfikatory zewnętrzne / bazy danych | ||||||||||||||||||||||
| ||||||||||||||||||||||
| nieruchomości | ||||||||||||||||||||||
| Masa cząsteczkowa | 126,11 g mol- 1 | |||||||||||||||||||||
| Stan fizyczny |
mocno |
|||||||||||||||||||||
| gęstość |
1,21 g cm- 3 − |
|||||||||||||||||||||
| Temperatura topnienia |
32-35 °C |
|||||||||||||||||||||
| temperatura wrzenia |
114 ° C (1,3 godz. Pa ) |
|||||||||||||||||||||
| instrukcje bezpieczeństwa | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Dane toksykologiczne | ||||||||||||||||||||||
| W miarę możliwości i zwyczajowo stosowane są jednostki SI . O ile nie zaznaczono inaczej, podane dane dotyczą warunków standardowych . | ||||||||||||||||||||||
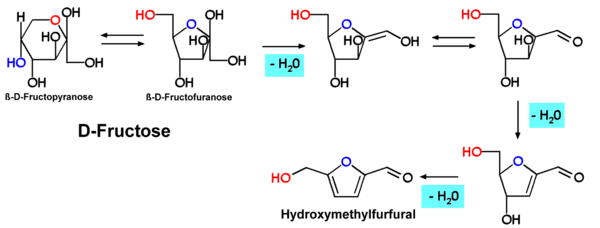
Hydroksymetylofurfural , HMF lub 5-(hydroksymetylo)furfural , także 5-oksymetylofurfural , to związek aldehydowo - furanowy, który powstaje podczas termicznego rozkładu cukru lub węglowodanów . HMF można wykryć w wielu produktach spożywczych poddanych obróbce termicznej, w tym w mleku, sokach owocowych, napojach alkoholowych, miodzie itp. Aktualne badania dotyczą wykrywania HMF w papierosach . HMF może być stosowany do modyfikacji w produkcji tworzyw sztucznych. Heksozy, zwłaszcza fruktoza , tworzą HMF poprzez wielokrotne (katalizowane kwasem) odwodnienie.
historia
Ten organiczny związek 1895 była po raz pierwszy opisana przez G. Tępe przez odwodnienie z fruktozy i sacharozy z kwasem szczawiowym produkowane i niezależnie J. Kiermeyer. Ponadto francuski chemik Louis Maillard zaobserwował w 1912 roku, w ramach swojej pracy badawczej nad nieenzymatycznymi reakcjami glukozy i lizyny, jej powstawanie w reakcji Maillarda nazwanej jego imieniem .
Występowanie
HMF w miodzie
Niewielka ilość HMF w miodzie jest wyznacznikiem jego świeżości i naturalności. Wysoka wartość HMF wskazuje na przedłużone ogrzewanie lub przechowywanie. Kiedy miód jest podgrzewany, fruktoza zamienia się w HMF. Zawartość HMF w świeżo ekstrahowanym miodzie jest bardzo niska i przy prawidłowym przechowywaniu wzrasta o ok. 2-3 mg/kg rocznie, w zależności od wartości pH i temperatury przechowywania. Przechowywanie w temperaturze pokojowej (21°C) może zwiększyć zawartość HMF do 20 mg/kg w ciągu roku. UE ustaliła maksymalny limit HMF na 40 mg/kg dla miodu produkowanego w warunkach europejskich. Niektóre krajowe stowarzyszenia pszczelarskie domagają się jeszcze niższych wartości, m.in. Na przykład Niemieckie Stowarzyszenie Pszczelarstwa zezwala na maksymalnie 15 mg / kg dla swojej pieczęci „Prawdziwy niemiecki miód”.
HMF w miodzie wykrywany jest najczęściej za pomocą wysokosprawnej chromatografii cieczowej lub tzw. metody Winklera . Szybki test do oznaczania HMF jest dostępny w firmie Merck KGaA od 2009 roku . W teście o nazwie „Reflectoquant® HMF” niewielką ilość miodu rozcieńcza się wodą destylowaną w stosunku 1:4 , pasek testowy zanurza się w próbce, a następnie mierzy w reflektometrze RQflex .
Tabela 1: Zawartość 5-HMF w różnych produktach spożywczych w mg/kg przy wystarczająco dużych pomiarach
| jedzenie | Zawartość w mg/kg (wartość średnia) |
| kochanie | 9,1 |
| sok jabłkowy | 7,4 |
| Sok winogronowy | 6,3 |
| Powidła śliwkowe | 410,9 |
| baton z musli | 36,3 |
| Suszone śliwki | 350,8 |
| Napój w proszku do kawy | 286,1 |
| Chleb żytni mieszany | 44,5 |
| Migdał, pokryty cukrem | 155,5 |
| Napój z suszonych śliwek | 1022.1 |
Produkcja i synteza
Powstawanie hydroksymetylofurfuralu obserwowano m.in. podczas karmelizacji heksoz (np. fruktozy, maltozy, glukozy). Mechanizm powstawania odpowiada schematowi prowadzącemu do furfuralu w pentozach .
Reakcję tę wykazują również cukry polimeryczne, takie jak skrobia lub celuloza. Wiadomo, że heksozy mogą przekształcać się w siebie poprzez przegrupowanie Lobry-de-Bruyn-Alberda-van-Ekenstein . Podczas prażenia z korzeni cykorii, do wytwarzania zamiennika kawy jest inulina częściowo przekształca się hydroksymetylofurfural, który dostarcza do kawy jak aromat.
W jednoetapowej syntezie może być celuloza w obecności sprzężonych katalizatorów chlorek miedzi(II) / chlorek chromu(II) w cieczy jonowej chlorek 1-etylo-3-metyloimidazoliowy jako rozpuszczalnik w temperaturze 80-120°C do 5- hydroksymetylofurfural (HMF ). W tych warunkach synteza jest około dziesięciokrotnie szybsza niż w przypadku konwencjonalnej hydrolizy katalizowanej kwasem.
Reakcja Maillarda
Reakcja Maillarda jest reakcja chemiczna pomiędzy aminokwasami i cukrami redukującymi, które daje rumiane pokarmy ich charakterystyczny smak. Reakcja jest formą brązowienia nieenzymatycznego, które zazwyczaj przebiega szybko od około 140 do 165°C (280 do 330°F). W wyższych temperaturach karmelizacja (brązowienie cukru, charakterystyczny proces), a następnie piroliza (końcowy rozpad prowadzący do spalania) stają się bardziej wyraźne. Jednym z produktów końcowych reakcji Maillarda jest 5-hydroksymetylofurfural (5-HMF).
posługiwać się
5-hydroksymetylofurfural w chirurgii
Wykazano, że przedoperacyjne suplementy mikroelementów w przyspieszonych programach chirurgicznych zmniejszają powikłania, skracają regenerację, a tym samym obniżają koszty. Efekty metaboliczne kombinacji kwasu α-ketoglutarowego (AKG) i 5-hydroksymetylofurfuralu (5-HMF) wpłynęły na poprawę wydolności i redukcję stresu oksydacyjnego w chirurgii płuc. Doustna suplementacja kombinacją kwasu α-ketoglutarowego i 5-HMF może być zatem kolejnym krokiem w multimodalnym podejściu do programów chirurgii przyspieszonej.
Znaczenie fizjologiczne
Możliwa rakotwórczość
Amerykański Narodowy Instytut Nauk o Zdrowiu Środowiskowym naraża HMF na wysokie ryzyko rakotwórczości. Wynika to z faktu, że inni członkowie tej grupy związków wykazują właściwości rakotwórcze. Badania nad szkodliwością samego HMF były dotychczas prowadzone tylko w ograniczonym zakresie.
W badaniach różnych substancji pod kątem właściwości przeciwnowotworowych nie można było wykazać takiego efektu dla 5-HMF.
Uważa się, że możliwa błędna interpretacja właściwości rakotwórczych opiera się na fakcie, że 5-HMF był izolowany jako czysta substancja (> 99%) tylko przez kilka lat. Najczystszy 5-HMF to bezbarwny proszek.
Bezpieczeństwo i toksyczność
Przeprowadzono liczne, ale rozbieżne badania dotyczące potencjalnego potencjału genotoksycznego lub rakotwórczego HMF. Różnice w wynikach można przypisać różnym stężeniom HMF zastosowanym w badaniach, z których niektóre były niezwykle wysokie i dalekie od rzeczywistych warunków. Jednak na tej podstawie EFSA zaleciła w 2005 r. wartość progową 540 μg/osobę/dzień, jak również stwierdzono w przeglądzie Capuano. Ta wartość jest nierealistyczna, ponieważ szacunkowe spożycie HMF wynosi 4-30 mg/osobę/dzień i może czasami wynosić nawet 350 mg, z czym niemiecka instytucja oceny ryzyka, BfR, doszła w 2011 r. do następującej oceny: „5 -HMF- Zgodnie z aktualnym stanem wiedzy naukowej, zawartość w żywności jest bezproblemowa pod względem zdrowotnym ”. 5-HMF znajduje się również w dużych ilościach między innymi w niektórych produktach spożywczych. w suszonych owocach 25-2900 mg/kg, produktach karmelowych 110-9500 mg/kg lub kawie (instant) 400-4100 mg/kg. Bardzo obszerne i szczegółowe badanie działania rakotwórczego HMF opisano w raporcie NTP, w którym stwierdza się, że nie ma dowodów na działanie rakotwórcze 5-HMF u szczurów w warunkach tych 26-letnich badań zgłębnikiem (188- 375 mg / kg). Na tej podstawie BfR wywnioskował, że najwyższa dawka uzyskana z doświadczeń na zwierzętach wynosiła od 80 do 100 mg/kg masy ciała bez działań niepożądanych. Przy średniej masie ciała 70 kg oznacza to 5600-7000 mg.
Farmakokinetyka i metabolizm
Wcześniejsze badania farmakokinetyczne zostały omówione przez Ulbrichta i Czoka, którzy podawali szczurom i myszom doustnie lub dożylnie dawkę 100 mg HMF/kg masy ciała. Podany doustnie HMF szybko zniknął z przewodu pokarmowego, aw osoczu krwi i moczu wykryto jedynie śladowe ilości . Sugeruje to, że HMF jest szybko metabolizowany . Po krótkim czasie wstrzyknięty dożylnie HMF nie był już wykrywany w osoczu krwi, natomiast w moczu i żółci wykryto jedynie niewielkie ilości. Podobne obserwacje poczynił Germond. Po podaniu doustnym lub dożylnym pojedynczych dawek 5 HMF przez zgłębnik w zakresie od 0,08 do 330 mg/kg, mniej niż 1% radioaktywności zostało zatrzymane w narządach jamy ciała iw kale. 85% radioaktywności zostało wyeliminowane po 8 godzinach, a 95-100% radioaktywności po 24 godzinach. Kwas 5-hydroksymetylo-2-furoesowy (HMFA) i N-(5-hydroksymetylo-2-furoilo)glicyna zidentyfikowano jako metabolity metodą NMR i MS . Jellum stwierdził u ludzi, że około 50% było wydalane z moczem w postaci HMFA i kwasu furano-2,5-dikarboksylowego (FDCA) po podaniu pozajelitowym HMF z roztworami fruktozy. W moczu nie stwierdzono niezmienionego HMF ani koniugatów z glicyną . Godfrey podawał HMF doustnie myszom i szczurom w dawkach 5-500 mg/kg. 60-80% podanych dawek było wydalane z moczem w ciągu 48 godzin. Jako metabolity zidentyfikowano HMFA, FDCA i N-(5-hydroksymetylo-2-furoilo)glicynę. Ostatnie badania farmakokinetyczne przeprowadził Monien. Autorzy potwierdzili, że HMF jest szybko wydalany i po krótkim czasie nie można go już wykryć w moczu. W badaniu z udziałem 6 zdrowych ochotników wcześniej zidentyfikowano kwas 5-hydroksymetylo-2-furoesowy, kwas 5-karboksylowy-2-furoiloglicynę, N-5-hydroksymetylo-2-furoiloglicynę i kwas 5-karboksylowy-3- furoilo-aminometan jako Metabolity metodą HPLC-MS/MS po spożyciu 3944 μmol (497 mg) lub 486 μmol (61,2 mg) 5-HMF, które zawarte są w soku śliwkowym lub suszonych śliwkach. Szacowany całkowity odzysk metabolitów wynosił odpowiednio 46,2% i 14,2% dawki 5-HMF w ciągu pierwszych 6 godzin po spożyciu. 5-Sulfometylofurfural (5-SMF), prawdopodobnie utworzony przez sulfokoniugację, który okazał się / został określony jako mutagenny i rakotwórczy, nie był obserwowany jako metabolit w powyższych raportach, z wyjątkiem niedawnego badania przeprowadzonego przez Monien. Autorzy wykazali, że SMF powstaje u myszy leczonych HMF. Do analizy wykorzystano LC-MS/MS. Jednak SMF nie został znaleziony jako metabolit u ludzi.
funkcjonować
Ogólny mechanizm 5-hydroksymetylofurfuralu
Głównym zadaniem 5-HMF jest kowalencyjne eliminowanie amoniaku / amin . Reaguje z reaktywnymi formami azotu (RNA), takimi jak peroksyazotyn i wiąże wolne rodniki w swoim stabilnym układzie rezonansowym. 5-HMF skutecznie zwiększa specjalny transport tlenu singletowego, nasycenie, wychwyt i produkcję energii w komórkach. Usuwa azot uwalniany w wyniku rozpadu aminokwasów (równoważąc własną chemię azotu w organizmie i zapobiegając przeciążeniu azotem). Ponadto przekształca 5-HMF nadtlenek produkcji w wewnętrznej mitochondrialnego membrany pobliżu koenzymu złożonej z H 2 O, CO 2 i w postaci utleniającego bursztynianu . Ponadto 5-HMF jest bardzo skuteczną, niekontrolowaną enzymatycznie substancją detoksykującą amoniak, która tworzy pochodne azometyny i jest usuwana bezpośrednio przez mocznik (np. transport amoniaku z mózgu).
Sposób działania - wewnątrzkomórkowy
Do oceny skuteczności wychwytywania 5-HMF wybrano cztery typy wolnych rodników, w tym resztę DPPH pochodzącą z azotu , reszty anionowe pochodzące z tlenu i anionów ponadtlenkowych oraz reszty alkilowe pochodzące z węgla . 5-HMF miał najsilniejszą aktywność zmiatania reszty hydroksylowej przy IC50 22,8 µM, w porównaniu ze stosunkowo słabą resztą alkilową przy IC50 45,0 µM. 5-HMF wykazał znaczną siłę (p <0,05) w wychwytywaniu rodników hydroksylowych w różnych stężeniach, z proporcjami zapytań wynoszącymi 92% (100 μM), 62% (25 μM), 30% (10 μM) i 7% (1 μM). ). Obliczono, że wartość IC50 5-HMF wynosi 22,8 μM. Jeśli chodzi o strukturę 5-HMF, zawiera kilka interesujących funkcjonalnych grup reaktywnych, takich jak podwójne wiązania , aldehydowy atom tlenu i inny tlen obecny w pierścieniu furanowym, który z łatwością może przyciągać elektrony ; ponadto grupa hydroksylowa może tworzyć tlen singletowy nawet po uwolnieniu jonu wodorowego . Te cechy powinny być głównymi czynnikami w jego aktywności antyoksydacyjnej poprzez zmiatanie nadmiernej produkcji wolnych rodników w organizmie i zmniejszenie aktywności enzymu utleniającego (MPO) lub zwiększenie zdolności enzymów antyoksydacyjnych glutationu (GSH) i dysmutazy ponadtlenkowej (SOD) przy poziom genów. Systematycznie oceniano następujące właściwości 5-HMF: jego działanie przeciwutleniające; Utlenianie białek błonowych; hamowanie enzymu utleniającego mieloperoksydazy (MPO); oraz ekspresję enzymów antyoksydacyjnych zawierających selen glutationu (GSH) i dysmutazy ponadtlenkowej (SOD) na poziomie genów. Aktywność antyoksydacyjna 5-HMF jest spowodowana bezpośrednim wymiataniem komórkowych ROS, a zatem 5-HMF może zostać opracowany jako silny kandydat przeciwutleniający do hamowania tworzenia komórkowych ROS. Najnowsze wyniki potwierdzają hamujący wpływ 5 HMF na nitrowanie tyrozyny przez peroksyazotyn .
Sposób działania - wewnątrz- i zewnątrzkomórkowy
Dzięki budowie 5-HMF jest nie tylko wyjątkowo stabilnym pseudo-aromem, ale dzięki swojej grupie karbonylowej posiada w pełni sprzężony układ rezonansowy. W swoim rozległym systemie rezonansowym, który tworzy długowieczne rodniki, 5-HMF może utrzymywać stabilne elektrony rodnikowe (np. peroxynitrite ). Kolejnym pozytywnym efektem jest eliminacja ONOO- ( peroxynitrite ), środka silnie utleniającego i deaminującego nukleotydy, oraz rodników OH* (po rozpadzie peroxynitrite ), które niszczą błony zdrowych komórek. 5-HMF został zidentyfikowany jako nowo odkryty lek, który indukuje reduktazę chinonową (QR). Jest to dobrze znany enzym detoksykacyjny fazy II.
Porównanie 5-HMF z witaminami
Przeciwutleniacze, takie jak witaminy C i E, reagują ze wszystkimi wolnymi rodnikami, m.in. H. także „niezbędne” rodniki in situ (obrona immunologiczna), co prowadzi do wielu dysfunkcji. 5-HMF eliminuje głównie wysoce reaktywne rodzaje azotu (RNS) (np. nadtlenki ), ale nie „niezbędne”. W swojej funkcji usuwania wolnych rodników zwracają się ku wysoce potencjalnym substancjom (np. rodnikowi witaminy C). Substancje te mogą również powodować niekontrolowane zaburzenia czynnościowe (np. dysfunkcję NOS).
literatura
- ↑ b c d Sheet hydroksymetylofurfural z Alfa Aesar, dostępne w dniu 14 marca 2010 roku ( PDF )(Wymagany JavaScript) .
- ↑ a b c Karta katalogowa 5-(hydroksymetylo)-furano-2-karbaldehydu (PDF) firmy Merck , dostęp 4 kwietnia 2011 r.
- ↑ G. Düll: O wpływie kwasu szczawiowego na inulinę . W: Chemiker-Zeitung . taśma 19 , nie. 116 , 1895, s. 216-217 .
- ↑ Jarosław Lewkowski: Synteza, chemia i zastosowania 5-hydroksymetylofurfuralu i jego pochodnych. W: ChemInform. 34, 2003, doi : 10.1002 / podb.200302269 .
- ↑ a b Maillard i in.: Action des acid amines sur les sucres; formation de melanoidines par voie méthodique [Działanie aminokwasów na cukry. Tworzenie melanoidyn w sposób metodyczny. Comptes Rendus (w języku francuskim). 154: 66-68.
- ↑ Catherine Billaud, Jean Adrian: Louis – Camille Maillard, 1878-1936 . W: Recenzje żywności Międzynarodowe . taśma 19 , nie. 4 , s. 345-374 , doi : 10.1081/fri-120025480 ( tandfonline.com [dostęp 22 maja 2017]).
- ↑ DIN 10751-1:2010-08: Badanie miodu – Oznaczanie zawartości hydroksymetylofurfuralu – Część 1: Metoda fotometryczna wg Winklera .
- ↑ a b c Opinia nr 030/2011: Zgodnie z aktualną wiedzą naukową zawartość 5-HMF w żywności nie stanowi problemu zdrowotnego. BfR, 15 maja 2011, dostęp 30 października 2019 .
- ↑ Ben-Erik van Wyck: Rośliny spożywcze światowej prasy drzewnej, 2006, ISBN 0-88192-743-0 . s. 134.
- ^ Y. Su, HM Brown, X. Huang, X. Zhou, JE Amonette, ZC Zhang: Jednoetapowa konwersja celulozy do 5-hydroksymetylofurfuralu (HMF), uniwersalna platforma chemiczna . W: ap. Kataliza . A 361, 2009, s. 117-122. doi : 10.1016 / j.apcata.2009.04.002 .
- ↑ Podsumowanie w: Chem. Ing. Techn. 81, 2009, s. 679.
- ↑ Matzi i wsp.: Wpływ przedoperacyjnej suplementacji mikroelementami w chirurgii płuc. Prospektywne randomizowane badanie doustnej suplementacji złożonego kwasu a-ketoglutarowego i 5-hydroksymetylofurfuralu, Eur J CardThorac Surg, 32 (2007): 776-782.
- ↑ H. Xiao, KL Parkin: Izolacja i identyfikacja potencjalnych środków przeciwnowotworowych z ekstraktów metanolowych z zielonej cebuli (Allium cepa) . W: Fitochemia . 68, nr 7, 2007, s. 1059-1067.
- ^ H. Xiao, KL Parkin: Indukcja aktywności enzymatycznej fazy II przez różne związki selenu . W: Odżywianie i nowotwory . 55. Nr 2, 2006, s. 210-223. doi : 10.1207 / s15327914nc5502_13 .
- ↑ Capuano, Fogliano i in.: Akrylamid i 5-hydroksymetylofurfural (HMF): przegląd metabolizmu, toksyczności, występowania w żywności i strategiach łagodzenia skutków, LWT - Food Science and Technology 44, (2011), 793-810.
- ↑ Ocena grupy aromatyzującej 66 (FGE.66) 1: Uwzględnienie alkoholu furfurylowego i pokrewnych substancji aromatyzujących ocenionych przez JECFA (spotkanie 55) strukturalnie związanych z furfurylem i pochodnymi furanu z dodatkowymi substytutami łańcucha bocznego i heteroatomami, które zostały ocenione przez EFSA w FGE.13 (2005) (EFSA-Q-2008-032R), Dziennik EFSA (2009) ON-752, 1-39.
- ↑ Raport techniczny NTP z badań toksykologicznych i kancerogenezy 5-HMF (CAS nr 67-47-0) u szczurów F344/N i myszy B6C3F1 (badania zgłębnikowe), Narodowe instytuty zdrowia służby zdrowia publicznego USA Departament zdrowia i człowieka usługi (2008)
- ↑ Ulbricht i wsp.: Przegląd 5-hydroksymetylofurfuralu (HMF) w roztworach pozajelitowych, Fundamental Applied Toxicology, 1984: 4 (5); 843-853.
- ↑ Czok: Tolerancja 5-hydroksymetylofurfuralu (HMF). Komunikat II: efekty farmakologiczne, Z. Ernährwiss, 1970: 10 (2), 103-110.
- ↑ Germond i wsp.: Szybka i całkowita eliminacja z moczu [14C]-5-hydroksymetylo-2-furaldehydu podawanego szczurom doustnie lub dożylnie. Toxicol Environ Health, 1987; 22: 79-89.
- ↑ Jellum i wsp.: Obecność pochodnych furanu u pacjentów otrzymujących dożylnie roztwory zawierające fruktozę, Clinica Chimica Acta, 1973: 47 (2); 191-201.
- ↑ Godfrey i in.: Dystrybucja i metabolizm 5-hydroksymetylofurfuralu u samców szczurów F344 i myszy B6C3F1 po podaniu doustnym, Journal of Toxicology and Environmental Health, 1999: 57; 199-210.
- ↑ b c Monien wsp. Konwersja Składnika wspólne żywnościowych 5-hydroksymetylofurfuralu w mutagenne i rakotwórcze siarkowy Ester u myszy in vivo, Toxicol Chem Res, 2009, 22 (6), 1123-1128....
- ↑ a b Prior i in.: Identyfikacja i wydalanie z moczem metabolitów 5-(hydroksymetylo)-2-furfuralu u ludzi po spożyciu suszonych śliwek lub suszonego soku śliwkowego, J Agric Food Chem, 2006; 54 (10): 3744-9.
- ↑ Surh i in.: 5-sulfooksymetylofurfural jako możliwy ostateczny mutagenny i rakotwórczy metabolit produktu reakcji Maillarda, 5-hydroksymetylofurfural, Carcinogenesis, 1994, 15 (10), str. 2375-2377.
- ↑ Blomqvist i wsp.: Glutamina i α-ketoglutaran zapobiegają zmniejszeniu stężenia wolnej glutaminy w mięśniach i wpływają na syntezę białek po całkowitej wymianie stawu biodrowego, metabolizm, tom 44, nr 9 (wrzesień), 1995: s. 1215-1222.
- ↑ Pfliger: Ustalenie i pomiar bezpośredniego i pośredniego działania antyoksydacyjnego AKG, 5HMF i witaminy C w obecności nadtlenonitratu, MTUniversity Graz, 2009, 99 Bl, sygnatura: II 723159.
- ↑ Wagner i in .: Potencjalne działanie antymutagenne i przeciwutleniające produktów reakcji Maillarda stosowanych jako „naturalne środki przeciwbrązowienia”, Mol Nutr Food Res., 2007 kwiecień; 51 (4): 496-50.