Łańcuch oddechowy

| Rodzic |
|
Łańcuch transportu elektronów Oddychanie komórek Fosforylacja oksydacyjna |
| Podrzędny |
| Łańcuch oddechowy błony komórkowej Łańcuch oddechowy błony mitochondrialnej |
| Ontologia genów |
|---|
| QuickGO |
| Rodzic |
|
Błona mitochondrialna błony komórkowej |
| Podrzędny |
|
Kompleks I Kompleks II Kompleks III Kompleks IV |
| Ontologia genów |
|---|
| QuickGO |
Łańcuch oddechowy jest częścią metabolizmu energii większości żywych organizmów . Z jednej strony, termin łańcucha oddechowego oznacza na szlak metaboliczny , czyli łańcuch biochemicznych reakcji redoks , które biorą w jednym miejscu za drugą , których istoty żywe wykorzystać do wytwarzania energii, a z drugiej strony również w całości z kompleksów uczestnicząc w szlaku metabolicznym .
Łańcuch oddechowy jest szczególnym przypadkiem łańcucha transportu elektronów i wraz z chemiosmozą tworzy proces fosforylacji oksydacyjnej .
Elektrony dostarczane przez NADH , FMNH 2 i FADH 2 są przenoszone do środka utleniającego w szeregu procesów redoks . Tak więc - szczególnie w przypadku eukariontów - egzergoniczna reakcja wodoru (H 2 ) i tlenu (1/2 O 2 ) do wody jest podzielona na poszczególne etapy. Zamiast potencjalnie wybuchowego ciepła, uwolniona energia jest wykorzystywana do syntezy uniwersalnej „waluty energetycznej” komórki , ATP , z ADP i fosforanu ( fosforylacja oksydacyjna ). Wodór i nośniki elektronów NADH i FADH 2 bound elektronów i wodoru związany z nim pochodzić z utleniania zewnętrznych donorów elektronów, na przykład - za pomocą cyklu Krebsa - degradacji kwasów tłuszczowych i glikolizy .
U eukariontów łańcuch oddechowy znajduje się w wewnętrznej błonie mitochondriów , u prokariotów w błonie komórkowej . Istnieją również inne donory elektronów niż tłuszcze i cukry oraz inne akceptory elektronów niż tlen.
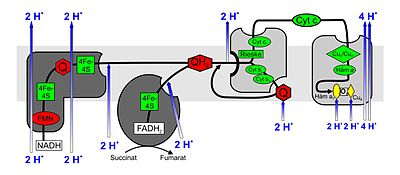
Łańcuch oddechowy jako łańcuch transportu elektronów
Łańcuchy transportujące elektrony składają się z szeregu połączonych szeregowo cząsteczek redoks, które są w stanie przyjmować lub uwalniać elektrony. Poprzez ten łańcuch elektrony są przekazywane z wyższych poziomów energii na niższe, opadają w dół, że tak powiem, stopniowo, przy czym poszczególne cząsteczki redoks mają coraz niższy poziom energii. U eukariotów w łańcuchu reakcji biorą udział kompleksy enzymatyczne od I do IV oraz wodór lub nośniki elektronów ubichinon (koenzym Q) i cytochrom c , które są osadzone w wewnętrznej błonie mitochondrialnej. Białka zaangażowane w łańcuch transportu elektronów (kompleksy I - IV) oraz nośniki elektronów ubichinon i cytochrom c tworzą (złożony) układ redoks .
Transport elektronów jest związany z pobieraniem i uwalnianiem protonów. Poprzez organizację przestrzenną tych procesów lub za pomocą zmian konformacyjnych w strukturze białek wywołanych przepływem elektronów „transportowane” są protony (H + ) (efekt rzeczywisty lub jako efekt sieciowy). Tworzy to „elektrochemiczny gradient protonów ” (składający się z różnicy stężeń protonów i ujemnego potencjału błony wewnątrz mitochondriów, generowanego przez usunięcie dodatnio naładowanych protonów). Energia tego „gradientu elektrochemicznego protonowej” ( protonu siły napędowej „PMF”) stosowany jest przez syntazy ATP, w wyniku wstecznego dyfuzji protonów w wewnętrzną błonę mitochondrialną , zgodnie z obecnie powszechnie przyjętą chemiosmotic teorii z Peter D. Mitchell , ATP z ADP i nieorganicznych Do syntezy fosforanów (w rzadkich przypadkach także fruktozy). Ta fosforylacja nazywana jest fosforylacją łańcucha oddechowego lub fosforylacją oksydacyjną (skrót: Oxphos ) ze względu na sprzężenie z łańcuchem oddechowym .
Funkcje kompleksów łańcucha oddechowego
W dodatku do jego zewnętrznej membrany mitochondrium zawiera wewnętrzną membranę . Przestrzeń między tymi dwiema membranami nazywana jest przestrzenią międzybłonową (przestrzenią okołochondrialną).
Każdy z trzech z czterech kompleksów łańcucha oddechowego obejmuje całkowicie wewnętrzną błonę mitochondrialną (integralną), podczas gdy kompleks II kończy się „ślepo” (obwodowo). Różnica stężenia protonów jest generowana między przestrzenią międzybłonową a wnętrzem ( macierzą ) mitochondrium, które jest następnie wykorzystywane w syntazie ATP do syntezy ATP.
Kompleks I.
NADH: oksydoreduktaza ubichinonu lub dehydrogenaza NADH . Ten ogromny kompleks enzymatyczny (940 kDa ) zredukowany przez NADH , zwłaszcza z cyklu kwasu cytrynowego , ubichinon (UQ lub Q) dla Ubihydrochinonu również ubichinol (podano UQH 2 lub QH 2 ). Kompleks składa się z dwóch części, które razem tworzą jego charakterystyczny kształt litery L. Nukleotydy zawierające flawinę ( FMN ) i centra żelaza i siarki są wymagane jako grupy prostetyczne w jednostce do katalizowania reakcji redoks. Ze względu na transport elektronów związany z reakcjami redoks, do przestrzeni międzybłonowej wpompowywane są 3–4 protony na utleniony NADH. Zakłada się, że sprzężenie z transportem protonów następuje poprzez zmianę konformacyjną enzymu.
Kompleks II
Bursztynian : oksydoreduktaza ubichinonu lub dehydrogenaza bursztynianowa . Kompleks II to enzym dehydrogenaza bursztynianowa z cyklu kwasu cytrynowego. Podczas reakcji w cyklu kwasu cytrynowego bursztynian jest utleniany do fumaranu . FAD to grupa prostetyczna w enzymie. Przekazuje swoje elektrony w kompleksie II do ubichinonu, który jest redukowany do ubichinonu. Kompleks II zawiera również centra żelazowo-siarkowe, takie jak kompleks I; jednak żadne protony nie są pompowane do przestrzeni międzybłonowej.
Kompleks III
Ubihydroquinone (ubichinol): cytochrom c oksydoreduktazę i cytochrom C reduktazy . W kompleksie III cykl Q przyczynia się do powstawania różnicy stężeń protonów poprzez asymetryczną absorpcję i uwalnianie protonów. Podczas utleniania ubichinolu (QH 2 ) do ubichinonu (Q) jedna cząsteczka cytochromu c jest redukowana w jednym cyklu na każdy uwolniony elektron (z ubichinolu), a dwa protony są uwalniane do przestrzeni międzybłonowej. Drugi elektron redukuje inny ubichinon w innym miejscu wiązania na macierzy mitochondrialnej, najpierw do wolnego rodnika ubisemichinonu (QH), a następnie do QH 2 , w wyniku czego dwa protony są absorbowane z macierzy.
Po dwóch półcyklach cztery protony na cząsteczkę ubichinolu są uwalniane do przestrzeni międzybłonowej, dwa protony są usuwane z macierzy mitochondrialnej, a dwa cytochrom c są redukowane. W kompleksie III następuje przekierowanie z transportera dwuelektronowego (ubichinol) do transportera jednoelektronowego (cytochrom c ).
Kompleks IV
Oksydoreduktaza cytochromu c : O 2 lub oksydaza cytochromu c . W kompleksie IV cytochrom c jest utleniany, a tlen jest redukowany do wody. Uwolniona energia jest wykorzystywana do protonów z przestrzeni matrycowej w międzybłonowej pompie kosmicznej .
W kompleksie IV cytochrom c jest utleniany, a elektron jest przenoszony do kompleksu. Po kolejnym przeniesieniu czterech elektronów (e - ) związaną cząsteczkę tlenu można zredukować do dwóch cząsteczek wody (H 2 O). Potrzebne do tego cztery protony (H + ) są usuwane z matrycy. Energia uwolniona podczas redukcji tlenu do wody jest wykorzystywana przez enzym do pompowania kolejnych czterech protonów na cząsteczkę tlenu z matrycy przez wewnętrzną błonę mitochondrialną do przestrzeni międzybłonowej. Dzieje się to poprzez zmiany w strukturze przestrzennej: w konformacji białko ma wysokie powinowactwo do H + i dlatego przyjmuje proton. W przeciwnej konformacji jest małe powinowactwo i proton jest uwalniany na zewnątrz błony.
Oksydaza cytochromu c jest białkiem transbłonowym z dwoma cząsteczkami hemu a (hem a i hem a 3 ) jako grupami prostetycznymi i dwoma centrami miedzi (Cu A i Cu B ) jako kofaktorami . Enzym odpowiedzialny za prawie wszystkie zużycie tlenu (powstawania wody z tlenu i wodoru w łańcuchu oddechowym) wszystkich organizmów tlenowych oddychania.
Inhibitory łańcucha oddechowego

Zidentyfikowano szereg inhibitorów, które hamują łańcuch transportu elektronów w różnych punktach:
- Rotenon i amobarbital ( amobarbital ) hamują kompleks I (oksydazę NADH). Jednakże, ponieważ nie ma to wpływu na transfer elektronów z FADH2 do kompleksu II, fosforylacja oksydacyjna może nadal mieć miejsce.
- Malonian i szereg fungicydów (SDHI) hamuje kompleks II (dehydrogenazę bursztynianową).
- Antybiotyk antymycyna A hamuje kompleks III ( reduktaza cytochromu c ); blokuje przenoszenie elektronów z cytochromu b do cytochromu c1 ; składniki łańcucha oddechowego przed miejscem działania antymycyny A w kompleksie III pozostają zredukowane, wszystkie z tyłu pozostają utlenione. To hamuje zużycie tlenu w kompleksie IV i syntezę ATP w kompleksie V. Fungicydy z klasy strobiluryn hamują również kompleks III w punkcie Q o .
- Cyjanki , azydki i tlenek węgla hamują kompleks IV ( oksydaza cytochromu c ); te cząsteczki blokują miejsce wiązania tlenu . W efekcie prowadzi to do akumulacji elektronów, w wyniku czego składowe łańcucha oddechowego są całkowicie zredukowane, a łańcuch oddechowy zostaje zatrzymany. Zatrucie cyjankami powoduje, że żyły stają się czerwone, ponieważ tlen z hemoglobiny w tętniczkach nie może dyfundować do komórek, ponieważ nie jest tam zużywany. W ten sposób do żył dostaje się bogata w tlen krew.
- antybiotyk oligomycyna hamuje syntazę ATP poprzez wiązanie się z jej siecią (F o część, o dla wrażliwej na oligomycynę), co oznacza, że gradient protonów rozkłada się znacznie wolniej. W rezultacie przepływ elektronów w celu utrzymania tego gradientu znacznie się zmniejsza, a zużycie tlenu spada. Oligomycyna działa również jako odsprzęgacz. W odpowiedniej literaturze nie ma rozróżnienia między F 0 (zero) i F o .
- Biguanidy, takie jak lek przeciwcukrzycowy metformina, prawdopodobnie działają poprzez hamowanie kompleksu I.
Wszystkie wymienione wcześniej inhibitory łańcucha oddechowego prowadzą do zmniejszonego zużycia tlenu. Inhibitory, zwane odsprzęgaczami, zachowują się inaczej.
Odsprzęgacz łańcucha oddechowego
Odsprzęgacze ( protonofory ) zmniejszają potencjał błony mitochondrialnej (gradient protonów). W ten sposób przerywają związek między utlenianiem a fosforylacją. W rezultacie transport elektronów i funkcjonowanie kompleksów I do IV zachodzi całkowicie, ale gradient protonów powstały podczas tego procesu jest anulowany przez sprzęgacz. Oznacza to, że nie może dojść do syntezy ATP. Ponieważ protony nie muszą już być przemieszczane wbrew gradientowi elektrochemicznemu, etapy utleniania w kompleksach I do IV przebiegają znacznie szybciej. Jednocześnie prowadzi to do zwiększonego zużycia tlenu.
- naturalne odsprzęgacze:
- Termogenina , patrz także brązowa tkanka tłuszczowa .
- sztuczne odsprzęgacze:
- 2,4-dinitrofenol jest słabym kwasem. Jest protonowany nad wewnętrzną błoną mitochondrialną ze względu na obfitość jonów H + (niższe pH ), może następnie przechodzić przez błonę i jest deprotonowany śródmiąższowo (wyższe pH).
- Cyjanek karbonylu-m-chlorofenylohydrazon (CCCP)
- Cyjanek karbonylu p- trifluorometoksyfenylohydrazon (FCCP)
- Pentachlorofenol (PCP)
literatura
- M. Saraste: Fosforylacja oksydacyjna w fin de siecle . W: Science , tom 283, 1999, nr 5407, str. 1488-1493, PMID 10066163 .
- Löffler, Petrides: Human biochemistry . 7. edycja.
linki internetowe
- Fosforylacja oksydacyjna - ścieżka referencyjna . KEGG (graficzne przedstawienie mitochondrialnych kompleksów łańcucha oddechowego, angielski)
- Szlaki mitochondrialne: fosforylacja oksydacyjna . (Język angielski)
- Pedro Silva: Chemiczna logika stojąca za ... Oddychaniem i fermentacją . (Język angielski)
- Łańcuch transportu elektronów (animowana ilustracja)
- Łańcuch transportu elektronów . Jassal / Reactome
Indywidualne dowody
- ↑ a b Bruce Alberts i wsp.: Biologia molekularna komórki . Wydanie 4. New York 2002, s. 773-793
- ↑ RG Efremov, R. Baradaran, LA Sazanov: Architektura kompleksu oddechowego I. W: Nature . Tom 465, numer 7297, maj 2010, s. 441-445, doi: 10.1038 / nature09066 . PMID 20505720 .
- ↑ JM Berg, JL Tymoczko, L. Stryer: Biochemistry . Szósta edycja. Spektrum-Verlag, 2007.
- ↑ Bruce Alberts i wsp.: Biologia molekularna komórki . Wydanie 4. New York 2002, s. 791
- ↑ Todd A. Swanson, Sandra I. Kim, Marc J. Glucksman: BRS Biochemistry, Molecular Biology i Genetics . Wydanie 5. Lippincott Raven, 2010, ISBN 978-0-7817-9875-4 , s. 89.
- ↑ LS Huang, D. Cobessi i wsp .: Wiązanie inhibitora łańcucha oddechowego antymycyny z mitochondrialnym kompleksem bc1: nowa struktura kryształu ujawnia zmieniony wewnątrzcząsteczkowy wzór wiązań wodorowych. W: Journal of Molecular biology . Tom 351, numer 3, sierpień 2005, s. 573-597, doi: 10.1016 / j.jmb 2005.05.053 . PMID 16024040 . PMC 1482829 (pełny tekst dowolny).
- ↑ HR Bridges, VA Sirviö et al.: Molekularne cechy biguanidów wymagane do kierowania mitochondrialnego kompleksu oddechowego I i aktywacji kinazy AMP. W: BMC biology. Tom 14, sierpień 2016, s. 65, doi: 10.1186 / s12915-016-0287-9 , PMID 27506389 , PMC 4977651 (pełny tekst dowolny).