Glikoliza
Glikoliza ( , starożytne greckie γλυκύς glykys , słodkie „i λύσις lizy , Uchwała”) jest istot żywych stopniowego wprowadzania monosacharydy (cukry proste), takie jak D - glukoza (dekstroza), od którego pochodzi nazwa glikolizy jest pochodny. Jest to główny proces rozkładu wszystkich węglowodanów u wszystkich eukariontów , w tym zwierząt , roślin i grzybów . U bakterii i archeonów powszechna jest również glikoliza. Jednak niektóre gatunki wykorzystują również inne szlaki metaboliczne do rozkładania glukozy, na przykład ścieżkę Entnera-Doudoroffa (ścieżkę ED). Glikoliza jest centralnym procesem w metabolizmie energetycznym i jednym z nielicznych szlaków metabolicznych wspólnych dla prawie wszystkich organizmów , co wskazuje na bardzo wczesny rozwój.
Demontaż odbywa się w dziesięciu pojedynczych krokach. To tworzy dwie cząsteczki pirogronianu z jednej cząsteczki glukozy . Ponadto powstają dwie cząsteczki adenozynotrójfosforanu (ATP) odpowiednie do przenoszenia energii i dwie cząsteczki NAD + są redukowane do NADH.
Glikoliza nazywana jest też Embden-Meyerhof-Parnas-Weg lub EMP-Weg na cześć jej odkrywców Gustava Embdena , Otto Meyerhofa i Jakuba Karola Parnasa . Termin ścieżka FDP , który odnosi się do produktu pośredniego D - fruktozo-1,6-bisfosforanu (nieaktualny: difosforan fruktozy), nie jest już używany .
Historia odkrycia

Badania nad rozkładem cukru sięgają jeszcze XIX wieku i początkowo rozpoczęły się badaniami nad fermentacją alkoholową , a później fermentacją kwasu mlekowego . W tych fermentacjach etapy reakcji aż do powstania pirogronianu są identyczne. W 1837 roku badacze Charles Cagniard-Latour , Theodor Schwanna i Friedrich Traugott Kützing niezależnie wykazali, że rozkład glukozy do etanolu, znany dziś jako fermentacja alkoholowa , jest powodowany przez organizmy żywe, a mianowicie drożdże . Fakt, że procesy metaboliczne żywych komórek drożdży są odpowiedzialne za beztlenowy rozkład cukrów, był wówczas bardzo kontrowersyjny. Do najbardziej zaciekłych przeciwników tego poglądu należeli wybitni chemicy Jöns Jakob Berzelius , Friedrich Wöhler i Justus von Liebig . Liebig postulował na przykład, że rozkładający się materiał przenosi „wibracje” na cukier do fermentacji, który następnie rozkłada się na etanol i dwutlenek węgla.
Od 1857 roku francuski badacz Louis Pasteur poświęcił się również rozkładowi cukrów w żywych komórkach drożdży . W 1860 opublikował potwierdzenie wyników Cagniarda-Latoura, Kützinga i Schwanna, tym samym przeciwstawiając się hipotezie Liebiga. Zauważył również, że spożycie glukozy jest wyższe w warunkach beztlenowych niż wtedy, gdy tlen jest dostępny dla drożdży. Ta obserwacja jest dziś znana jako „ efekt Pasteura ”.
W tym czasie panowała doktryna, że tylko „ siła życiowa ” (vis vitalis) tkwiąca w żywych istotach może przekształcić glukozę w etanol. Z drugiej strony, w 1858 roku Moritz Traube zasugerował, że za rozkład cukrów w komórkach drożdży odpowiedzialne są same procesy chemiczne, a nie „żywotność” jako taka. W 1897 roku Eduard Buchner w końcu odkrył, że fermentacja alkoholowa jest również możliwa w bezkomórkowym ekstrakcie drożdżowym. Pokazał, że szlak metaboliczny może zachodzić nawet wtedy, gdy komórki nie są już nienaruszone. Jest to znane jako in vitro . Nazwał ten katalitycznie aktywny preparat „ zymase ”, nie wiedząc, że w beztlenowym rozkładzie glukozy bierze udział kilka enzymów. Nawet Maria z Mannasein poruszyła się w tym samym roku w publikacji podobnej do konkluzji Buchnera. Jednak jej praca nie przekonała innych, ponieważ jej dowody były niewystarczające.

Wyjaśnienie poszczególnych etapów glikolizy udało się od początku XX wieku. Więc Arthur Harden i William John Young (1878-1942) mogli mieć decydujący wpływ na rozwiązanie szlaku glikolitycznego i opublikowali swoje odkrycia w serii publikacji z 1905 roku. Odkryli między innymi, że wyizolowane ekstrakty drożdżowe glukoza wydobywa się powoli do etanolu i dwutlenku węgla. , jeśli w ekstraktach nie było fosforanów nieorganicznych. Jednak po dodaniu fosforanów ta reakcja fermentacji , która zachodziła in vitro , czyli bez żywych komórek, mogła ponownie przebiegać szybciej. Udało im się również wyizolować 1,6-bisfosforan fruktozy i wykazać, że jest to produkt pośredni glikolizy. Rozdzielili również bezkomórkowy ekstrakt drożdżowy na dwie frakcje za pomocą dializy . Naukowcy nazwali frakcję niedializowaną, która według Buchnera jest zwykle większymi cząsteczkami i białkami, jako „zymazy”. Była wrażliwa na ciepło. Z drugiej strony frakcja dializowalna składa się z jonów i małych cząsteczek, które mogą przejść przez błonę dializacyjną. To było termicznie stabilne i nazywało się „Cozymazą”. Tylko oba razem mogły wywołać reakcję fermentacji in vitro . Okazało się, że zymaza była mieszaniną enzymów, natomiast koenzymaza zawierała niezbędne dla tych enzymów koenzymy .
W 1918 roku Otto Meyerhof udowodnił, że te same koenzymy są potrzebne do fermentacji kwasu mlekowego w mięśniach i fermentacji alkoholowej. Ze względu na krótki czas życia wielu produktów pośrednich dalsze wyjaśnienie szlaku metabolicznego okazało się trudne. Gustav Embden zaproponował pierwszą sekwencję reakcji biochemicznej glikolizy w 1932 roku. Dwa lata później Karl Lohmann zdołał udowodnić w laboratorium Meyerhofa, że podczas glikolizy powstaje uniwersalny nośnik energii, adenozynotrójfosforan (ATP). Grupa badawcza Meyerhofa przyczyniła się do odkrycia około jednej trzeciej enzymów biorących udział w glikolizie.
Wreszcie, pod koniec lat 30. XX wieku, praca Otto Warburga i Hansa von Euler-Chelpin wyjaśniła etapy reakcji w drożdżach; Z kolei Embden, Meyerhof i Jakub Karol Parnas pracowali z komórkami mięśniowymi. Ponadto Carl i Gerty Cori , Carl Neuberg , Robert Robinson i Erwin Negel, którzy pracowali pod Warburgiem, odegrali ważną rolę w wyjaśnieniu glikolizy.
Wszystkie etapy i enzymy biorące udział w glikolizie są znane od lat 40. XX wieku. Następnie przeprowadzono bardziej szczegółowe badania zaangażowanych enzymów i ich regulację.
Znaczenie komórki
Glikoliza jest najważniejszym sposobem rozkładania węglowodanów w metabolizmie. Przede wszystkim heksozy i triozy to ta jedna ścieżka metabolizowana i przygotowana do dalszej degradacji. Glikoliza zajmuje więc centralne miejsce w metabolizmie katabolicznym . Enzymy biorące udział w reakcjach występują w prawie wszystkich żywych organizmach, więc glikoliza jest również uniwersalna. Glikoliza pełni również inne ważne funkcje:
Wytwarzanie energii w warunkach beztlenowych
W glikolizie energia jest pozyskiwana i dostarczana w postaci dwóch cząsteczek ATP na cząsteczkę zdegradowanej D- glukozy, niezależnie od tego, czy jest tlen dla łańcucha oddechowego, czy nie. Glikoliza wytwarza około jednej piętnastej ilości ATP na cząsteczkę D- glukozy w stosunku do całkowitego rozpadu oksydacyjnego na dwutlenek węgla i wodę w cyklu kwasu cytrynowego iw łańcuchu oddechowym. W związku z tym mniej glukozy jest metabolizowane w warunkach tlenowych, co zaobserwował u drożdży Louis Pasteur w 1861 r. ( efekt Pasteura ).
Ponieważ glikoliza zachodzi również w warunkach beztlenowych , otwiera to pewne korzystne możliwości w metabolizmie. Na przykład mikroorganizmy mogą w ten sposób pozyskiwać energię w środowisku beztlenowym. U kręgowców , gdy mięśnie są w dużym stopniu wykorzystywane, czasami zużywa się więcej tlenu niż jest transportowany do komórek. Z tego powodu komórka w krótkim okresie musi czerpać energię wyłącznie z glikolizy. Dzieje się tak często w przypadku większych zwierząt, takich jak aligatory , krokodyle , słonie , nosorożce , wieloryby i foki , gdzie tlen nie może być dostarczony wystarczająco szybko do utleniającego rozkładu glukozy. Również u ludzi glukoza jest przekształcana w mleczan w szybko kurczących się komórkach mięśniowych w trakcie glikolizy i fermentacji kwasu mlekowego . Wielką zaletą glikolizy jest fakt, że ATP może być udostępniony 100 razy szybciej niż poprzez fosforylację oksydacyjną w łańcuchu oddechowym.
Rośliny czerpią energię z fotosyntezy lub z łańcucha oddechowego. Zdarzają się jednak również sytuacje, w których światło i tlen są chwilowo niedostępne, na przykład podczas nasączania podczas kiełkowania nasion lub gdy korzenie są chwilowo zalewane wodą. W tych warunkach lokalny metabolizm jest utrzymywany przez glikolizę.
Glukoza jako jedyne paliwo
Komórki w mózgu muszą czerpać większość swojej energii z glikolizy, niektóre wyspecjalizowane komórki nawet czerpią energię wyłącznie z glikolizy. Należą do nich np. komórki rdzenia nerkowego , także erytrocyty pozbawione mitochondriów, a co za tym idzie łańcucha oddechowego, oraz plemniki . W końcu obejmuje również szybko rosnące i dzielące się komórki nowotworowe . Otto Warburg odkrył w 1930 roku, że komórki nowotworowe mają znacznie wyższy wskaźnik glikolizy niż zdrowe komórki. W pozytonowej tomografii emisyjnej służy do wizualizacji tkanki nowotworowej.
Bloki budulcowe do materiału komórkowego
Glikoliza nie tylko przygotowuje glukozę do degradacji oksydacyjnej, ale także dostarcza prekursorów do biosyntezy innych związków. Stąd pirogronianowy materiał wyjściowy do syntezy kwasów tłuszczowych oraz niektórych aminokwasów ( L - alanina , L - walina i L - leucyna ). Glicerol-3- fosforan , który odgrywa rolę w syntezie lipidów , powstaje redukcyjnie z fosforanu dihydroksyacetonu . Fosfoenolopirogronian jest materiałem wyjściowym do biosyntezy aminokwasów aromatycznych L - fenyloalaniny , L - tryptofanu i L - tyrozyny , natomiast L - seryna powstaje z 3-fosfoglicerynianu .
Zapewnienie NADH
Oprócz ATP glikoliza wytwarza również czynnik redukujący NADH. Jest on albo ponownie utleniany w łańcuchu oddechowym w celu dalszego wzmocnienia ATP, albo stosowany jako czynnik redukujący do syntezy innych cząsteczek - przynajmniej w celu regeneracji NAD + w fermentacjach .
Etapy reakcji
Lokalizacja komórkowa
Glikoliza zachodzi w cytoplazmie w komórce . W organizmach wielokomórkowych, takich jak ludzie, glikoliza zachodzi we wszystkich (zróżnicowanych) typach komórek. Rośliny dokonują również glikolizy w plastydach .
Przegląd ogólny

Glu-6-P = glukozo-6-fosforan
Fru-6-P = fruktozo-6-fosforan
Fru-1,6-bP = fruktozo-1,6-bisfosforan
DHAP = fosforan dihydroksyacetonu
GAP = aldehyd 3-glicerynowy
1 , 3-bPG = 1,3-bisfosfoglicerynian
3-PG = 3-fosfoglicerynian
2-PG = 2-fosfoglicerynian
PEP = fosfoenolopirogronian
Pyr = pirogronian
Rozkład glukozy do pirogronianu zachodzi w ten sam sposób zarówno w warunkach niedoboru tlenu ( beztlenowe ) jak i przy wystarczającym zaopatrzeniu w tlen ( tlenowe ). W przeciwieństwie do łańcucha oddechowego, tlen (O 2 ) nie jest zużywany.
Glikolizę można podzielić na dwie fazy. Pierwsza faza to faza przygotowawcza, w której energia jest najpierw inwestowana w postaci ATP. Polega na rozszczepieniu heksozowej D- glukozy na dwa fosforany triozowe: fosforan dihydroksyacetonu (DHAP) i gliceraldehydo-3-fosforan (GAP) (patrz rysunek). Tutaj DHAP jest w CAP dla drugiej fazy izomeryzacji . To przygotowuje cukier do faktycznego rozkładu.
W drugiej fazie dwie cząsteczki GAP są przekształcane w dwie cząsteczki pirogronianu (Pyr) w kilku etapach pośrednich. W procesie powstają dwie cząsteczki NADH i cztery cząsteczki ATP. Faza ta dostarcza energii w postaci 4 ATP i 2 równoważników redukcji NADH.
Całkowity bilans glikolizy można zatem sformułować w następujący sposób:
Faza przygotowawcza
Pierwszym krokiem w glikolizy jest fosforylacja z D- glukozy (Glc) i glukozo-6-fosforan (G6P). W zależności od typu komórki, reakcja ta jest heksokinaza lub glukokinazy (heksokinazy IV) katalizuje , w którym jedna cząsteczka ATP inwestycji. Ma to dwie zalety: Z jednej strony błona komórkowa jest przepuszczalna dla glukozy dzięki obecnym w niej kanałom glukozowym (np. GLUT-1 ), ale nie dla glukozo-6-fosforanu wytwarzanego przez fosforylację. W rezultacie gromadzi się w komórce. Z drugiej strony fosforylacja glukozy zmniejsza stężenie glukozy w komórce, podczas gdy stężenie G6P wzrasta w odwrotnym kierunku. Początkowa fosforylacja powoduje, że wewnątrz komórki jest mniej glukozy niż na zewnątrz komórki. Ponieważ wewnątrzkomórkowe stężenie glukozy jest w związku z tym nierównowagi w stosunku do zewnątrzkomórkowego, dalsza glukoza przepływa wzdłuż powstałego gradientu stężenia przez kanały glukozowe komórki. W rezultacie faworyzowane jest wchłanianie glukozy.
U bakterii fosforylacja w pierwszym etapie glikolizy nie jest katalizowana przez hekso- lub glukokinazy, ale przez system fosfotransferazy cukrowej zależnej od fosfoenolopirogronianu (PEP) .
Glukozo-6-fosforan jest następnie przekształcany w izomeryczny fruktozo-6-fosforan (F6P) przez izomerazę glukozo-6-fosforanową . Enzym preferuje wiązanie alfa-anomeru G6P, produktem reakcji jest α- D -fruktozo-6-fosforan. W standardowych warunkach równowaga reakcji izomeryzacji znajduje się po stronie G6P. Ponieważ jednak F6P nadal szybko reaguje, zostaje wycofany z układu reakcyjnego, tak że nie ustala się równowagi i reakcja izomeryzacji przebiega na korzyść F6P.
 |
ATP, ADP heksokinaza lub glukokinaza |
 |
Glukozo- 6-fosforanu izomeraza  |

|
| α- D - glukoza | α- D - glukozo-6-fosforan | α- D - fruktozo-6-fosforan |
Fruktozo-6-fosforan jest następnie poddawany działaniu pierwszego kluczowego enzymu glikolizy, fosfofruktokinazy 1 , ufosforylowanego cząsteczką ATP do fruktozo-1,6-bisfosforanu (F1,6bP), w wyniku czego powstaje ADP. Enzym preferuje beta-anomer F6P, podczas gdy alfa-anomer powstał we wstępnej reakcji. Nie stanowi to jednak problemu, ponieważ oba anomery są w równowadze ( mutacja ). W anaerobowych bakterii, kilka roślin, pierwotnych komórkach eukariotycznych, a niektóre Archaea, ten etap jest katalizowany przez pyrophosphate- fosfofruktokinaza zależnego (EC 2.7.1.90), w których pirofosforan (PP I , z angielskiego pirofosforanu nieorganiczna ) są używane zamiast ATP.
 |
ATP, ADP fosfo fruktooligosacharydy kinazy |

|
| β- D -fruktozo-6-fosforan | β- D - fruktozo-1,6-bisfosforan |
Ponowne zainwestowanie energii jest tanie i konieczne z dwóch powodów: Z jednej strony ten etap – oprócz glukokinazy i kinazy pirogronianowej – sprawia, że glikoliza jest nieodwracalna w warunkach fizjologicznych. Z drugiej strony dostarczana tutaj energia umożliwia rozszczepienie heksozy w następnym etapie, a tym samym powstanie dwóch fosforylowanych trioz do dalszej degradacji, fosforanu dihydroksyacetonu (DHAP) i aldehydu 3-glicerynowego (GAP). Atomy węgla C1-C3 z F1,6bP znajdują się w DHAP, podczas gdy atomy C w GAP pochodzą z jednostki C4-C6 F1,6bP.
Reakcja rozszczepiania jest bardzo niekorzystna w standardowych warunkach (ΔG 0 '= +24 kJ/mol) i nie zaszłaby. Jednak ze względu na szybki metabolizm obu produktów reakcji zachodzi ona w stanie zbliżonym do równowagi w warunkach fizjologicznych. Fosforan dihydroksyacetonu jest przekształcany w D -gliceroaldehydo-3-fosforan przez izomerazę triosefosforanową (TIM) . Ta stereospecyficzna izomeryzacja w kierunku GAP jest promowana przez fakt, że GAP jest dalej rozkładany w glikolizie, a zatem stężenie w komórce jest utrzymywane na niskim poziomie. Bez dalszego metabolizmu równowaga między DHAP i GAP byłaby silnie po stronie ketonu, czyli DHAP (22:1).
 |
Aldolaza |
 |
Triozy fosforan izomeraza  |

|
| β- D -fruktozo-1,6-bisfosforan | Dihydroksy aceton fosforan |
D - 3-fosforan aldehydu glicerolowego |
Faza amortyzacji
Każda z dwóch powstałych cząsteczek gliceraldehydo-3-fosforanu jest utleniana na początku fazy amortyzacji glikolizy przez dehydrogenazę gliceraldehydo-3-fosforanu (GAPDH). W reakcji NAD + jest redukowany do NADH. Utlenianie grupy aldehydowej (GAP) do grupy karboksylowej jest bardzo korzystne energetycznie. Służy do łączenia nieorganicznego fosforanu z grupą karboksylową. Tworzy to mieszany bezwodnik kwasowy 1,3-bisfosfoglicerynian (1,3-BPG). Równowaga tej reakcji jest po stronie eduktu GAP w porównaniu z 1,3-BPG (10:1). Jednak szybka konwersja produktu uniemożliwia ustalenie się równowagi i stale tworzy się 1,3-BPG, a wysokie stężenie NAD + w porównaniu z NADH sprzyja konwersji w jednym kierunku.
Alternatywną drogą w erytrocytach , od 1,3-bisfosfoglicerynianu do 3-fosfoglicerynianu , jest cykl Rapoport-Luebering , który przebiega przez produkt pośredni 2,3-bisfosfoglicerynian i którego centralnym enzymem jest trójfunkcyjna mutaza bisfosfoglicerynian .
 |
NAD + NADH + Pi + H + glyceraldehyde- 3-fosforan Dehydrogenaza  |

|
| D -gliceraldehydo-3-fosforan | D - 1,3-bisfosfoglicerynian |
W następnym etapie kinaza fosfoglicerynianowa generuje jedną cząsteczkę ATP podczas przekształcania 1,3-bisfosfoglicerynianu w 3-fosfoglicerynian poprzez przeniesienie reszty fosforanowej na ADP. Energia uwolniona podczas poprzedniego utleniania jest zatem zachowana przez gromadzenie ATP. Zachodzące tu tworzenie ATP z ADP jest przykładem fosforylacji łańcucha substratu . Jeśli komórka ma już dużo ATP (a tym samym mało ADP), reakcja jest kontynuowana w tym momencie, dopóki wystarczająca ilość ADP nie będzie ponownie dostępna. Ta regulacja sprzężenia zwrotnego jest ważna, ponieważ ATP rozkłada się stosunkowo szybko, gdy nie jest używane. Zapobiega to nadprodukcji ATP.
Na tym etapie bilans energetyczny glikolizy jest zrównoważony: użyto dwóch cząsteczek ATP, a dwie odzyskano
 |
Fosfo Glycerate kinazy ADP, ATP 
|

|
| D -1,3-bisfosfoglicerynian | D - 3-fosfoglicerynian |
Niezależna od kofaktora mutaza fosfoglicerynianowa (PGM) katalizuje następnie konwersję 3-fosfoglicerynianu do 2-fosfoglicerynianu. Podczas tego procesu grupa fosforanowa jest tymczasowo przenoszona na resztę aminokwasową enzymu. W erytrocytach reakcja ta jest katalizowana przez zależny od kofaktora PGM, w którym jako produkt pośredni powstaje 2,3-bisfosfoglicerynian.
2-fosfoglicerynian jest następnie odwadniany do fosfoenolopirogronianu (PEP) za pomocą enolazy . Dlatego enzym ten nazywany jest również dehydratazą 2-fosfoglicerynianową. PEP jest związkiem fosforylowanym o bardzo wysokim potencjale przenoszenia grup . Jest to wykorzystywane w ostatnim etapie glikolizy w celu uzyskania kolejnej cząsteczki ATP. Tutaj kinaza pirogronianowa (PK) katalizuje konwersję PEP do pirogronianu (= anion kwasu pirogronowego) z przyrostem ATP. Jednak nie prowadzi to bezpośrednio do pirogronianu, ale raczej do równowagi enolopirogronianu. Przy pH 7 równowaga jest po stronie formy ketonowej. Ten etap jest również regulowany przez ADP, jest to trzecia, nieodwracalna reakcja w przebiegu glikolizy.
 |
Fosfo Glycerate mutase 
|
 |
H 2 O enolazy  |
 |
Kinaza pirogronianowa ADP ATP |
|
| D -3-fosfoglicerynian | D - 2-fosfoglicerynian | Fosfoenolopirogronian | pirogronian |
W przypadku braku fosforanów rośliny mogą hydrolizować PEP do pirogronianu bez uzyskiwania ATP, co ma miejsce w wakuolach . Zaangażowany enzym to fosfataza PEP (EC 3.1.3.60), która uwalnia nieorganiczny fosforan i przeciwdziała w ten sposób niedoborowi fosforanów.
Regeneracja kofaktora NAD +
W glikolizie dwie cząsteczki NAD + są redukowane do NADH na cykl. Przez większość czasu stężenie komórkowe NAD + jest bardzo niskie, dzięki czemu zostanie szybko zużyty bez ponownego utleniania. W rezultacie NAD + musi zostać zregenerowany, inaczej glikoliza ulegnie zatrzymaniu. Sposób, w jaki to się dzieje, zależy od tego, czy warunki są beztlenowe czy tlenowe . Ponadto wpływa to na dalszą ścieżkę degradacji pirogronianu.
Warunki tlenowe
W warunkach tlenowych pirogronian ulega dekarboksylacji oksydacyjnej w kompleksie dehydrogenazy pirogronianowej do acetylo-CoA . Tworzy to jedną cząsteczkę dwutlenku węgla i jedną cząsteczkę NADH. Acetyl-CoA wchodzi następnie w cykl kwasu cytrynowego , w którym jest całkowicie utleniany do dwóch cząsteczek dwutlenku węgla. Podczas tych etapów utleniania powstają dodatkowe cząsteczki NADH. Te i te powstałe w wyniku glikolizy są ostatecznie ponownie utleniane w trakcie łańcucha oddechowego ze zużyciem tlenu, dzięki czemu NAD + jest ponownie dostępny dla glikolizy i cyklu kwasu cytrynowego. Jednocześnie podczas tych etapów powstają kolejne cząsteczki ATP. Podczas gdy prokariota mogą wytworzyć w sumie 38 cząsteczek ATP na cząsteczkę glukozy, równowaga u eukariontów zależy od sposobu, w jaki NADH wytworzony w cytozolu przechodzi przez błonę mitochondrialną (transport jabłczanowo-asparaginianowy lub transport glicerol-3-fosforanowy ).
U eukariontów cykl kwasu cytrynowego odbywa się w macierzy mitochondrium , podczas gdy glikoliza zachodzi w cytozolu. NAD + i NADH nie mogą swobodnie dyfundować przez błonę wewnętrzną mitochondrium i brakuje specjalnych translokatorów . Wymiana NAD + i NADH zachodzi zatem albo za pośrednictwem wahadłowego jabłczanu-asparaginianu, albo wahadłowego glicerolu-3-fosforanu.
W literaturze glikoliza i następujący po niej rozkład pirogronianu do dwutlenku węgla w procesach cyklu kwasu cytrynowego i łańcucha oddechowego są czasami błędnie określane jako glikoliza tlenowa . Jednak glikoliza kończy się wytworzeniem pirogronianu i zachodzi zarówno w warunkach tlenowych, jak i beztlenowych.
Warunki niedotlenienia
→ patrz również główne artykuły fermentacja alkoholowa , fermentacja kwasu mlekowego
Jeśli tlen nie jest dostępny lub jest tylko w ograniczonym zakresie, pirogronian można dalej przekształcać redukcyjnie, na przykład w fermentacji kwasu mlekowego lub w fermentacji alkoholowej . W fermentacji mlekowej pirogronian jest redukowany do L - mleczanu za pomocą NADH , w fermentacji alkoholowej jest dekarboksylowany i redukowany do etanolu . W obu przypadkach NADH jest utleniany do NAD + i jest dostępny do dalszych rund glikolizy. W przeciwieństwie do tlenowej ścieżki degradacji, na tych etapach fermentacji nie powstaje ATP.
W fermentacji alkoholowej drożdże wytwarzają etanol z pirogronianu w dwóch etapach reakcji, które są katalizowane przez dwa enzymy, dekarboksylazę pirogronianową (EC 4.1.1.1) i dehydrogenazę alkoholową . NADH wytwarzany przez glikolizę jest utleniany do NAD + . Bakterie, na przykład bakterie kwasu mlekowego, a także komórki mięśniowe u ludzi, obsługują fermentację mlekową (patrz również rysunek po prawej). Tutaj pirogronian jest redukowany do mleczanu przez dehydrogenazę mleczanową przy użyciu NADH, dzięki czemu glikoliza może być kontynuowana. Reakcja ta jest silnie egzergiczna zarówno w warunkach standardowych, jak i fizjologicznych (ΔG 0 ′ = -25 kJ/mol lub ΔG = -14,8 kJ/mol).
Fermentacja (homofermentacyjna) kwasu mlekowego jest czasami określana jako glikoliza beztlenowa . Jest to jednak mylące, ponieważ glikoliza kończy się utworzeniem pirogronianu i zachodzi zarówno w warunkach tlenowych, jak i beztlenowych.
Ponieważ glikoliza zachodzi w cytozolu komórek, może również zachodzić w komórkach bez mitochondriów. Tutaj jednak NADH nie może zostać utleniony do NAD + przez cykl kwasu cytrynowego i łańcuch oddechowy , ale bez zużycia tlenu poprzez redukcję pirogronianu do mleczanu, katalizowanego przez dehydrogenazę mleczanową. Tak więc, gdy cząsteczka glukozy ulega rozkładowi, w erytrocytach powstają tylko dwie cząsteczki ATP, które jednak zaspokajają potrzeby tych komórek.
Aspekty energetyczne
Pozycja równowagi
| krok | Reakcja w glikolizie | ΔG 0 ' [kJ / mol] | ΔG [kJ/mol] |
|---|---|---|---|
| 1 | Glukoza + ATP → glukoza-6-P + ADP | -16,7 | -33.9 |
| 2 | Glukoza-6-P ⇌ fruktoza-6-P | +1,7 | -2,9 |
| 3 | Fruktoza-6-P + ATP → Fruktoza-1,6-bP + ADP | -14,2 | -18,8 |
| 4. | Fruktoza-1,6-bP ⇌ DHAP + G-3-P | +23,9 | -0,2 |
| 5 | DHAP ⇌ LUKA | +7,6 | +2,4 |
| 6. | GAP + P i + NAD + ⇌ 1,3-bis-P-glicerynian + NADH + H + | +6,3 | -1,3 |
| 7th | 1,3-bis-P-glicerynian + ADP ⇌ 3-P-glicerynian + ATP | -18,9 | +0,1 |
| ósmy | 3-fosfoglicerynian ⇌ 2-fosfoglicerynian | +4,4 | +0,8 |
| 9 | 2-P-glicerynian ⇌ PEP + H 2 O | odpowiednio +7,5 i +1,8 | +1,1 |
| 10 | PEP + ADP → pirogronian + ATP | -31.7 | -23,0 |
Większość reakcji glikolizy jest energetycznie niekorzystna w standardowych warunkach przy pH 7. Zmiana entalpii swobodnej G 0 ' jest często dodatnia, tak że te reakcje są endergoniczne i nie zachodzą (patrz tabela wartości ΔG 0 '). Glikoliza zakończyłaby się w czwartym etapie.
| Metabolit | Stężenie [mM] |
|---|---|
| glukoza | 5.0 |
| Glukoza-6-P | 0,083 |
| Fruktoza-6-P | 0,014 |
| Fruktoza-1,6-bP | 0,031 |
| DHAP | 0,140 |
| Czapka | 0,019 |
| 1,3-bis-P-glicerynian | 0,001 |
| 3-PG | 0,120 |
| 2-PG | 0,030 |
| WERWA | 0,023 |
| pirogronian | 0,051 |
| P i | 0,001 |
Z definicji stężenie molowe reagentów odpowiada w takich warunkach 1 mol·l -1 . Nie można tego jednak wykorzystać jako podstawy do obliczeń, ponieważ żywe komórki nie mogą generować ani utrzymywać tak wysokich stężeń. Z drugiej strony, aby dokonać sensownej oceny, należałoby znać rzeczywiste stężenia substancji. Jeśli jest to mierzone w warunkach fizjologicznych , zmianę entalpii swobodnej G można obliczyć ponownie (patrz tabela valuesG wartości, stężenie metabolitów).
Do obliczania tych wartości szczególnie odpowiednie są erytrocyty. Erytrocyty czerpią całą swoją energię z glikolizy. Wszystkie inne reakcje komórkowe również zachodzą w cytoplazmie, ponieważ nie mają one ani mitochondriów , jądra komórkowego ani retikulum endoplazmatycznego . Ułatwia to również oddzielenie składników komórek. Bez mitochondriów nie ma reakcji łańcucha oddechowego ani cyklu kwasu cytrynowego . W przeciwnym razie określenie ilościowe zaangażowanych koenzymów byłoby znacznie trudniejsze. Przecież szlak pentozofosforanowy ma tylko niewielki udział w metabolizmie erytrocytów, nie ma też biosyntezy białek ani lipidów. Pozwala to na łatwe wyizolowanie i oznaczenie glikolitycznych produktów pośrednich.
W 1965 roku w ludzkich erytrocytach oznaczono stężenia substancji ( stan ustalony ) pośrednich glikolitycznych związków (patrz tabela po prawej). Stwierdzono, że niektóre półprodukty występują w bardzo niskich stężeniach. Biorąc pod uwagę te stężenia, równowaga odpowiednich reakcji zmienia się w taki sposób, że w warunkach fizjologicznych cała glikoliza jest odwracalna z wyjątkiem trzech reakcji (ΔG około 0 kJ · mol- 1 ).
W tych reakcjach stężenie molowe pozostaje tak niskie, ponieważ powstające produkty są szybko przekształcane, a następnie usuwane z układu w wyniku nieodwracalnych reakcji. Te trzy nieodwracalne reakcje są katalizowane przez kluczowe enzymy glukokinazę lub heksokinazę, fosfofruktokinazę 1 i kinazę pirogronianową. Dzięki szybkiej, nieodwracalnej konwersji przy użyciu jednego z kluczowych enzymów, stężenia substancji wcześniej wytworzonych produktów są wystarczająco obniżone – glikoliza może przebiegać w jednym kierunku.
Przy obliczaniu położenia równowagi w warunkach fizjologicznych małe, ale dodatnie wartości ΔG powodują niektóre reakcje, np. w izomeryzacji 3-fosfoglicerynianu do 2-fosfoglicerynianu (ΔG = +1,1 kJ mol- 1 ). Ściśle mówiąc, wartości te nie mogą być całkowicie poprawne, ponieważ reakcja naprzód może mieć miejsce tylko przy ujemnych wartościach ΔG. Ponieważ jednak zachodzi glikoliza, zakłada się, że za tę sprzeczność odpowiadają błędy pomiarowe w określaniu stężeń substancji.
Posiadanie trzech punktów kontrolnych ma dwie konsekwencje. Po pierwsze, glikolizę można skutecznie regulować w tych punktach, aby można ją było szybko włączyć lub wyłączyć w zależności od stanu energetycznego komórki. Po drugie, obecna równowaga umożliwia również odwrotną reakcję glikolizy, glukoneogenezę . Z wyjątkiem trzech enzymów stosowane są wszystkie enzymy glikolizy.
Wydajność
W standardowych warunkach konwersja D- glukozy w dwie cząsteczki mleczanu uwalnia 183,6 kJ/mol energii (ΔG 0 ’= −183,6 kJ/mol):
Aby zbudować dwie cząsteczki ATP z dwóch cząsteczek ADP i fosforanu nieorganicznego (P i ), wymagane jest 61,0 kJ / mol:
Ponieważ glikoliza łączy te dwie reakcje poprzez fosforylację łańcucha substratu, uwalniana jest energia 122,6 kJ / mol:
ΔG 0 '= (−183,6 + 61) kJ mol -1 = -122,6 kJ mol -1
W standardowych warunkach, gdy glukoza jest rozkładana na mleczan w warunkach beztlenowych, 33% dostępnej energii jest wykorzystywane do budowy dwóch cząsteczek ATP. Ponieważ w warunkach fizjologicznych do nagromadzenia ATP wymagane jest około 50 kJ mol- 1 , wydajność energetyczna jest również nieco wyższa, około 50%.
rozporządzenie
Glikoliza służy do dostarczania energii, zwłaszcza jeśli powstały pirogronian jest dalej rozkładany w warunkach tlenowych. Jeśli natomiast występuje stan korzystny energetycznie, glukoza jest magazynowana i przekształcana w inne metabolity w trakcie anabolizmu wraz ze zużyciem energii.
Dlatego regulacja glikolizy ma kluczowe znaczenie. Na przykład nie powinien przebiegać równolegle do ich reakcji odwrotnej, glukoneogenezy . W takim przypadku mówi się o „ bezczynnym procesie ”, który bezsensownie wykorzystuje ATP i dlatego jest nieproduktywny. Jako wyjątek należy wspomnieć o wytwarzaniu ciepła przez trzmiele , które wytwarzają ciepło poprzez zamierzoną, przeciwbieżną fosforylację i defosforylację fruktozo-6-fosforanu do fruktozo-1,6-bisfosforanu i odwrotnie.
Z biochemicznego punktu widzenia kontrolowane są reakcje nieodwracalne. W warunkach fizjologicznych w glikolizie zachodzą trzy reakcje, które są nieodwracalne. Są katalizowane przez hekso- lub glukokinazę, fosfofruktokinazę-1 i kinazę pirogronianową, a zatem są celem regulacji.
Hekso- i glukokinaza
Heksokinaza jest pierwszym enzymem glikolizy, którego aktywność jest regulowana. Fosforyluje glukozę do glukozo-6-fosforanu (G6P), jednocześnie zużywając ATP, ale może również wykorzystywać inne heksozy jako substrat. G6P jest końcowym produktem reakcji heksokinazy i jako taki allosterycznie hamuje enzym .
Izoenzym heksokinazy, glukokinaza, występujący w wątrobie, nie jest hamowany przez produkt G6P. W przeciwieństwie do heksokinazę, ale także wykazuje wyższą K M wartość. Dlatego glukokinaza zastępuje heksokinazę tylko przy bardzo wysokich stężeniach glukozy. W tych warunkach G6P jest przechowywany jako glikogen w kolejnych etapach i nie jest rozkładany w glikolizie, ponieważ G6P jest również kierowany do innych szlaków metabolicznych. Dlatego wątroba działa jak homeostat do tej poziomu cukru we krwi , jak to utrzymuje go budując lub uszkodzi glukozę.
Specyficzne dla wątroby białko regulatorowe może odwracalnie wiązać się z glukokinazą i w ten sposób ją hamować. Wiązanie tego regulatora z glukokinazą zachodzi w jądrze komórkowym , tak że hamowana glukokinaza pozostaje tam nieaktywna i nie może na nią wpływać inne efektory cytozolowe. To wiązanie jest następnie wzmacniane, jeśli enzym został allosterycznie zmodyfikowany przez fruktozo-6-fosforan. W przeciwieństwie do tego glukoza powoduje odłączenie tego białka wątroby. Gdy stężenie cukru we krwi jest wysokie, glukoza dominuje, tak że regulator może dysocjować i glukoza jest fosforylowana do glukozo-6-fosforanu. Jeśli jednak poziom cukru we krwi spadnie zbyt mocno (poniżej 5 mmol·l -1 ), glukokinaza jest hamowana za pośrednictwem fruktozo-6-fosforanu. Glukoza nie jest już fosforylowana i może ponownie pozostawić wątrobę, aby była dostępna dla innych narządów.
Wreszcie, glukokinaza jest regulowana na poziomie transkrypcji . Hormonu insuliny wpływa ilość glukokinazy w wątrobie. U pacjentów z cukrzycą występuje zaburzenie metaboliczne , ponieważ nie mogą oni wytwarzać wystarczającej ilości insuliny. Mają zbyt niski poziom glukokinazy, nie tolerują wysokiego poziomu cukru we krwi i mają mało glukokinazy w wątrobie.
Fosfofruktokinaza-1
Głównym punktem kontrolnym glikolizy jest fosforylacja Frc-6-P do Frc-1,6-bP przez fosfofruktokinazę-1 (PFK-1). Stanowi pierwszy prawdziwy etap specyficzny dla glikolizy i jest nieodwracalny w warunkach fizjologicznych. Enzym posiada dwa miejsca wiązania ATP. Oprócz miejsca wiązania substratu o wysokim powinowactwie, PFK-1 ma również regulatorowe miejsce wiązania. Zatem ATP może służyć zarówno jako substrat, jak i allosterycznie hamować PFK-1. Jeśli stężenie ATP są wystarczająco wysokie, K K wartość enzymu zwiększa się. Obniża to aktywność PFK-1, dzięki czemu zmniejsza się glikoliza. Niemniej jednak, stężenia ATP w komórce zmieniają się tylko nieznacznie, tak więc samo ATP nie wystarczyłoby do precyzyjnej regulacji. Aktywność PFK-1 zależy zatem również od stężenia AMP i odzwierciedla dostarczanie energii do komórki. AMP działa jako allosteryczny, niekowalencyjny aktywator. Jeśli stan energetyczny komórki jest wysoki (wysokie stężenie ATP, niskie stężenie AMP), enzym jest hamowany, w przeciwnym razie aktywność PFK-1 jest zwiększona, aby wytworzyć więcej ATP.
Nawet cytrynian hamuje allosterynę PFK-1. Cytrynian jest kluczowym metabolitem cyklu kwasu cytrynowego , którego podstawowym celem jest wytwarzanie energii w warunkach tlenowych. Alternatywnie, z cyklu kwasu cytrynowego można pobrać różne cząsteczki prekursorowe. Jeśli jest dużo cytrynianu, cykl kwasu cytrynowego jest nasycony. Dlatego cytrynian hamuje PFK-1 w sensie hamowania produktu końcowego, tak że glikoliza słabiej zasila cykl kwasu cytrynowego.
Na aktywność fosfofruktokinazy-1 wpływa również wartość pH . Niska wartość pH hamuje enzym i spowalnia glikolizę. Dzieje się tak na przykład, gdy mięśnie są napięte i wytwarza się dużo kwasu mlekowego. To obniża wartość pH w komórkach.
Wreszcie, PFK-1 jest allosterycznie aktywowany w stężeniach mikromolowych przez β- D -fruktozo-2,6-bisfosforan (F-2,6-bP). F-2,6-bP promuje glikolizę, jednocześnie hamując fruktozo-1,6-bisfosfatazę . Jest to enzym, który katalizuje odwrotną reakcję w glukoneogenezie w tym momencie . W warunkach fizjologicznych enzym pozostaje praktycznie nieaktywny bez F-2,6-bP. Po związaniu F-2,6-bP z PFK-1 powinowactwo dwóch inhibitorów ATP i cytrynianu jest również zmniejszone.
U bakterii fruktozo-2,6-bisfosforan nie występuje jako aktywator PFK-1.
Kinaza pirogronianowa
Ostatni etap glikolizy jest nieodwracalny i katalizowany przez kinazę pirogronianową (PK). Jest to również regulowane, ale w przeciwieństwie do pozostałych dwóch enzymów w stosunkowo podrzędny sposób. Fruktozo-1,6-bisfosforan i AMP stymulują PK, podczas gdy ATP, acetylo-CoA i L - alanina hamują ją allosterycznie. Izoenzym (forma L), który dominuje w wątrobie i jelitach, może, w przeciwieństwie do formy M występującej w mięśniach, być również fosforylowany przez kinazę białkową A. W aktywności kinazy białkowej A pośredniczy hormonalnie glukagon . W formie ufosforylowanej ten izoenzym jest następnie hamowany stosunkowo silniej przez ATP i alaninę niż niezmodyfikowany PK. Ma to spowolnić rozkład glukozy w wątrobie, aby była łatwiej dostępna dla innych narządów. Defosforylacja jest katalizowana przez fosfatazę .
Inhibitory
Enolaza jest hamowana przez fluor . Octan jodu hamuje dehydrogenazę aldehydu 3-glicerynowego, która utlenia 3-fosforan glicerynowy z fosforanem nieorganicznym i przy udziale NAD + do 1,3-bisfosfoglicerynianu. Modyfikuje grupę SH enzymu, dzięki czemu hamowanie to może być ponownie zniesione przez dodanie merkaptanów .
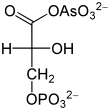
Arsenat , HAsO 4 2- , jest podobny do nieorganicznego fosforanu HPO 4 2- i jest przekształcany w jego miejsce przez dehydrogenazę aldehydo-3-glicerynową. To tworzy 1-arseno-3-fosfoglicerynian z gliceraldehydo-3-fosforanu (patrz rysunek). W przeciwieństwie do 1,3-bisfosfoglicerynianu ten związek arsenianowy, jak każdy inny arsenian acylowy, jest bardzo niestabilny, rozkłada się do 3-fosfoglicerynianu. W rezultacie energia utleniania nie może być już wykorzystywana przez fosforylację łańcucha substratu. Nie ma już kroku w tworzeniu ATP w glikolizie, która nadal ma miejsce, ale nie dostarcza już żadnego ATP netto. Ponieważ arsenian nie jest zużywany, działa już w ilościach katalitycznych. Harden i Young wykazali wpływ arsenianu na glikolizę na początku XX wieku przy użyciu ekstraktów drożdżowych.
patologia
Ze względu na centralną rolę glikolizy w metabolizmie defekty ujawniają się stosunkowo rzadko, ponieważ zaatakowane komórki w większości przypadków obumierają. Dlatego znanych jest tylko kilka chorób i mutacji w glikolizie.
Najbardziej znane są defekty kinazy pirogronianowej, które prowadzą do anemii hemolitycznej . Jeśli pirogronian kinazy nie, bez ATP wytwarza się w ostatnim etapie glikolizy tak, że krwinki nie może zapewnić wystarczająco dużo energii do pracy pomp jonowych w tym błoną cytoplazmatyczną . Powoduje to pęcznienie i pękanie czerwonych krwinek. Jeśli aktywność izomerazy fosforanu triozy jest zmniejszona przez mutację, prowadzi to do tak zwanego niedoboru izomerazy fosforanu triozy . Prowadzi to do uszkodzeń neurologicznych, a także do anemii hemolitycznej, często także do śmierci. Niedobór fosfofruktokinazy prowadzi do choroby Taruiego , która powoduje osłabienie mięśni zależne od wysiłku z bólem mięśni i niedokrwistością hemolityczną.
Wejście innych metabolitów
Oprócz D- glukozy w glikolizie mogą również występować inne metabolity, pod warunkiem, że można je przekształcić w jeden z występujących tam produktów pośrednich. Pentozy i tetrozy są zwykle przekształcane w gliceraldehydo-3-fosforan lub fruktozo-6-fosforan na drodze pentozofosforanowej, a następnie mogą być dalej przekształcane.
Szlaki degradacji di- lub polisacharydów również prowadzą do glikolizy. Na przykład sacharoza dzieli się na glukozę i fruktozę. Sposób dalszego przekształcania fruktozy opisano poniżej. Gdy laktoza jest podzielone , D- glukozy i D - galaktoza są wytwarzane , jest on również przekształcane w glukozę i ulega rozkładowi w glikolizy.
Poszczególne monosacharydy powstają z wielu cukrów w reakcjach enzymatycznych , które w razie potrzeby po izomeryzacji do glukozo-6-fosforanu lub fruktozo-6-fosforanu, mogą wpłynąć bezpośrednio na szlak rozkładu glikolitycznego. Dobrze znanym przykładem jest substancja magazynująca glikogen . Fosforylazy glikogenu zamienia go glukozy 1-fosforanu , która jest następnie izomeryzacji do glukozo-6-fosforanu.
gliceryna
Gliceryna powstaje podczas rozkładu trójglicerydów i może służyć jako prekursor glikolizy lub glukoneogenezy. Cytozolowa kinaza glicerolowa fosforyluje glicerol, zużywając ATP do glicerolu-3-fosforanu , który jest następnie utleniany do fosforanu dihydroksyacetonu. Jest to katalizowane przez cytozolową dehydrogenazę glicerolo-3-fosforanową (cGDH) lub izoenzym w błonie mitochondrium (mGDH). Pierwsza redukuje NAD + , druga redukuje ubichinon .
Fruktoza
Kiedy disacharydowa sacharoza jest rozkładana, uwalniana jest glukoza i fruktoza. U zwierząt wyższych fruktoza jest fosforylowana w wątrobie do fruktozo-1-fosforanu , co jest katalizowane przez fruktokinazę ( ketoheksokinaza , FK) ze spożyciem ATP. Następnie aldolaza B ( aldolaza fruktozo-1-fosforanowa, ALD-B) rozbija fruktozo-1-fosforan na fosforan dihydroksyacetonu (DHAP) i aldehyd glicerynowy . DHAP i aldehyd glicerynowy są przekształcane w 3-fosforan gliceryny. Te dwie konwersje są katalizowane przez izomerazę triozowo-fosforanową (TPI) lub kinazę triozową (TK) opisaną powyżej z konsumpcją ATP. Brak fruktokinazy prowadzi do fruktozurii , autosomalnej recesywnej choroby dziedzicznej u wyższych zwierząt .
W innych narządach heksokinaza może również przejąć funkcję fruktokinazy w celu fosforylowania fruktozy. Ich powinowactwo do glukozy w porównaniu do fruktozy jest znacznie wyższe (95% glukoza, 5% fruktoza).
Mannose
D - mannoza jest składnikiem różnych glikoprotein i polisacharydów . Aby móc wejść w glikolizę, mannoza jest najpierw fosforylowana przez heksokinazę do mannozy-6-fosforanu ze zużyciem ATP. Jest on ostatecznie izomeryzowany do fruktozo-6-fosforanu , który jest katalizowany przez izomerazę mannozo-6-fosforanu (również izomerazę fosfomannozy, EC 5.3.1.8).
Sorbitol
Sorbitol może zostać utleniony do glukozy lub fruktozy na drodze poliolowej .
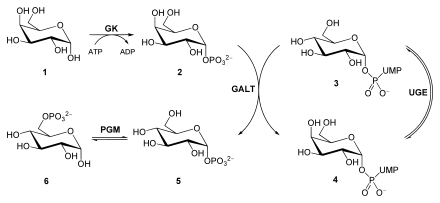
Galaktoza
Gdy laktozę podziale , D- glukozy i D- galaktoza są zwolnione. W celu przekształcenia galaktozy w jej epimer glukozy C4, cukier jest najpierw przekształcany w galaktozo-1-fosforan przez galaktokinazę (GK) przy użyciu ATP . Galaktoza-1-fosforanu uridyl transferazy (GALT) teraz katalizuje wymianę UDP związany glukozy galaktozą. Powoduje to wytwarzanie glukozo-1- fosforanu i UDP- galaktozy . Podczas gdy glukozo-1-fosforan jest izomeryzowany do glukozo-6- fosforanu przez fosfoglukomutazę (PGM), UDP-glukozo-4-epimeraza (UGE) epimeryzuje UDP-galaktozę do UDP-glukozy .
Defekt galaktokinazy objawia się chorobą metaboliczną galaktozemią .
Cechy szczególne roślin zielonych
W roślinach zielonych występują pewne różnice w glikolizie w porównaniu z glikolizą u zwierząt. Zostały one opisane poniżej.
Glikoliza w plastydach
Wiadomo, że glikoliza u roślin przebiega niezależnie od siebie nie tylko w cytoplazmie, ale także w plastydach komórki. Jednak nie zawsze przebiega tam całkowicie, gdyż często brakuje enzymów w fazie amortyzacji, np. mutazy enolazy czy fosfoglicerynianu. Wysoce specyficzne translokatory mogą przenosić związki pośrednie z jednego przedziału komórkowego do drugiego w celu zakończenia wszystkich etapów reakcji glikolizy. W cytozolu wielu jednokomórkowych zielonych alg brakuje cytozolowych enzymów glikolizy, tak że odbywa się to całkowicie w chloroplastach.
Rośliny zielone wykorzystują glikolizę w plastydach, aby rozłożyć skrobię na pirogronian w ciemności lub w tkance niefotosyntetyzującej, ze wzrostem ATP i NADH. Dostarczają również różne cząsteczki prekursorowe do budowy innych produktów, na przykład do syntezy kwasów tłuszczowych.
Izoenzymy są niezbędne do równoległego działania glikolizy zarówno w cytoplazmie, jak iw plastydach . Na przykład w cytoplazmie znajduje się kinaza pirogronianowa, która katalizuje analogiczną reakcję w plastydzie. Wszystkie izoenzymy są zakodowane w genomie rośliny. Przedstawiciele plastydów ulegają translacji w cytoplazmie komórki roślinnej, a następnie są transportowane do organelli . Nadal nie jest jasne, czy izoenzymy powstały w wyniku duplikacji genu z genu prekursora. Możliwy byłby również horyzontalny transfer genów z genomu symbionta prokariotycznego ( teoria endosymbiontów ).
Rola pirofosforanu
Kolejną cechą jest stosowanie pirofosforanu (PP I ) zamiast ATP jako donora fosforanowego w pierwszych reakcjach glikolitycznych. Zaobserwowano to również u niektórych bakterii. Zwykle pirofosforan jest hydrolizowany do dwóch cząsteczek fosforanu przez pirofosfatazę (PPiaza, EC 3.6.1.1). Celem tej hydrolizy jest uczynienie reakcji biochemicznych nieodwracalnymi w warunkach fizjologicznych. Potocznie mówi się, że ta hydroliza „wyciąga” reakcję na jedną stronę. Wyjaśnienie tego jest takie, że hydroliza jest egzoergiczna, tj. w procesie uwalniana jest energia:
PPiaza nie występuje w cytozolu roślin, więc może tam powstać stężenie pirofosforanu do 0,3 mmol/l. Zależna od pirofosforanu fosfofruktokinaza (PFP, EC 2.7.1.90), odkryta w 1979 roku, wykorzystuje pirofosforan do fosforylacji fruktozo-6-fosforanu do fruktozo-1,6-bisfosforanu. Ta reakcja jest również odwracalna i może być również wykorzystana do odwrotnej drogi, glukoneogenezy. Podobnie jak PFK-1, PFP jest regulowany przez fruktozo-2,6-bisfosforan.
Różnorodność metaboliczna fosfoenolopirogronianu
Rośliny wykorzystują PEP z glikolizy na różne sposoby (patrz rysunek po prawej). Zastosowanie PEP jest ograniczone w klasycznym szlaku degradacji glikolitycznej: kinaza pirogronianowa (PK) wykorzystuje PEP jako substrat do bezpośredniego tworzenia pirogronianu. ATP jest generowany przez fosforylację łańcucha substratu. W roślinach, a ponadto PEP służy jako substrat dla karboksykinazy PEP (PEPC), które w szczególności w instalacjach o C 4 - lub Crassulacean metabolizm kwasu jest bardzo ważne. Szczawiooctan , produkt pośredni cyklu kwasu cytrynowego, powstaje z PEP i wodorowęglanu . Szczawiooctan jest następnie redukowany do L - jabłczanu przez cytozolową dehydrogenazę jabłczanową (MDH) . L- Malat jest następnie transportowany do różnych organelli. W mitochondrium może zostać zdekarboksylowany do pirogronianu przez mitochondrialny, zależny od NAD + enzym jabłczanowy (ME). Jest to reakcja obejściowa kinazy pirogronianowej, w której nie wytwarza się ATP, ale jest przydatna w przypadku niedoboru fosforanów. Dzieje się tak, ponieważ fosforan związany w PEP jest ponownie uwalniany i jest dostępny dla rośliny w innych reakcjach. To obejście zostało zademonstrowane w korzeniach grochu .
Plastydowy, zależny od NADP enzym jabłczanowy może wytwarzać pirogronian z jabłczanu L wytwarzanego przez PEPC i MDH . Pirogronian jest tam potrzebny do syntezy kwasów tłuszczowych lub jest transportowany z powrotem do cytozolu. To także omija reakcję kinazy pirogronianowej, co jest korzystne w przypadku braku fosforanów.
Jeśli brakuje fosforanów, fosfataza PEP (PEPase, EC 3.1.3.60) może również uwalniać cenny fosforan. Tutaj PEP jest transportowany do wakuoli , gdzie jest hydrolizowany do pirogronianu przez PEPazę. Pirogronian i fosforan są następnie transportowane z powrotem do cytoplazmy. Jeśli nie ma niedoboru fosforanów, żądanie PEPase jest hamowana przez dostatecznie dużą P ı stężeniu.
Wreszcie istnieje również cytozolowy, niezależny od fosforanu GADH (EC 1.2.1.9), który utlenia aldehyd glicerynowy bezpośrednio do 3-fosfoglicerynianu. Produkowany jest tylko NADPH, ale bez ATP.
rozporządzenie
Istnieje kilka ważnych różnic między regulacją enzymów biorących udział w glikolizie a regulacją u zwierząt. PEP to specjalny efektor allosteryczny, który w przeciwieństwie do procesu u zwierząt może hamować PFK. W przeciwieństwie do tego, fruktozo-1,6-bisfosforan nie może aktywować kinazy pirogronianowej. Podczas gdy fruktozo-2,6-bisfosforan aktywuje PFK u zwierząt, nic takiego nie dzieje się u roślin.
Glikoliza w roślinach zielonych jest regulowana przede wszystkim przez aktywność kinazy pirogronianowej i karboksykinazy PEP, a w drugiej kolejności przez PFK-1 i PFP. W zasadzie ze zwierzętami jest odwrotnie.
Glikoliza w archeonach
W archeonach rozkładających cukier węglowodany są rozkładane na różne sposoby. W hipertermofilnych i termofilnych tlenowcach, na przykład Thermoplasma acidophilum ( Euryarchaeota ) lub Sulfolobus solfataricus (obecnie przeklasyfikowany na Saccharolobus solfataricus [en] , Crenarchaeota ), glukoza jest przekształcana w pirogronian poprzez wariant ścieżki Entner-Doudoroff (ścieżka ED). Natomiast hipertermofilne, fermentujące beztlenowce wykorzystują węglowodany w zmodyfikowanym szlaku EMP, takim jak:
- wśród Euryarchaeota:
- Pyrococcus furiosus ,
- Archaeoglobus fulgidus [pl] (redukujący siarczany) i
- Przedstawiciele rodzaju Thermococcus [en] ;
wśród Crenarchaeota:
Występujące w nim metabolity są podobne do metabolitów glikolizy eukariontów i bakterii, ale do tego celu wykorzystywane są enzymy, które nie mają podobieństwa do enzymów bakterii lub eukariontów. Archaea zawierają ADP- zamiast kinaz zależnych od ATP, na przykład glukokinazę (EC 2.7.1.147) lub fosfofruktokinazę (EC 2.7.1.146). W przeciwieństwie do bakterii nie mają systemu transportu cukru zależnego od PEP. Ostatni etap glikolizy, konwersja PEP do pirogronianu, może być również przeprowadzona przez dikinazę fosforanu pirogronianu (PPDK, EC 2.7.9.1) oprócz PK. Enzym ten katalizuje przekształcenie odwracalnego PEP AMP i PP I pirogronianu, ATP i P ı , chociaż tworzenie pirogronianu jest korzystne w Thermoproteus Tenax . T. tenax jest żyjącym w warunkach beztlenowych, fakultatywnym, heterotroficznym Archeonem z departamentu Crenarchaeota . PPDK wykryto również u bakterii i eukariontów.
Istnieje ważna różnica w utlenianiu 3-fosforanu aldehydu glicerynowego. Jest on albo utleniany bezpośrednio do 3-fosfoglicerynianu przez zależną od NAD(P) + (GAPN) lub dehydrogenazę zależną od ferredoksyny (GAPOR), ale bez włączania nieorganicznego fosforanu. Dlatego na tym etapie nie powstaje żaden ATP w wyniku fosforylacji łańcucha substratu, tak że u większości archeonów formalnie nie uzyskuje się ATP poprzez tę zmodyfikowaną glikolizę. Najlepiej zbadanym szlakiem metabolicznym glikolizy u archeonów jest szlak P. furiosus . Tam odpowiedź netto to:
Kolejną istotną różnicą jest brak allosterycznej regulacji kluczowych enzymów za pomocą efektorów, co zostało opisane powyżej dla bakterii i eukariontów. U T. tenax istnieją przynajmniej przesłanki, że GAPN jest allosterycznie aktywowany przez AMP, glukozo-1-fosforan, fruktozo-6-fosforan, fruktozo-1-fosforan, ADP i rybozo-5-fosforan, podczas gdy NAD (P) H , NADP + i ATP hamują enzym. Może również zachodzić regulacja na poziomie transkrypcji, jak w przypadku GAPDH znalezionego w T. tenax .
ewolucja
Glikoliza występuje w większości bakterii i eukariontów, aw nieco zmodyfikowanej formie w archeonach i bakteriach hipertermofilnych . Sugeruje to, że glikoliza powstała bardzo wcześnie w ewolucji i była już obecna w pierwszych organizmach. Na podstawie porównań filogenetycznych z mikroorganizmami termofilnymi i hipertermofilnymi podejrzewa się, że szlak EMP pojawił się po pojawieniu się szlaku ED. Ponadto pierwotne znaczenie szlaku EMP prawdopodobnie nie dotyczyło rozkładu węglowodanów, ale było odwrotnie, jako glukoneogeneza w celu gromadzenia glukozy. Potwierdza to również teorię, że szlaki metaboliczne budujące węglowodany pojawiły się wcześniej w ewolucji niż te, które rozkładają węglowodany; „Dzisiejsza” glukoneogeneza jest bardziej rozpowszechniona w organizmach we wszystkich trzech domenach niż glikoliza.
Enzymy niższej gałęzi glikolizy (faza amortyzacji) katalizują głównie reakcje odwracalne i najbardziej konserwatywne. Występują również w filogenetycznie starszym szlaku ED. Podobnie jak inne szlaki metaboliczne, były one prawdopodobnie obecne przed oddzieleniem trzech domen żywych organizmów i dlatego należą do najstarszych enzymów. Ze względu na ich zasadnicze znaczenie nie mogły z czasem zostać utracone ani zastąpione przez inne enzymy. Dehydrogenaza gliceroaldehydo-3-fosforanowa jest najbardziej konserwatywną spośród wszystkich enzymów glikolitycznych, tylko 3% domeny katalitycznej uległo zmianie w ciągu 100 milionów lat.
Górna gałąź glikolizy (faza przygotowawcza) prawdopodobnie ustaliła się później. Podczas gdy enzymy zaangażowane w bakterie i eukarionty wykazują wysoką homologię, enzymy występujące w archeonach są wyjątkowe. Wciąż dyskutuje się, czy enzymy dla pierwszej części glikolizy zostały pierwotnie utracone w archeonach i zostały ponownie wprowadzone dopiero później poprzez horyzontalny transfer genów . Alternatywnie, enzymy o podobnych funkcjach mogły zostać użyte do pierwotnej glikolizy, które następnie zostały poddane poważnym modyfikacjom i zmianom sekwencji. W obu przypadkach może to wyjaśniać, dlaczego enzymy glikolityczne w archeonach są tak różne od tych w innych organizmach.
literatura
- Geoffrey Zubay: biochemia. Mcgraw-Hill profesjonalista. Wydanie IV. 1999, ISBN 3-89028-701-8 , s. 293nn.
- Donald Voet, Judith G. Voet: Biochemia. Wiley-VCH 1994, ISBN 3-527-29249-7 , s. 420ff.
- Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Biochemia. 6 edycja. Spektrum Akademischer Verlag, Heidelberg 2007, ISBN 978-3-8274-1800-5 , s. 486ff.
- H. Robert Horton, Laurence A. Moran, K. Gray Scrimgeour, Marc D. Perry, J. David Rawn, Carsten Biele (tłumacz): Biochemia. Wydanie czwarte zaktualizowane. Pearson Studium, 2008, ISBN 978-3-8273-7312-0 , s. 442ff.
- Reginald Garrett, Charles M. Grisham: Biochemia. (Międzynarodowe wydanie studenckie). Wydanie IV. Usługi edukacyjne Cengage, 2009, ISBN 978-0-495-11464-2 , s. 535-562.
- David L. Nelson, Michael M. Cox, Albert L. Lehninger (pierwszy): Lehninger Biochemie. 4., całkowicie zmieniony i exp. Wydanie. Springer, Berlin 2009, ISBN 978-3-540-68637-8 , s. 607-730.
- Ron S. Ronimus, Hugh W. Morgan: Dystrybucja i filogeneza enzymów szlaku Embden-Meyerhof-Parnas z archeonów i bakterii hipertermofilnych wspierają glukoneogenne pochodzenie metabolizmu. W: Archaea 1 (3) 2003, s. 199-221, PMID 15803666 , PMC 2685568 (pełny tekst dowolny)
- WC Plaxton: Organizacja i regulacja glikolizy roślinnej. W: Annu Rev Plant Physiol Plant Mol Biol. 47 (1996), str. 185-214, PMID 15012287 , doi : 10.1146 / annurev.arplant.47.1.185
- T. Dandekar, S. Schuster, B. Snel, M. Huynen, P. Bork: Wyrównanie ścieżki: zastosowanie do analizy porównawczej enzymów glikolitycznych . W: Biochem. J. . 343 Pt 1, październik 1999, s. 115-24. PMID 10493919 . PMC 1220531 (darmowy pełny tekst).
Indywidualne dowody
- ↑ C. Cagniard-Latour: Mémoire sur la fermentation vineuse. W: Annales de chimie et de physique . t. 68, 1837, s. 206-222.
- ↑ Theodor Schwanna: Wstępna informacja dotycząca eksperymentów fermentacji i gnicia. W: Roczniki Fizyki i Chemii . t. 41, 1837, s. 184-193.
- ↑ FT Kützing: Badania mikroskopowe drożdży i octu macierzystego, wraz z kilkoma innymi powiązanymi strukturami roślinnymi. W: Dziennik. Chemia Praktyczna . 11 (1837), s. 385-409.
- ^ E. Racker: Historia efektu Pasteura i jego patobiologii. W: Mol Cell Biochem. 5 (1-2) 1974, s. 17-23, PMID 4279327 , doi : 10.1007 / BF01874168 .
- ↑ J. Liebig: O zjawiskach fermentacji, gnicia i gnicia oraz ich przyczynach. W: Roczniki Farmacji. (Heidelberg) 30 (1839), s. 250-287.
- ^ L. Pasteur: Memoire sur la fermentaçion alcoolique. W: Annales de chimie et de physique. 58 (1860), s. 323-426.
- ↑ M. Traube W: Ann. Fiz. Chem (Poggendorff) 103 (1858), s. 331-344.
- ↑ E. Buchner: Fermentacja alkoholowa bez komórek drożdży (komunikat wstępny). W: Ber. Dt.Chem.Ges . 30 (1897), s. 117-124. (online)
- ↑ Athel Cornish-Bowden: Nowa butelka piwa w starym Eduardzie Buchner i rozwój wiedzy biochemicznej. ISBN 84-370-3328-4 , s. 60.
- ↑ A. Harden, WJ Young: Alkoholowy ferment soku drożdżowego. W: proc. R. Soc. Londyn. B 77 (519) 1906, s. 405-420, doi : 10.1098/rspb.1906.0029 .
- ↑ A. Harden, WJ Young: Alkoholowy ferment soku drożdżowego. Część III.-Funkcja fosforanów w fermentacji glukozy przez sok drożdżowy. W: proc. R. Soc. Londyn. B 80 (540) 1908, s. 405-420, doi : 10.1098/rspb.1908.0029 .
- ↑ Donald Voet, Judith G. Voet, Alfred Maelicke (red.), Werner Müller-Esterl (red.): Biochemie. Wiley-VCH 1992, ISBN 3-527-28242-4 , s. 421f.
- ^ N. Kresge, RD Simoni, RL Hill: Otto Fritz Meyerhof i wyjaśnienie szlaku glikolitycznego. W: J Biol Chem . 280 (4) 2005, s. E3, PMID 15665335 , PDF (bezpłatny dostęp do pełnego tekstu, angielski)
- ^ Albert L. Lehninger, David L. Nelson, Michael M. Cox: Lehninger Biochemie. 3., całkowicie zmieniony i exp. Wydanie. Springer, Berlin 2009, ISBN 978-3-540-41813-9 , s. 584nn.
- ↑ Donald Voet, Judith G. Voet, Alfred Maelicke (red.), Werner Müller-Esterl (red.): Biochemie. Wiley-VCH, 1992, ISBN 3-527-28242-4 , s. 444.
- ↑ Hans W. Heldt, Birgit Piechulla: Biochemia roślin . Wydanie IV. Spektrum Akademischer Verlag, Heidelberg 2008, ISBN 978-3-8274-1961-3 , s. 334.
- ^ Reginald Garrett, Charles M. Grisham: Biochemia. (Międzynarodowe wydanie studenckie). Wydanie IV. Cengage Learning Services, 2009, ISBN 978-0-495-11464-2 , s. 535.
- ↑ Hans W. Heldt, Birgit Piechulla: Biochemia roślin . Wydanie IV. Spektrum Akademischer Verlag, Heidelberg 2008, ISBN 978-3-8274-1961-3 , s. 334.
- ↑ Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Biochemia. 6 edycja. Spektrum Akademischer Verlag, Heidelberg 2007, ISBN 978-3-8274-1800-5 , s. 764.
- ↑ Caroline Bowsher, Martin W. Steer, Alyson K. Tobin: Biochemia roślin. Garland Pub, Nowy Jork, NY 2008, ISBN 978-0-8153-4121-5 , s. 145.
- ^ H. Robert Horton, Laurence A. Moran, K. Grey Scrimgeour, Marc D. Perry, J. David Rawn, Carsten Biele (tłumacz): Biochemie. Badanie Pearsona. Wydanie czwarte zaktualizowane. 2008, ISBN 978-3-8273-7312-0 , s. 448.
- ↑ a b c R. & nnbsp; S. Ronimus, H. & nnbsp;W. Morgan: Dystrybucja i filogeneza enzymów szlaku Embden-Meyerhof-Parnas z bakterii archeonów i hipertermofilnych wspiera glukoneogenne pochodzenie metabolizmu. W: Archeony . 1 (3) 2003, s. 199-221, PMID 15803666 , PMC 2685568 (wolny pełny tekst).
- ↑ a b Caroline Bowsher, Martin W. Steer, Alyson K. Tobin: Biochemia roślin. Garland Pub, Nowy Jork, NY 2008, ISBN 978-0-8153-4121-5 , s. 148.
- ↑ David Nelson, Michael Cox: Lehninger Biochemie. Springera, Berlin; 4., całkowicie zmieniony i exp. Wydanie. 2008, ISBN 978-3-540-68637-8 , s. 713.
- ↑ Caroline Bowsher, Martin W. Steer, Alyson K. Tobin: Biochemia roślin. Garland Pub, Nowy Jork, NY 2008, ISBN 978-0-8153-4121-5 , s. 150.
- ^ B c d Reginald Garrett Charles M. Grisham: biochemii. (Międzynarodowe wydanie studenckie). Wydanie IV. 2009, Cengage Learning Services, ISBN 978-0-495-11464-2 , s. 538.
- ^ B David L. Nelson, Michael M. Cox: Lehninger Podstawy biochemii. Wydanie piąte. Palgrave Macmillan, 2008, ISBN 978-0-7167-7108-1 , s. 553.
- ^ Reginald Garrett, Charles M. Grisham: Biochemia. (Międzynarodowe wydanie studenckie). Wydanie IV. Cengage Learning Services, Australia 2009, ISBN 978-0-495-11464-2 , s. 539.
- ^ S. Minakami, H. Yoshikawa: Badania nad glikolizą erytrocytów. II.Zmiany energii swobodnej i etapy ograniczania szybkości w glikolizie erytrocytów. W: J. Biochem. Vol. 59 (2) 1966, s. 139-144, PMID 4223318 .
- ↑ S. Minakami, H. Yoshikawa: Rozważania termodynamiczne dotyczące glikolizy erytrocytów. W: Biochem. Biofizyka. Res. Vol. 18 (3) 1965, s. 345-349, PMID 14300746 , doi : 10.1016/0006-291X (65) 90711-4 .
- ^ Reginald Garrett, Charles M. Grisham: Biochemia. (Międzynarodowe wydanie studenckie). Wydanie IV. Cengage Learning Services, Australia 2009, ISBN 978-0-495-11464-2 , s. 554.
- ↑ Athel Cornish-Bowden: Nowa butelka piwa w starym Eduardzie Buchner i rozwój wiedzy biochemicznej. Universitat de Valencia, Valencia 1997, ISBN 84-370-3328-4 , s. 148.
- ^ Reginald Garrett, Charles M. Grisham: Biochemia. (Międzynarodowe wydanie studenckie). Wydanie IV. 2009, Cengage Learning Services, ISBN 978-0-495-11464-2 , s. 537.
- ^ EA Newsholme i wsp.: Aktywność difosfatazy fruktozy w mięśniach latających z trzmiela i rola tego enzymu w wytwarzaniu ciepła. W: Biochem J . 128 (1) 1972, s. 89-97, PMID 4343671 , PMC 1173573 (wolny pełny tekst).
- ^ B Reginald Garrett, Charles M. Grishama: biochemii. (Międzynarodowe wydanie studenckie). Usługi edukacyjne Cengage; Wydanie IV. 2009, ISBN 978-0-495-11464-2 , s. 539f.
- ↑ a b c David Nelson, Michael Cox: Lehninger Biochemie. 4., całkowicie zmieniony i exp. Wydanie. Springer, Berlin 2008, ISBN 978-3-540-68637-8 , s. 773ff.
- ^ Reginald Garrett, Charles M. Grisham: Biochemia. (Międzynarodowe wydanie studenckie). Usługi edukacyjne Cengage. Wydanie IV. 2009, ISBN 978-0-495-11464-2 , s. 542f.
- ↑ Müller-Esterl, Werner.: Biochemia: wprowadzenie dla lekarzy i przyrodników . Wydanie I. Elsevier, Spektrum, Akad. Verl, Monachium 2004, ISBN 3-8274-0534-3 , s. 496 f .
- ↑ a b c H. Robert Horton, Laurence A. Moran, K. Gray Scrimgeour, Marc D. Perry, J. David Rawn, Carsten Biele (tłumacz): Biochemie. Badanie Pearsona. Wydanie czwarte zaktualizowane, 2008, ISBN 978-3-8273-7312-0 , s. 468.
- ^ H. Robert Horton, Laurence A. Moran, K. Grey Scrimgeour, Marc D. Perry, J. David Rawn, Carsten Biele (tłumacz): Biochemie. Badanie Pearsona. wydanie czwarte zaktualizowane, 2008, ISBN 978-3-8273-7312-0 , s. 470.
- ↑ Todd A. Swanson, Sandra I. Kim, Marc J. Glucksman: Biochemia BRS, biologia molekularna i genetyka. Wydanie piąte. Lippincott Raven, 2010, ISBN 978-0-7817-9875-4 , s. 65.
- ↑ A. Harden, WJ Young: Alkoholowy ferment soku drożdżowego. Część VI.-Wpływ Arsenatów i Arsenitów na fermentację cukrów przez sok drożdżowy. W: proc. R. Soc. Londyn. B 83 (566) 1911, s. 451-475, doi : 10.1098/rspb.1911.0028 .
- ↑ Todd A. Swanson, Sandra I. Kim, Marc J. Glucksman: Biochemia BRS, biologia molekularna i genetyka. Wydanie piąte. Lippincott Raven, 2010, ISBN 978-0-7817-9875-4 , s. 123.
- ^ B W.C. Plaxton: organizacji i regulacji roślinnego glikolizy. W: Annu Rev Plant Physiol Plant Mol Biol. 47 (1996), str. 185-214, PMID 15012287 , doi : 10.1146/annurev.arplant.47.1.185 .
- ^ Rudolf K. Thauer, Kurt Jungermann, Karl Decker: Oszczędzanie energii w chemotroficznych bakteriach beztlenowych. W: Recenzje bakteriologiczne . t. 41, nr 1, 1977, s. 101.
- ^ B. Siebers, P. Beauty: Niezwykłe szlaki i enzymy centralnego metabolizmu węglowodanów w Archaea. W: Curr Opin Microbiol . 8 (6) 2005, s. 695-705, PMID 16256419 , doi : 10.1016 / j.mib.2005.10.014 .
- ↑ M. Zaparty i wsp.: Centralny metabolizm węglowodanów hipertermofilnego crenarchaeote Thermoproteus tenax: ścieżki i wgląd w ich regulację. W: Arch Microbiol . 190 (3) 2008, s. 231-245, PMID 18491075 , doi : 10.1007/s00203-008-0375-5 .
- ↑ C. & nnbsp;H. Verhees i in. : Unikalne cechy szlaków glikolitycznych w Archaea. W: Biochem J . 375 (Pt & nnbsp; 2) 2003, s. 231-246, PMID 12921536 , PMC 1223704 (wolny pełny tekst).
- ^ AH Romano, T. Conway: Ewolucja szlaków metabolicznych węglowodanów. W: Res. Microbiol. tom 147 (6-7), 1996, str. 448-455, PMID 9084754 ; doi : 10.1016 / 0923-2508 (96) 83998-2
- ↑ RS Ronimus, HW Morgan: Dystrybucja i filogeneza enzymów szlaku Embden-Meyerhof-Parnas z archeonów i bakterii hipertermofilnych wspierają glukoneogenne pochodzenie metabolizmu. W: Archaea 1 (3) 2003, s. 199-221, PMID 15803666 , PMC 2685568 (pełny tekst dowolny).
linki internetowe
- Glikoliza na stronie Ulricha Helmicha
- Jennifer McDowall / Interpro: Białko miesiąca: Enzymy glikolizy. (pol.)