Heksokinaza
| Heksokinaza | ||
|---|---|---|

| ||
| Heksokinaza z drożdży Kluyveromyces lactis | ||
| inne nazwy |
HK |
|
| Podstawowa struktura masy / długości | 50 kDa u prokariontów, 100 kDa u eukariontów | |
| Izoformy | 4 u ssaków | |
| Klasyfikacja enzymów | ||
| WE, kategoria | 2.7.1.1 , kinaza | |
| Typ odpowiedzi | Fosforylacja | |
| Podłoże | Heksoza + ATP | |
| Produkty | Heksozo-6-fosforan + ADP | |
W hexokinases są enzymy z metabolizmem węglowodanów , które fosforylują heksozy (cukry z sześciu atomów węgla) i w ten sposób przekształcić w siebie fosforanu heksozy, takie jak glukoza do glukozo-6-fosforanu . Heksokinazy należą do fosfotransferaz ( EC 2,7).
cechy
Jako kinazy , heksokinazy prowadzą do fosforylacji heksoz; glukozo-6-fosforan jest zwykle tworzony z glukozy przy użyciu trifosforanu adenozyny . Glukozo-6-fosforan jest następnie metabolizowany w trakcie glikolizy lub szlaku pentozofosforanowego .
Rodzaje heksokinaz
Heksokinazy występują we wszystkich sferach istot żywych i należą do ATPaz z fałdem aktynowym . Heksokinazy często występują w kilku izoformach . Istnieją cztery izoformy heksokinazy u ssaków (I, II, III i IV, czyli A, B, C i D). Glukokinaza w ssaków jest izoformą heksokinazy w wątrobie (heksokinazy IV), lecz tylko fosforylacji glukozy. Podczas gdy heksokinazy bakteryjne mają masę molową około 50 kDa , heksokinazy eukariotyczne mają około 100 kDa i składają się z dwóch podobnych części, które prawdopodobnie wyewoluowały z heksokinazy prekursorowej poprzez duplikację genów . Obie części są aktywne enzymatycznie tylko w heksokinazie II.
W niektórych guzach heksokinazy ulegają nadekspresji .
| Rodzaj | opis | gen | Fenotypy |
|---|---|---|---|
| I (A) | występuje we wszystkich tkankach ssaków i jest uważany za „enzym domowy”, na który nie mają wpływu większość zmian fizjologicznych, hormonalnych i metabolicznych | HK1 | Choroba Charcota-Mariego-Tootha typu 4G, |
| II (B) | jest główną regulowaną izoformą w wielu typach komórek i jest podwyższona w wielu typach raka. Jest to heksokinaza, która znajduje się w mięśniach i sercu. Heksokinaza II znajduje się również na zewnętrznej błonie mitochondrialnej, dzięki czemu możliwy jest bezpośredni dostęp do ATP. | HK2 | silnie wyrażany w kilku rodzajach raka, w tym raku piersi i raku okrężnicy |
| III (C) | hamuje substrat w stężeniach fizjologicznych z powodu glukozy | HK3 | nadekspresja w złośliwym guzku pęcherzykowym tarczycy |
| IV (D) | występuje w wątrobie, trzustce, podwzgórzu, jelicie cienkim i prawdopodobnie w niektórych innych komórkach neuroendokrynnych i odgrywa ważną rolę regulacyjną w metabolizmie węglowodanów. W komórkach beta wysp trzustkowych służy jako czujnik glukozy do kontrolowania wydzielania insuliny i podobnie kontroluje uwalnianie glukagonu w komórkach alfa. W hepatocytach wątroby glukokinaza reaguje na zmiany poziomu glukozy w otoczeniu zwiększając lub zmniejszając syntezę glikogenu . | GCK | Cukrzyca o początku dojrzałości typu 2 młodego , |
mechanizm
Wiązanie glukozy
Na podstawie rentgenograficznych badań krystalograficznych heksokinazy z drożdży wykazano, że wiązanie glukozy z miejscem aktywnym powoduje silną zmianę konformacyjną enzymu. Heksokinaza składa się z dwóch płatów, a kiedy glukoza wiąże się, płaty przesuwają się ku sobie. Jeden płat obraca się o dwanaście stopni względem drugiego, co prowadzi do ruchów szkieletu polipeptydowego o 0,8 nm. Zamknięcie luki w heksokinazie spowodowanej przez indukowane dopasowanie zapewnia otoczkę glukozy, z wyjątkiem grupy hydroksylowej na atomie C6, do której ATP przenosi następnie grupę fosforylową. Zmiany strukturalne wywołane glukozą mają dwie zalety:
- Otoczenie glukozy staje się mniej polarne, co sprzyja reakcji z hydrofilową grupą hydroksylową glukozy i końcową grupą fosforanową ATP.
- Heksokinaza wypycha wodę z centrum aktywnego i zapewnia, że woda nie atakuje grupy γ-fosforanowej ATP. Gdyby nastąpiła hydroliza ATP, powstałyby ADP i P i .
Heksokinaza jest aktywna tylko wtedy, gdy obecne są jony Mg 2+ (lub inne dwuwartościowe jony metali, takie jak Mn 2+ ).
Reakcja w miejscu aktywnym
Heksokinaza przeprowadza arbitralny mechanizm reakcji „bi-bi” , w którym enzym przed reakcją tworzy trójskładnikowy kompleks (kompleks białkowy złożony z trzech różnych cząsteczek, które są ze sobą połączone) z glukozą i Mg 2+ –ATP. Grupa hydroksylowa przy atomie C6 glukozy przeprowadza nukleofilowy atak na grupę γ-fosforanową ATP i tworzy ADP jako grupę opuszczającą . Ten mechanizm jest również znany jako mechanizm S N 2 . Produktem jest glukozo-6-fosforan. Kompleksowanie jonu Mg 2+ z ATP przypuszczalnie służy ułatwieniu nukleofilowego ataku na atom fosforu poprzez osłanianie ujemnych ładunków na atomach tlenu. Nie udało się jeszcze ostatecznie określić dokładnej pozycji (miejsc) jonu Mg 2+ w kompleksie z ATP podczas reakcji.
rozporządzenie
Glukozo-6-fosforan jest silnym inhibitorem z hexokinases 1-3 o stałej inhibicji ( K I ) 10-30 mM. Istnieją dwa modele, które pokazują hamujący wpływ glukozo-6-fosforanu:
- Jako inhibitor allosteryczny glukozo-6-fosforan wiąże się mocno z domeną N -końcową w celu stabilizacji zamkniętej konformacji domeny N - końca . Zamknięta domena N -końcowa przypuszczalnie stabilizuje elastyczną subdomenę C -końcowej połowy enzymu (gdzie również znajduje się centrum aktywne) w taki sposób, że zapobiega się wiązaniu z ATP.
- Glukozo-6-fosforan działa jako konkurencyjny inhibitor, który współzawodniczy z ATP o domenę C -końcową jako miejsce wiązania.
W przypadku heksokinazy 1, hamowanie przez glukozo-6-fosforanu może być ponownie podnoszony w stężeniach fizjologicznych P ı . Fang i in . (1998) opisali dwa możliwe mechanizmy uwalniania zahamowania przez P i :
- P i konkuruje z glukozo-6-fosforanu do allosterycznym miejscem wiążącym na N -końcową połowę enzymu.
- P i wiąże się z N -końcową połową enzymu i tym samym wypiera glukozo-6-fosforan z aktywnego centrum w C -końcowej połowie poprzez mechanizm pośredni.
W obu przypadkach, wiązanie się z N -końcową domeną przez P i reguluje katalizy w C regionu-końcową poprzez allosteryczne mechanizmu. Fang i in . wykazali również, że regulatorowe miejsce wiązania Pi znajduje się w domenie N -końcowej, która zawiera również miejsce wiązania glukozo-6-fosforanu o niskim powinowactwie.
Glukokinaza nie jest hamowana przez glukozo-6-fosforan. Pozwala to na ciągłą sygnalizację (np. Wyzwalanie uwalniania insuliny) przy znacznych poziomach G6P.
metabolizm
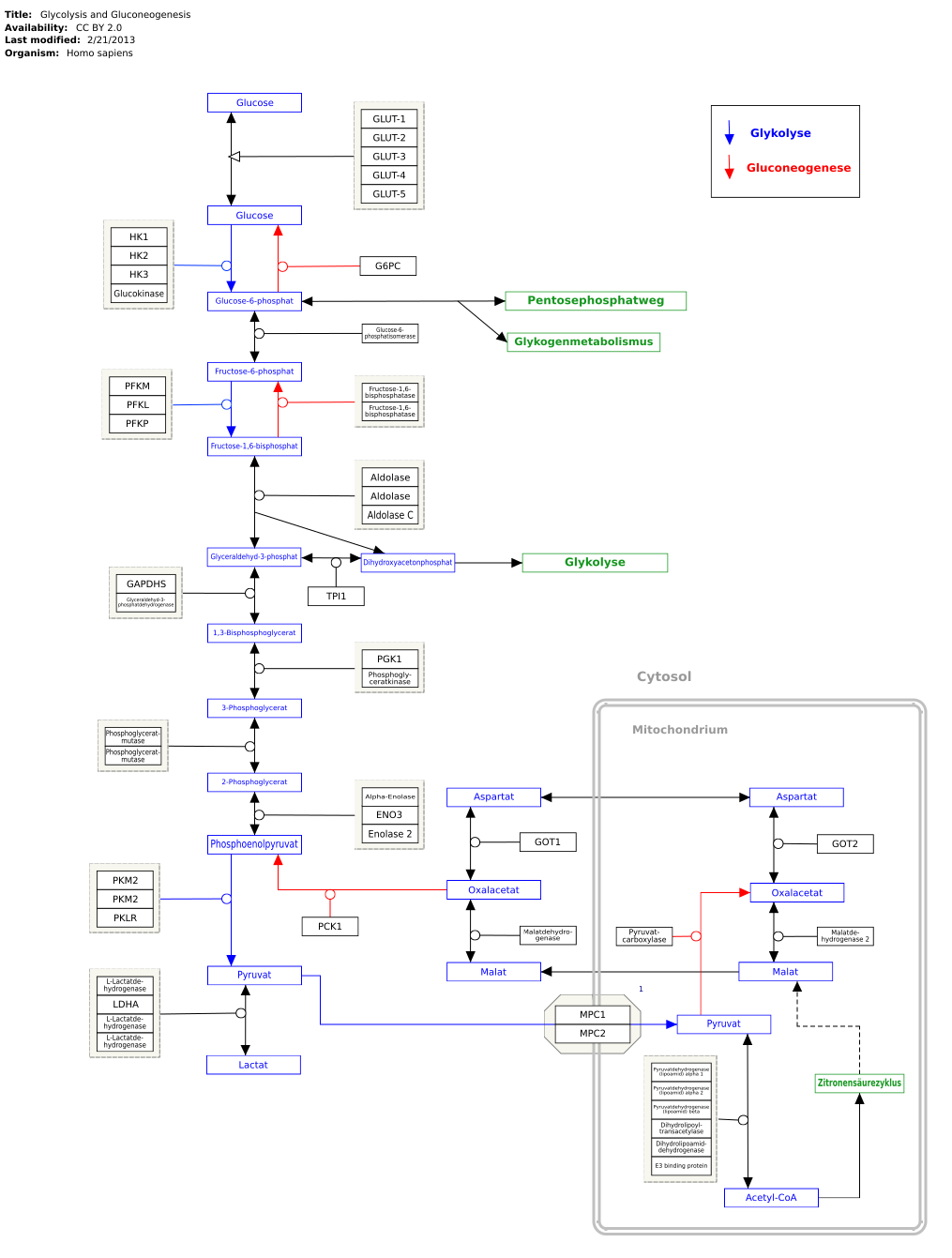
Geny, białka i metabolity są powiązane z odpowiednimi artykułami. Szlak metaboliczny można edytować na WikiPathways :
literatura
- Jeremy M. Berg, John L. Tymoczko, Lubert Stryer : Biochemistry. 6. wydanie, Spektrum Akademischer Verlag, Heidelberg 2007. ISBN 978-3-8274-1800-5 .
- Donald Voet, Judith G. Voet: Biochemistry. Wydanie trzecie, John Wiley & Sons, Nowy Jork 2004. ISBN 0-471-19350-X .
- Bruce Alberts , Alexander Johnson, Peter Walter, Julian Lewis, Martin Raff, Keith Roberts: Molecular Biology of the Cell , 5th Edition, Taylor & Francis 2007, ISBN 978-0-8153-4106-2 .
Indywidualne dowody
- ↑ Poniższe pozycje ENZYME należą do klasy 2.7.-.- ( angielski ) SIB Swiss Institute of Bioinformatics. Źródło 29 października 2019 r.
- ↑ TA Smith: Heksokinazy ssaków i ich nieprawidłowa ekspresja w raku. W: Brytyjskie czasopismo nauk biomedycznych. Tom 57, numer 2, 2000, ISSN 0967-4845 , str. 170-178, PMID 10912295 .
- ↑ CMT4G. W: Online Mendelian Inheritance in Man . (Język angielski)
- ↑ LS Sullivan, DC Koboldt, SJ Bowne, S. Lang, SH Blanton, E. Cadena, CE Avery, RA Lewis, K. Webb-Jones, DH Wheaton, DG Birch, R. Coussa, H. Ren, I. Lopez , C. Chakarova, RK Koenekoop, CA Garcia, RS Fulton, RK Wilson, GM Weinstock, SP Daiger: Dominująca mutacja w heksokinazie 1 (HK1) powoduje barwnikowe zapalenie siatkówki. W: Investigative ofhthalmology & Visual Science. Tom 55, numer 11, wrzesień 2014, s. 7147-7158, doi : 10.1167 / iovs.14-15419 , PMID 25190649 , PMC 4224580 (pełny tekst dowolny).
- ↑ F. Wang, Y. Wang, B. Zhang, L. Zhao, V. Lyubasyuk, K. Wang, M. Xu, Y. Li, F. Wu, C. Wen, PS Bernstein, D. Lin, S. Zhu, H. Wang, K. Zhang, R. Chen: Mutacja typu missense w HK1 prowadzi do autosomalnego dominującego zapalenia barwnikowego siatkówki. W: Investigative ofhthalmology & Visual Science. Tom 55, numer 11, październik 2014, s. 7159-7164, doi : 10.1167 / iovs.14-15520 , PMID 25316723 , PMC 4224578 (pełny tekst dowolny).
- ↑ UniProt P35354 # subcellular_location
- ^ A. Schindler, E. Foley: Heksokinaza 1 blokuje sygnały apoptotyczne w mitochondriach. W: Sygnalizacja komórkowa. Tom 25, numer 12, grudzień 2013, s. 2685-2692, doi : 10.1016 / j.cellsig.2013.08.035 , PMID 24018046 .
- ↑ D. Palmieri, D. Fitzgerald, SM Shreeve, E. Hua, JL Bronder, RJ Weil, S. Davis, AM Stark, MJ Merino, R. Kurek, HM Mehdorn, G. Davis, SM Steinberg, PS Meltzer, K Aldape, PS Steeg: Analizy resekowanych przerzutów raka piersi do mózgu człowieka ujawniają związek między regulacją w górę heksokinazy 2 a złymi rokowaniami. W: Molecular cancer research: MCR. Tom 7, numer 9, wrzesień 2009, s. 1438-1445, doi : 10.1158 / 1541-7786.MCR-09-0234 , PMID 19723875 , PMC 2746883 (pełny tekst dowolny).
- ^ Q. Peng, J. Zhou, Q. Zhou, F. Pan, D. Zhong, H. Liang: Wyciszający gen heksokinazy II uwrażliwia ludzkie komórki raka okrężnicy na 5-fluorouracyl. W: Hepato-gastroenterology. Tom 56, numer 90, 2009 marzec-kwiecień, str. 355-360, PMID 19579598 .
- ↑ Jeremy M. Berg, John L. Tymoczko, Lubert Stryer, Gregory J. Gatto, Jr .: Stryer Biochemistry . Springer-Verlag, 2014, ISBN 978-3-8274-2988-9 , s. 460 ( ograniczony podgląd w Google Book Search).
- ^ Donald Voet, Judith G. Voet: Biochemistry . Wydanie 4. John Wiley & Sons, 2010, ISBN 978-0-470-91745-9 , s. 597 ( ograniczony podgląd w wyszukiwarce Google Book).
- ↑ AE Aleshin, C. Zeng, GP Bourenkov, HD Bartunik, HJ Fromm, RB Honzatko: Mechanizm regulacji heksokinazy: nowe spojrzenie na strukturę krystaliczną rekombinowanej heksokinazy ludzkiego mózgu skompleksowanej z glukozą i glukozo-6-fosforanem. W: Struktura. Tom 6, numer 1, styczeń 1998, str. 39-50, doi : 10.1016 / s0969-2126 (98) 00006-9 , PMID 9493266 .
- ↑ DL Purich, HJ Fromm, FB Rudolph: Heksokinazy: właściwości kinetyczne, fizyczne i regulacyjne. W: Postępy w enzymologii i pokrewnych dziedzinach biologii molekularnej. Tom 39, 1973, s. 249-326, doi : 10.1002 / 9780470122846.ch4 , PMID 4583639 (przegląd).
- ↑ Tsuei-Yun Fang, Olga Alechina, Alexander E. Aleshin, Herbert J. Fromm, Richard B. Honzatko: Identification of a Phosphate Regulatory Site and a Low Affinity Binding Site for Glucose 6-Phosphate in the N-terminal Half of Human Brain Heksokinaza. W: Journal of Biological Chemistry. 273, 1998, str. 19548, doi : 10.1074 / jbc.273.31.19548 .
- ^ GI Bell, A. Cuesta-Munoz, FM Matschinsky: Glukokinaza . W: Encyclopedia of Molecular Medicine . John Wiley & Sons, Hoboken 2002, ISBN 978-0-471-37494-7 .
- ↑ FM Matschinsky: Banting Lecture 1995. Lekcja regulacji metabolizmu zainspirowana paradygmatem sensora glukokinazy. W: Cukrzyca. Tom 45, numer 2, luty 1996, str. 223-241, doi : 10.2337 / diab.45.2.223 , PMID 8549869 (przegląd).