Droga pentozofosforanowa
| Rodzic |
|
Rozpad glukozy Regeneracja NADPH |
| Podrzędny |
| Droga utleniająca Droga redukcyjna |
| Ontologia genów |
|---|
| QuickGO |
Szlak pentozofosforanowy (również cykl monofosforanu heksozy, bocznik monofosforanu heksozy lub szlak 6-fosfoglukonianu) jest szlakiem metabolicznym, który występuje u większości żywych organizmów. Jest to sposób wykorzystania węglowodanów , na przykład glukozy , w których powstaje czynnik redukujący NADPH .
Służy również do konwersji różnych węglowodanów. Procesy te zachodzą w cytozolu komórki, aw roślinach także w chloroplastach .
Ogólny proces i produkty
Szlak pentozofosforanowy można podzielić na odcinek oksydacyjny, nieodwracalny i nieoksydacyjny (redukcyjny), odwracalny. Jednak obie ścieżki nie muszą podążać za sobą. Np. w procesie asymilacji CO 2 w roślinach ( cykl Calvina ) wybierana jest tylko droga redukcyjna.
W szlaku pentozofosforanowym rybulozo-5-fosforan jest tworzony z D- glukozy na drodze oksydacyjnej , z otrzymaniem NADPH. Rybulozo-5-fosforanową (a pentozy fosforan), można przekształcić w metabolitami glikolizy, albo służy jako podstawowy element do biosyntezy z nukleotydów ( DNA , RNA ) i koenzymy ( ATP , koenzym A , NAD , FAD ). NADPH jest stosowany jako środek redukujący anabolizm i służy do utrzymania środowiska redukującego w cytoplazmie . W przeciwieństwie do NADH, NADPH nie służy do generowania energii w łańcuchu oddechowym . Inne możliwości syntezy NADPH obejmują m.in. transfer cytrynian i lekkich reakcji podczas fotosyntezy .
W części nieutleniającej, odwracalnej , różne węglowodany można przekształcić w siebie. Na przykład, pentozy (C 5 cukru) wynikające z gałąź utleniająca może być przekształcony w metabolitami glikolizy . C 3 cukier ( triozy ), C 4 cukrowe ( tetrozy ), C 5 cukru (pentozy), C 6 cukier ( heksozy ) i C 7 cukier ( heptozy ) występują jako produkty pośrednie .
Część utleniająca
Podobnie jak w glikolizie , pierwszym etapem jest reakcja glukokinazy , w której α- D- glukoza ulega fosforylacji do α- D -glukozy-6-fosforanu ( 1 ) ze zużyciem ATP.
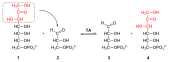
Dehydrogenazy glukozo-6-fosforanu glukozy (G6PDH) formy do wytworzenia NADPH H + 6-Phosphoglucono-A-lakton ( 2 ), ester wewnątrzcząsteczkowej. Jest wysoce specyficzny dla glukozo-6-fosforanu i NADP + , ale nie dla NAD + . Jest to utlenianie na atomie C 1 glukozy. Równowaga tej reakcji jest daleka od produktów. Również dehydrogenaza heksozo -6-fosforanowa (X6PDH) może katalizować tę reakcję. Wykazuje jednak niższą specyficzność względem glukozy i może również utleniać inne heksozy. Jednak w wielu komórkach katalizuje to pierwszy etap szlaku pentozofosforanowego.
Następnie 6-fosfoglukonolaktonaza przekształca 6-fosfoglukono-δ-lakton w 6-fosfoglukonian ( 3 ). Jest on następnie utlenia się i dekarboksyluje się przez 6-fosfoglukonianu dehydrogenazy do rybulozy-5-fosforanu ( 4 ), z NADPH H + i CO 2, która jest utworzona. Oznacza to, że na atomie C3 zachodzi utlenianie.
Całkowity bilans dla utleniającej części ścieżki pentozofosforanowej, począwszy od glukozo-6-fosforanu, wynosi zatem:
Część nieutleniająca

W odwracalnych części szlaku pentozo-fosforanowego, C 4 , C 5 , C, 6 i jedno podwójne wiązanie C 7 cukry są przekształcane w siebie, to nie ma służyć do wytworzenia kolejne równoważniki redukcji. Reakcje te są katalizowane przez dwa enzymy. Transketolazy przenosi dwie i transaldolazę trzy atomy jednostek . Przeniesienie atomów węgla przez transaldolazę i transketolazę nie zużywa ATP, a w przypadku transketolazy jest zależne tylko od kofaktora pirofosforanu tiaminy (TPP, z witaminy B1 ).
Jako przykład, rysunek pokazuje możliwy los rybulozo-5-fosforanu, który powstał podczas szlaku utleniania szlaku pentozofosforanowego.
Rybozo-5-fosforan jest izomeryzowany do rybozo-5-fosforanu przez izomerazę rybozo-5-fosforanu , ale można go również przekształcić w ksylulozo-5-fosforan (X5P) za pomocą fosforano- rybulozo-3-epimerazy . Oba produkty biorą udział w następujących reakcjach. Transketolazy następnie przenosi C 2 urządzenie z ksylulozo-5-fosforan rybozy do 5-fosforanu, dzięki czemu gliceraldehydo-3-fosforan (GAP) są utworzone z pierwszych i sedoheptulozę-7-fosforan (S7P) od niego . Gdy C 3 jednostki przenosi się do szczeliny w S7P , erytrozo-4-fosforan (E4P) i fruktozo-6-fosforanu są utworzone . Ta reakcja jest katalizowana przez transaldolazę. Wreszcie ketolaza przenosi dwie jednostki węgla z innej cząsteczki X5P do E4P, tak że w końcu powstaje kolejna cząsteczka fruktozo-6-fosforanu i GAP.
Bilans
Z trzema cząsteczkami rybulozo-5-fosforanu, ścieżka redukcyjna ścieżki pentozofosforanowej skutkuje następującą równowagą:
Jeśli wziąć pod uwagę ścieżkę utleniania, dwie cząsteczki fruktozo-6-fosforanu i jedna cząsteczka aldehydu 3-glicerynowego powstają z trzech cząsteczek glukozo-6-fosforanu podczas utleniania NADP + i dekarboksylacji:
Droga redukcyjna pentozofosforanowa
W cyklu Calvina powstaje 3-fosforan gliceraldehydu. W tym procesie pięć cząsteczek jest przekształcanych w trzy cząsteczki rybulozo-5-fosforanu przy użyciu enzymów glukoneogenezy ( izomeraza triosefosforanowa , aldolaza , fruktozo-1,6-bisfosfataza ) oraz transketolazy i aldolazy. Na powyższym rysunku odpowiada to ścieżce od prawej do lewej.
W literaturze ta regeneracja jest również określana jako redukcyjny szlak pentozofosforanowy .
Wariacje
Szlak pentozofosforanowy wytwarza środki redukujące w postaci NADPH, podczas gdy glikoliza wytwarza NADH. Jeśli na przykład coraz częściej stosuje się NADPH i pentozy, glukoza przepływa do tego szlaku metabolicznego. Dzieje się tak zwłaszcza w tkankach, w których zachodzi synteza kwasów tłuszczowych lub steroidów . Aby wygenerować NADH i ATP, produkty pośrednie szlaku pentozofosforanowego mogą wrócić do glikolizy. Szlak pentozofosforanowy można zatem postrzegać jako centrum molekularne, odpowiadające na różne potrzeby komórki w zakresie NADPH, rybozy, ATP, NADH i pirogronianu . W ten sposób łączy anaboliczny i kataboliczny metabolizm glukozy. Poniżej omówiono różne przypadki:
Należy wygenerować dużo NADPH
W przypadku, gdy potrzebnych jest jak najwięcej cząsteczek NADPH, można zastosować następujący wariant szlaku pentozofosforanowego (patrz rysunek):
Po pierwsze, sześć cząsteczek glukozo-6-fosforanu jest rozkładanych na sześć cząsteczek rybulozo-5-fosforanu poprzez utleniającą część szlaku PP. Tworzy to 12 cząsteczek NADPH. Rybulozo-5-fosforan może następnie - jak pokazano - zostać przekształcony w pięć cząsteczek fruktozo-6-fosforanu poprzez kilka wzajemnych konwersji w redukcyjnej części ścieżki. Odbywa się to przy udziale enzymów glukoneogenezy. Ponieważ są one w równowadze z glukozo-6-fosforanem, wracają do cyklu. W rezultacie bilans jest:
W ogólnej równowadze jedna cząsteczka glukozo-6-fosforanu jest całkowicie utleniona do sześciu cząsteczek CO 2 , co daje 12 cząsteczek NADPH:
Jednak ten wariant szlaku pentozofosforanowego, w którym wytwarzany jest tylko NADPH, występuje w komórkach ssaków w dość niewielkim stopniu. W literaturze to całkowite utlenienie glukozy jest również określane jako „utleniający szlak pentozofosforanowy” lub, według jego odkrywców, „droga degradacji Warburga-Dickensa-Horeckera”.
Wymagany jest fosforan rybozo-5
Komórki w szpiku kostnym , skórze , błonie śluzowej jelit, a także komórki nowotworowe dzielą się szybko iw konsekwencji wymagają dużej ilości DNA i RNA. Konstrukcja DNA i RNA wymaga wielu ryboz. Alternatywnie do drogi PP, można uwydatnić wytwarzanie rybozo-5-fosforanu (patrz rysunek).
W powyższym przykładzie sześć cząsteczek rybozo-5-fosforanu jest wytwarzanych z pięciu cząsteczek glukozo-6-fosforanu. Tutaj omija się oksydacyjną część szlaku PP, zachodzą tylko konwersje przez ketolazy i aldolazy. Jednak w tym procesie zużywana jest również jedna cząsteczka ATP.
Saldo:
NADH, NADPH i ATP są potrzebne
W przypadku, gdy komórka oprócz NADPH chce wytwarzać energię z rozpadu glukozy, można zastosować połączenie szlaku PP i glikolizy (patrz rysunek).
W oksydacyjnej części szlaku PP trzy cząsteczki glukozo-6-fosforanu są oksydatywnie rozkładane na trzy cząsteczki rybulozo-5-fosforanu, co daje sześć cząsteczek NADPH. Rybulozo-5-fosforan jest następnie przekształcany w pięć cząsteczek GAP w różnych reakcjach. Chociaż zużywane są tutaj dwie cząsteczki ATP, GAP jest metabolizowany do pirogronianu w dalszej sekwencji glikolizy. To tworzy dwie cząsteczki ATP i jedną cząsteczkę NADH na cząsteczkę pirogronianu.
Ogólny bilans pokazuje:
rozporządzenie
Dostępność substratu w nieoksydacyjnej części szlaku pentozofosforanowego jest kontrolowana przez stan równowagi i potrzeby metaboliczne komórki (patrz punkt Zmiany). W części oksydacyjnej szlaku głównym punktem regulacyjnym jest dehydrogenaza glukozo-6-fosforanowa, kluczowy enzym, którego konkurencyjna inhibicja zachodzi w trakcie hamowania produktów końcowych: NADPH i produktów pośrednich syntezy kwasów tłuszczowych ( acylo-CoA ) hamują dehydrogenazę glukozo-6-fosforanową. Natomiast NADP + jest allosterycznym aktywatorem dehydrogenazy.
Występowanie
Te enzymy szlaku pentozo-fosforanu występuje w cytoplazmie prawie wszystkie komórki. Ponieważ NADPH jest niezbędny do syntezy kwasów tłuszczowych i steroidów, droga PP zachodzi szczególnie w komórkach wątroby (synteza kwasów tłuszczowych i cholesterolu) oraz w tkance tłuszczowej (synteza kwasów tłuszczowych). Inne tkanki, w których syntetyzowane są kwasy tłuszczowe i steroidy, również wymagają NADPH, a tym samym szlaku pentozofosforanowego. Są to na przykład kobieca pierś produkująca mleko ( gruczoły mammaria ), jądra , jajniki i kora nadnerczy (synteza sterydów).
Jednak w komórkach mięśniowych w dużej mierze brakuje enzymów dla tego szlaku metabolicznego. Dzieje się tak, ponieważ glukozo-6-fosforan jest tam metabolizowany w cyklu glikolizy i kwasu cytrynowego w celu wytworzenia energii.
Zależność erytrocytów od szlaku pentozofosforanowego
Erytrocyty są wyjątkowe, ponieważ są całkowicie zależne od szlaku pentozofosforanowego. Dla nich jest to jedyny sposób, w jaki można wytworzyć środki redukujące w postaci NADPH.
Tkanki są narażone na uszkodzenia oksydacyjne spowodowane reaktywnymi formami tlenu (ROS). Erytrocyty są szczególnie narażone na transport tlenu. ROS, na przykład nadtlenek wodoru (H 2 O 2 ), uszkadzają białka, DNA i lipidy ściany komórkowej. Albo H 2 O 2 jest rozdzielany na wodę i tlen przez katalazę, albo uszkodzenia oksydacyjne są minimalizowane przez fakt, że glutation czyni ROS nieszkodliwymi. Peroksydaza glutationowa można zmniejszyć nadtlenki (patrz rysunek), przez utlenienie dwie cząsteczki glutationu. NADPH działa jako ochronny środek redukujący, regenerując glutation. Jest to katalizowane przez reduktazę glutationową (GSR).
U osób z defektem dehydrogenazy glukozo-6-fosforanowej (G6PDH) erytrocyty narażone są na zwiększony stres oksydacyjny, ponieważ w przeciwieństwie do innych tkanek nie wykazują ekspresji dehydrogenazy heksulozy-6-fosforanowej, przez co defekt ma drastyczny wpływ na szlak pentozofosforanowy . Powstaje zbyt mało NADPH, przez co dochodzi do większych uszkodzeń oksydacyjnych, na przykład w błonie. Niedobór G6PDH prowadzi zatem do anemii hemolitycznej .
Z drugiej strony osoby z defektem G6PDH mają zwiększoną ochronę przed malarią . Patogen Plasmodium falciparum namnaża się w erytrocytach, ale jest bardzo wrażliwy na stres oksydacyjny. Prowadzi to do przewagi selekcyjnej: niedobór G6PDH jest powszechny na obszarach, gdzie malaria jest powszechna.
Erytrocyty nie mają jądra ani mitochondriów . Oznacza to, że nie mogą ani działać w cyklu kwasu cytrynowego, ani nie potrzebują rybozy-5-fosforanu do produkcji DNA i RNA. Więc możesz wytwarzać wystarczającą ilość przeciwutleniaczy za pomocą samej gałęzi oksydacyjnej. Z jednej strony pozbawia to dostarczającą energię glikolizy glukozy, z drugiej strony wkrótce pojawi się problem osmotyczny z pentoz. Jednak gałąź nieoksydacyjna przekształca dwie cząsteczki ksylulozo-5-fosforanu i jedną cząsteczkę rybozo-5-fosforanu w gliceroaldehydo-3-fosforan i dwie cząsteczki fruktozo-6-fosforanu. Produkty te mogą wykorzystywać erytrocyty w glikolizie do wytwarzania energii (patrz sekcja powyżej ).
literatura
- Reginald Garrett, Charles M. Grisham: Biochemia (International Student Edition). 3. Wydanie. Thomsom Learning, 2005, ISBN 0-534-41020-0 , s. 725-735
- Thomas M. Devlin (red.): Podręcznik biochemii z korelacjami klinicznymi . Wydanie szóste. Wiley & Sons, 2005, ISBN 978-0-471-67808-3 , s. 638-643
- H. Robert Horton, Laurence A. Moran, K. Gray Scrimgeour, Marc D. Perry, J. David Rawn i Carsten Biele (tłumacze): Biochemie . Wydanie czwarte zaktualizowane. Studium Pearsona, 2008, ISBN 978-3-8273-7312-0 , s. 490-496
- Werner Müller-Esterl: Biochemia, wprowadzenie dla lekarzy i przyrodników . Spektrum Akademischer Verlag, 2004, ISBN 3-8274-0534-3 , s. 522-527.
- Albert Lehninger, Michael Cox, David L. Nelson: Lehninger Principles of Biochemistry . Wydanie piąte. WH Freeman & Co, 2008, ISBN 978-0-7167-7108-1 , s. 558-563
linki internetowe
Indywidualne dowody
- ↑ Tutaj w sensie „bocznego wejścia” produktów w glikolizie.
- ↑ David Nelson, Michael Cox: Lehninger Biochemie . 4., całkowicie zmieniony i exp. Wydanie. Springer, Berlin 2009, ISBN 978-3-540-68637-8 , s. 1076.
- ↑ a b c d H. Robert Horton, Laurence A. Moran, K. Gray Scrimgeour, Marc D. Perry, J. David Rawn i Carsten Biele (tłumacze): Biochemie . Wydanie czwarte zaktualizowane. Studium Pearsona, 2008, ISBN 978-3-8273-7312-0 , s. 490-496.
- ↑ a b c d Albert Lehninger, Michael Cox, David L. Nelson: Lehninger Principles of Biochemistry . Wydanie piąte. WH Freeman & Co, 2008, ISBN 978-0-7167-7108-1 , s. 558-563.
- ↑ a b c Werner Müller-Esterl: Biochemia, wprowadzenie dla lekarzy i przyrodników . Spektrum Akademischer Verlag, 2004, ISBN 3-8274-0534-3 , s. 522-527.
- ^ Karlsons Biochemie i Pathobiochemie . ISBN 978-3-13-357815-8 , s. 258.
- ^ Reginald Garrett, Charles M. Grisham: Biochemia (International Student Edition). 3. Wydanie. Thomsom Learning, 2005, ISBN 0-534-41020-0 , s. 725-735.
- ↑ Thomas M. Devlin (red.): Podręcznik biochemii z korelacjami klinicznymi . Wydanie szóste. Wiley & Sons, 2005, ISBN 978-0-471-67808-3 , s. 638-643.
- ↑ Jeremy M. Berg, Lubert Stryer, John L. Tymoczko: Biochemia . Wydanie szóste. Spektrum Akademischer Verlag, 2007, ISBN 978-3-8274-1800-5 , s. 650.




















