dyfuzja
Dyfuzja (łac. diffusio , z łac. diffundere , 'wylewać', 'rozpraszać', 'rozprowadzać') to wyrównywanie różnic stężeń w cieczach lub gazach jako naturalny proces fizyczny spowodowany ruchem molekularnym Browna , który zachodzi bez żadnego wpływu zewnętrznego . Z czasem prowadzi to do całkowitego wymieszania dwóch lub więcej substancji dzięki równomiernemu rozmieszczeniu ruchomych cząstek, a tym samym zwiększa entropię układu. Cząstkami mogą być atomy , cząsteczki , nośniki ładunku lub wolne neutrony . Zwykle co najmniej jedna z substancji jest gazem lub cieczą , ale ciała stałe i plazmy mogą również dyfundować w siebie nawzajem.
Zasada działania
Dyfuzja opiera się na losowym losowym ruchu cząstek ze względu na ich energię cieplną („ruch termiczny”, patrz poniżej). W przypadku nierównomiernego rozkładu statystycznie więcej cząstek przemieszcza się z obszarów o wysokim stężeniu do obszarów o niskim stężeniu lub gęstości cząstek niż odwrotnie. Powoduje to makroskopowy transport substancji netto . Przez dyfuzję rozumie się zwykle ten transport sieciowy. Termin ten jest również używany dla podstawowego procesu mikroskopowego.
W układzie zamkniętym dyfuzja powoduje zmniejszenie różnic stężeń aż do całkowitego wymieszania. Czas potrzebny na to zwiększa się w -wymiarowej przestrzeni z -tą potęgą odległości. Dyfuzja jest zatem skuteczna głównie w skali od nano do milimetra; W większych skalach w cieczach i gazach dominuje zazwyczaj transport masy przez przepływ ( konwekcja ). Na dyfuzję w ciałach stałych często nakładają się również inne procesy chemiczno-fizyczne, takie jak absorpcja , adsorpcja , resorpcja i transport kapilarny .
Dyfuzja nie zależy od przepuszczalności powietrza przez materiał. W osmozie małe cząsteczki dyfundują przez zamkniętą membranę, która jest nieprzepuszczalna dla większych cząsteczek. Decydującym czynnikiem jest dyfuzyjność materiału w stosunku do substancji rozpraszającej.
Dyfuzja może opierać się na różnych zjawiskach:
- Dyfuzja zbiorowa to dyfuzja kilku cząstek wzdłuż gradientu stężenia, w tym na przykład prawa Ficka.
- Z drugiej strony w przypadku samodyfuzji brane są pod uwagę poszczególne cząstki, między innymi ich zachowanie. opisuje relacja Einsteina . Współczynnik samodyfuzji (indeks dolny S oznacza samodyfuzję) jest funkcją czasu.
- Przez ekstremalnie krótkie czasy, krótsze niż czas relaksacji Browna , mówi się o reżimie balistycznym.
- Krótkookresowa stała dyfuzji panuje dla czasów w pobliżu czasu relaksacji Browna .
- W przeciwieństwie do tego, w Wielkich czasach Limes dominuje długoterminowa stała dyfuzji .
fabuła
Jednym z pierwszych, którzy systematycznie przeprowadzali na dużą skalę eksperymenty dyfuzyjne, był Thomas Graham . Z jego eksperymentów dotyczących dyfuzji gazów wyprowadził prawo Grahama , nazwane jego imieniem :
„Oczywiste jest, że dyfuzyjność gazów jest odwrotnie proporcjonalna do pewnej funkcji ich gęstości – najwyraźniej pierwiastka kwadratowego z ich gęstości”.
„Oczywiste jest, że szybkość dyfuzji gazów jest odwrotnością funkcji ich gęstości – najwyraźniej pierwiastka kwadratowego z ich gęstości”.
„Dyfuzja lub spontaniczne mieszanie się dwóch stykających się gazów następuje przez wymianę w położeniu nieskończenie małych objętości gazów, które to objętości niekoniecznie są równej wielkości, będąc w przypadku każdego gazu odwrotnie proporcjonalne do kwadratu pierwiastek gęstości tego gazu.”
„Na dyfuzję lub spontaniczne mieszanie dwóch stykających się gazów wpływa zmiana położenia nieskończenie małych objętości gazów, które niekoniecznie muszą być tego samego rzędu wielkości, a w przypadku każdego gazu odwrotnie proporcjonalne do pierwiastka kwadratowego z gęstości gazu są."
W odniesieniu do dyfuzji w roztworach Graham był w stanie wykazać, że szybkość dyfuzji jest proporcjonalna do różnicy stężeń i zależna od temperatury (szybsza dyfuzja w wyższych temperaturach). Graham pokazał również możliwość rozdzielania mieszanin roztworów lub gazów za pomocą dyfuzji.
Thomas Graham nie był jeszcze w stanie określić podstawowych praw dyfuzji. Adolf Fick dokonał tego dopiero kilka lat później . Postulował, że prawo, którego szukał, musi być analogiczne do praw przewodzenia ciepła określonych przez Jeana Baptiste Josepha Fouriera :
„Rozprzestrzenianie się ciała rozpuszczonego w rozpuszczalniku, tak długo, jak odbywa się bez zakłóceń pod wyłącznym wpływem sił molekularnych, przebiega zgodnie z tym samym prawem, które ustanowił Fourier dla rozprzestrzeniania się ciepła w przewodniku, a które Ohm ma już tak znakomicie odniósł sukces na Rozszerzeniu elektryki (gdzie wiadomo, że nie jest ściśle poprawny).”
Fick przeprowadził eksperymenty, których wyniki potwierdziły słuszność pierwszego prawa Ficka, które później nazwano jego imieniem. Mógł jedynie wywnioskować ważność drugiego prawa Ficka z ważności pierwszego. Dowód bezpośredni nie powiódł się ze względu na ograniczone możliwości analityczne i matematyczne.
Na początku XX wieku Albertowi Einsteinowi udało się wyprowadzić prawa Ficka z praw termodynamiki, dając w ten sposób dyfuzji bezpieczne podstawy teoretyczne. Wyprowadził również zależność Stokesa-Einsteina do obliczania współczynnika dyfuzji:
„Współczynnik dyfuzji zawieszonej substancji zależy od stałych uniwersalnych i temperatury bezwzględnej tylko od współczynnika tarcia cieczy i wielkości zawieszonych cząstek”.
Einstein pokazał również, jak uchwycić ruch pojedynczej dyfundującej cząstki, a tym samym zrozumieć ruch molekularny Browna jako zjawisko fluktuacji. Obliczył średnie kwadratowe przemieszczenie cząstki w czasie τ dla przypadku jednowymiarowego . Niedługo po Einsteinie Smoluchowski również doszedł do praktycznie tej samej zależności inną drogą, stąd równanie to jest obecnie nazywane równaniem Einsteina-Smoluchowskiego .
ilustracja
Eksperyment często cytowany w celu zilustrowania rozprzestrzeniania się dyfuzji polega na stopniowym zabarwieniu letniej wody kroplą atramentu, która jest wprowadzana, ale woda nie jest ani mieszana, ani wstrząsana. Po chwili kolor tuszu zostanie równomiernie rozprowadzony w wodzie. Rozprzestrzenianiu się atramentu w wodzie mogą jednak również sprzyjać różnice w gęstości i temperaturze. Wpływy te można zredukować poprzez nałożenie barwnej cieczy o większej gęstości na ciecz o mniejszej gęstości oraz stosowanie bardzo lepkich cieczy, np. B. kolorowy syrop i miód. Obserwowane wówczas stopniowe zabarwienie miodu można wytłumaczyć prawie wyłącznie dyfuzją, przy czym zarówno syrop przenika do miodu, jak i miód do syropu.
Przydatne przykłady
- Podczas spiekania bardzo ważną rolę w koalescencji składników proszku odgrywa dyfuzja.
- Stal można utwardzić przez dyfuzję węgla i/lub azotu lub doprowadzić do pylenia metalu .
- W piecach dyfuzyjnych domieszki wprowadzane są do materiału półprzewodnikowego w temperaturze około 1000 °C , aby w szczególny sposób wpływać na przewodność elektryczną lub właściwości mechaniczne elementów w technologii mikrosystemowej .
- Dyfuzja odgrywa kluczową rolę w chemii technicznej . Często występuje tutaj w połączeniu z konwekcją i reakcjami chemicznymi . Typowe zastosowania to projektowanie reaktorów i katalizatorów . W inżynierii procesów chemicznych selektywne rozdzielanie mieszanin substancji często prowadzi się przy użyciu technologii sit molekularnych i/lub membran . Oba procesy opierają się na „separacji kinetycznej”, przy czym różnice w dyfuzji poszczególnych substancji w nanoporach odgrywają zasadniczą rolę, a tym samym otwierają możliwości kontroli.
- W półprzewodnikach elektrony poruszają się wbrew prądowi pola generowanemu przez źródło napięcia z powodu prądu dyfuzyjnego .
- Przy dwubiegunowej dyfuzji elektrony i jony poruszają się w plazmie w tym samym kierunku .
- W konstrukcji budynku , dyfuzja pary wodnej musi być brane pod uwagę na ochronę przed wilgocią w celu uniknięcia niedopuszczalnie dużych ilości wody kondensacyjnej. W tym celu stosuje się paroizolacje i paroizolacje o określonym oporze dyfuzji pary wodnej .
- W mikrobiologii dyfuzję stosuje się w teście dyfuzji agarowej .
- W oddychaniu przez płuca wymiana gazowa między pęcherzykami a krwią odbywa się poprzez dyfuzję.
- Za pomocą tak zwanej spektroskopii uporządkowanej dyfuzyjnie (DOSY), ruchliwość translacyjna poszczególnych cząsteczek może być mierzona w mieszaninach, a masa cząsteczkowa może być określona przy użyciu współczynnika dyfuzji .
Podstawy fizyczne
Dyfuzja w pewnej stałej temperaturze odbywa się bez dodatkowego wkładu energii i jest w tym sensie pasywna; Zwłaszcza w biologii rozróżnia się dyfuzję i transport aktywny .
W teorii dyfuzja to nieskończenie długi proces. Jednak pod względem mierzalności często można go uznać za ukończony w skończonym czasie.
Ruch termiczny

Ruch termiczny, na którym opiera się dyfuzja, może mieć bardzo różny charakter w zależności od rozważanego systemu. W gazach jest prosty. przerywane przez sporadyczne uderzenia. Gwałtowny ruch termiczny cząstek cieczy w wyniku częstych uderzeń powoduje znacznie wolniejszy ruch Browna obiektów mezoskopowych, które można zaobserwować pod mikroskopem . W bryłach zachodzą okazjonalne zmiany położenia, m.in. B. poprzez zamianę miejsca dwóch sąsiadujących ze sobą cząstek, czyli „wędrówkę” pustych przestrzeni. W przypadku nośników ładunku (np. jony , elektrony , dziury ) na ruch termiczny nakłada się jednak dryf wywołany siłami elektrostatycznymi.
Prawdopodobieństwo i entropia
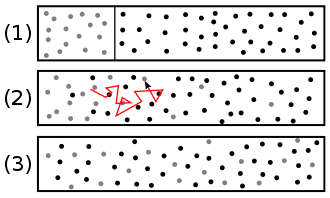
Kierunek ruchu pojedynczej cząstki jest całkowicie przypadkowy. Ze względu na oddziaływanie z innymi cząsteczkami zachodzą ciągłe zmiany kierunku. Jednak uśredniając w dłuższym okresie czasu lub w dużej liczbie cząstek, może skutkować transportem w określonym kierunku m.in. B. jeśli skok w określonym kierunku ma być może tylko nieznacznie większe prawdopodobieństwo . Ma to miejsce w przypadku różnicy stężeń (również gradientu stężeń ). Następnie powstaje przepływ netto cząstek, aż do ustalenia stanu ustalonego, równowagi termodynamicznej . Zwykle stanem równowagi jest równomierny rozkład, w którym stężenie wszystkich cząstek jest jednakowo wysokie w każdym punkcie przestrzeni.
Prawdopodobieństwo i dyfuzja - próba wyjaśnienia : Załóżmy, że 1000 cząstek substancji znajduje się tylko w prawej połowie naczynia, a 10 cząstek w lewej połowie; ponadto każda cząsteczka porusza się na pewną odległość w całkowicie losowym kierunku z powodu ruchu cząsteczek Browna. Następnie następuje: Prawdopodobieństwo, że jedna z 1000 cząstek losowo przesunie się z prawej strony na lewą, jest 100 razy większe niż prawdopodobieństwo, że jedna z zaledwie 10 cząstek przesunie się z lewej na prawą stronę. Zatem po pewnym czasie istnieje duże prawdopodobieństwo, że cząstki netto przemieszczą się z prawej strony na lewą. Jak tylko prawdopodobieństwo wędrówki będzie takie samo po obu stronach, tj. po 505 cząstek po prawej i lewej stronie, nie będzie już przepływu masy netto i stężenie będzie wszędzie takie samo (w ramach fluktuacji statystycznych) . Oczywiście cząstki nadal migrują od lewej do prawej i odwrotnie; Ale ponieważ jest teraz taka sama liczba części, nie można określić różnicy w stężeniu. Jeśli teraz pomyślisz o „prawej” i „lewej” jako o szczególnie małych podprzestrzeniach, np. B. przedstawia test tuszu i wszystkie te podprzestrzenie w pewnym momencie mają to samo stężenie tuszu, tusz jest równomiernie rozłożony.
Układy, w których cząstki są losowo rozmieszczone w całej objętości, mają wyższą entropię niż układy bardziej uporządkowane, w których cząstki wolą przebywać w określonych obszarach. Dyfuzja prowadzi zatem do wzrostu entropii. Zgodnie z drugą zasadą termodynamiki jest to proces dobrowolny, którego nie można odwrócić bez wpływu z zewnątrz.
Większa entropia w rozkładzie w całej objętości wynika również z większej liczby wzorców rozmieszczenia (lub mikrostanów), które mogą tworzyć cząstki, jeśli mają więcej dostępnej przestrzeni. Liczba mikrostanów tworzących ten sam makrostan nazywana jest jego wagą statystyczną . Oznacza to, że rozkład na dużą skalę ma również wyższą wagę statystyczną w porównaniu z układem przestrzennie skoncentrowanym, a zatem jest również bardziej prawdopodobny. Entropia ( ) makrostanu jest więc miarą jego prawdopodobieństwa.
Analogia do przewodzenia ciepła i przewodzenia prądu elektrycznego
Dyfuzja podlega prawom równoważnym z przewodzeniem ciepła . Dlatego równania opisujące jeden proces można przyjąć dla drugiego.
Dyfuzja rozpuszczonych cząstek
Przy ustalonym ciśnieniu i ustalonej temperaturze gradient potencjału chemicznego jest z punktu widzenia termodynamiki przyczyną napędzającą przepływ materiału. Przepływ jest zatem:
- : Gęstość strumienia cząstek ( flux ) w mol · m −2 · s −1
- : Potencjał chemiczny w J · mol −1
- : Długość w m
- : współczynnik w mol 2 s kg -1 m -3
W prostych zastosowaniach zamiast potencjału chemicznego można użyć stężenia substancji . Jest to łatwiej dostępne niż potencjał chemiczny substancji. Dla gazu doskonałego potencjał chemiczny jest podany przez
- ,
Jest to potencjał chemiczny rozsądnie dobranego stanu odniesienia , który nie jest przez obecność stanów standardowych działa na wyraźne potrzeby stanu standardowego lub normalnego. W przypadku substancji, która nie jest idealna, należy wziąć pod uwagę dodatkowe terminy nadmiarowe, ponieważ istnieją interakcje między cząstkami (patrz potencjał chemiczny ). Jeśli temperatura nie zależy wyraźnie od lokalizacji, obowiązują następujące zasady:
Wstawienie tego do powyższego równania daje pierwsze prawo Ficka:
Współczynnik dyfuzji został wprowadzony tutaj. Związek między współczynnikami i jest
w wyniku czego
- : Współczynnik dyfuzji w m 2 s −1
- : Stężenie molowe w mol · m −3
- : Temperatura w K
- : Uniwersalna stała gazowa w J K -1 mol -1
W przypadku bardzo niskich stężeń (pojedynczych cząsteczek) rozważanie to nie jest już łatwo dopuszczalne, ponieważ klasyczna termodynamika traktuje roztwory jako kontinuum . W przypadku wysokich stężeń cząstki oddziałują na siebie tak, że wyrównywanie stężeń następuje wolniej, gdy oddziaływanie jest atrakcyjne, a szybsze, gdy jest odpychające. W takich przypadkach potencjał chemiczny nie jest już logarytmicznie zależny od stężenia.
Pierwsze prawo Ficka
Zgodnie z pierwszym prawem Ficka gęstość prądu cząstek jest proporcjonalna do gradientu stężenia przeciwnego do kierunku dyfuzji. Stałą proporcjonalności jest współczynnik dyfuzji .
Jednostkami są na przykład = mol m- 2 s- 1 , = mol · m- 4 i = m 2 s- 1 .
Gęstość strumienia cząstek stanowi ilościowe stwierdzenie o (w średniej statystycznej) ukierunkowanym ruchu cząstek, tj. H. ile cząstek danej ilości substancji porusza się w czasie przez obszar prostopadły do kierunku dyfuzji, netto. Podane równanie odnosi się również do ogólnego przypadku, że współczynnik dyfuzji nie jest stały, ale zależy od stężenia (ściśle mówiąc, nie jest to już jednak stwierdzenie Pierwszego Prawa Ficka).
Równanie Nernsta-Plancka można postrzegać jako rozszerzenie prawa Ficka .
Drugie prawo Ficka (równanie dyfuzji)
Równanie ciągłości i równanie różniczkowe dla przypadku jednowymiarowego
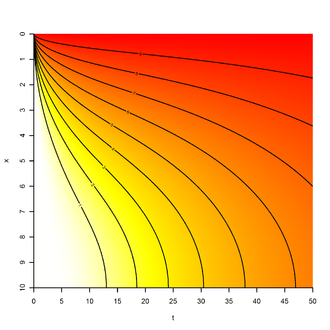
Za pomocą równania ciągłości (zachowanie masy)
równanie dyfuzji wynika z pierwszego prawa Ficka
dla stałych współczynników dyfuzji wynika z tego
- .
Reprezentuje ona zależność między różnicami stężeń czasowych i lokalnych, a zatem jest odpowiednia do przedstawiania dyfuzji nieustalonej , w przeciwieństwie do pierwszego prawa Ficka, które opisuje przepływ dyfuzji, który jest stały w czasie. Istnieje wiele analitycznych i numerycznych podejść do rozwiązania tego równania różniczkowego , które jednak silnie zależą od warunków początkowych i brzegowych .
Z matematycznego punktu widzenia równanie dyfuzji jest tożsame z równaniem przewodzenia ciepła , jego właściwości matematyczne i możliwe rozwiązania zostały omówione w tym artykule.
Równanie różniczkowe dla przypadku trójwymiarowego
Przypadek trójwymiarowej dyfuzji można opisać drugim prawem Ficka w jego najbardziej ogólnej postaci:
z operatorem Nabla . Z matematycznego punktu widzenia to równanie dyfuzji jest również identyczne z (trójwymiarowym) równaniem przewodzenia ciepła ; jego matematyczne właściwości i podejścia do rozwiązania zostały omówione w artykule. Rozwiązanie tego równania jest zwykle czasochłonne i, w zależności od rozważanego obszaru, możliwe tylko numerycznie .
W przypadku stacjonarnym m.in. H. dla
wyniki eliptycznego równania różniczkowego cząstkowego
Jeżeli dodatkowo współczynnik dyfuzji jest izotropowy , otrzymuje się równanie różniczkowe typu Laplace'a .
Jeśli oprócz dyfuzji zaangażowany jest również transport ukierunkowany, dynamikę stężenia opisuje równanie konwekcji-dyfuzji .
Rodzaje dyfuzji
Powszechnie rozróżnia się cztery rodzaje dyfuzji. Współczynniki dyfuzji różnią się dla różnych typów dyfuzji, nawet jeśli te same cząstki dyfundują w standardowych warunkach .
Własna dyfuzja
Jeśli w gazie, czystej cieczy lub roztworze nie ma makroskopowego gradientu, zachodzi tylko rzeczywista samodyfuzja. Samodyfuzja (często nazywana również dyfuzją wewnętrzną) to transport cząsteczek w obrębie tej samej substancji, na przykład cząsteczek wody w czystej wodzie lub jonów sodu w roztworze NaCl. Ponieważ trudno jest odróżnić cząstki identyczne fizycznie i chemicznie, można to zaobserwować tylko z dużym wysiłkiem, dlatego samodyfuzję często przybliża się izotopowymi znacznikami tej samej substancji, na przykład 22 Na + dla jonów sodu. Zakłada się, że gradient powstały przez dodanie znacznika jest pomijalnie mały. Samodyfuzja to model opisujący ruch molekularny Browna. Zmierzone współczynniki dyfuzji można przekształcić w średnie kwadratowe przemieszczenie cząstki w okresie czasu.
Gradient pola NMR jest szczególnie odpowiednią metodą pomiaru współczynników samodyfuzji .Nie są tu wymagane znaczniki izotopowe, ponieważ fizycznie i chemicznie identyczne cząstki można odróżnić na podstawie fazy precesji spinu jądrowego jądra atomowego znajdującego się w cząstce. Dzięki tej technice NMR współczynniki samodyfuzji można bardzo precyzyjnie określić w czystych cieczach, jak również w złożonych, płynnych mieszaninach. Współczynnik samodyfuzji czystej wody został zmierzony niezwykle dokładnie i dlatego jest często używany jako wartość referencyjna. Wynosi 2,299 · 10 -9 m² · s -1 przy 25 ° C i 1,261 · 10 -9 m² · s -1 przy 4 ° C.
Dyfuzja znacznika
Dyfuzja znacznika to dyfuzja niskich stężeń jednej substancji w roztworze drugiej substancji. Dyfuzja znacznika różni się od samodyfuzji tym, że jako znacznik stosuje się znakowaną cząstkę innej substancji, np. B. 42 K + w roztworze NaCl. Często stosuje się znacznik radioaktywny lub fluorescencyjny, ponieważ może to bardzo dobrze wykryć. Przy nieskończonym rozcieńczeniu współczynniki dyfuzji własnej i dyfuzji znacznika są identyczne.
Klasyczna dyfuzja Ficka
Oznacza to dyfuzję wzdłuż stosunkowo silnego gradientu. Przy tego rodzaju dyfuzji najlepsze jest przybliżenie współczynnika dyfuzji.
Przeciwdyfuzja
Przeciwdyfuzja występuje, gdy istnieją przeciwne gradienty, powodując dyfuzję cząstek w przeciwnych kierunkach.
Dyfuzja gazów
W zasadzie dyfuzja cząstek w gazach nie różni się pod względem regularności od dyfuzji cząstek rozpuszczonych w cieczach. Jednak prędkość dyfuzji (przy porównywalnych gradientach) jest tutaj o rząd wielkości większa, ponieważ ruch poszczególnych cząstek w gazach jest znacznie szybszy. Dyfuzję gazów rozcieńczonych w układach wieloskładnikowych można opisać modelem dyfuzji Maxwella-Stefana .
Dyfuzja w ciałach stałych
W doskonałej sieci krystalicznej każda cząsteczka sieci obraca się wokół swojej ustalonej pozycji sieci i nie może jej opuścić. Niezbędnym warunkiem dyfuzji w krystalicznym ciele stałym jest zatem obecność defektów sieci . Tylko dzięki temu warunkowi atomy lub jony mogą zmienić swoje miejsce, a tym samym może nastąpić transfer masy. Można sobie wyobrazić różne mechanizmy:
- Cząsteczki „wskakują” w puste przestrzenie w sieci, tak że puste przestrzenie przemieszczają się przez sieć i następuje przepływ cząstek netto. Mechanizm ten został zademonstrowany przez efekt Kirkendalla .
- Mniejsze cząstki przemieszczają się przez przestrzenie między sieciami. W porównaniu z dyfuzją przez wakat prowadzi to do bardzo wysokich współczynników dyfuzji. Ten mechanizm został również sprawdzony eksperymentalnie.
- Miejsca wymiany dwóch cząstek lub wymiana pierścieni między kilkoma cząstkami. Ten hipotetyczny mechanizm nie został jeszcze potwierdzony eksperymentalnie.
- Jeśli nośniki ładunków swobodnych w półprzewodnikach doświadczają wystarczającego rozpraszania (np. od fononów , elektronów i zanieczyszczeń ), propagują się również dyfuzyjnie.
Dyfuzję w kryształach można również opisać prawami Ficka. Jednak współczynniki dyfuzji mogą zależeć od kierunku przestrzennego ( anizotropia ). Współczynniki dyfuzji, które są skalarne w przypadku izotropowym , stają się tensorem drugiego rzędu , zwanym tensorem dyfuzji . Droga dyfuzji jest zatem ważnym parametrem opisu procesów dyfuzji w ciałach stałych.
W przypadku anizotropii, na przykład, pierwsze prawo Ficka jest napisane w następujący sposób:
w tym teraz
jest macierzą 3 × 3 zwaną tensorem dyfuzji (lub macierzą dyfuzji ). Ta macierz jest symetryczna i dlatego ma tylko sześć niezależnych składników.
Dyfuzja w niekrystalicznych ( bezpostaciowych ) ciałach stałych jest mechanicznie podobna do tej w kryształach, chociaż nie ma rozróżnienia między regularnymi i nieregularnymi pozycjami sieci. Matematycznie można opisać takie procesy oraz dyfuzję w cieczach.
Równanie Fokkera-Plancka
Dodatkowa zmienna napędzająca ze względu na istniejący potencjał oznacza, że rozkład równomierny nie odpowiada już stanowi stanu ustalonego. Teorię tego dostarcza równanie Fokkera-Plancka .
Przypadek szczególny: anomalna dyfuzja
W opisanych powyżej procesach dyfuzji, które można opisać równaniem dyfuzji Ficka, średnie kwadratowe przemieszczenie dyfundujących cząstek (tj. średnia odległość między cząstkami a ich punktem początkowym w czasie ) wzrasta proporcjonalnie do czasu:
Prawo to wynika z teorii ruchu molekularnego Browna. W komórkach można jednak zaobserwować inne zasady, na przykład w ruchu makrocząsteczek przez cytoplazmę komórki. To medium, gęsto zaludnione organellami i (makro) cząsteczkami, prowadzi do spowolnionego ruchu dyfuzyjnego, zgodnie z prawem potęgowym. Obowiązuje wówczas, co następuje:
Poniższe informacje dotyczą tego spowolnionego ruchu, który nazywa się subdyfuzją . Istnieją również procesy dyfuzji, w których zachodzi , to znaczy są przyspieszane. Nazywa się to superdyfuzją .
Przypadek szczególny: ułatwiona dyfuzja (biologia)
W biologii ułatwiona dyfuzja lub przepuszczalność opisuje możliwość penetracji niektórych substancji przez biomembranę łatwiej niż byłoby to faktycznie możliwe ze względu na ich rozmiar, ładunek, polaryzację itp. Niektóre białka, tak zwane białka tunelowe, tworzą tunel przez błonę komórkową, który ze względu na swoją średnicę i/lub rozkład ładunku pozwala niektórym substancjom łatwiej przejść niż przez „zamkniętą” błonę (np. kanały jonowe ).
Niewłaściwe użycie słowa dyfuzja
Terminy dyfuzja i dyfuzyjność są często używane w dziedzinie akustyki zamiast niemieckiego słowa diffusität . Przyczynia się do tego błędne tłumaczenie z angielskiego.
Zobacz też
- Równanie reakcji-dyfuzji
- Dyfuzja wirowa , oznacza mieszanie przez przepływ
- Dyfuzja Knudsena , dyfuzja zdominowana przez granice
- Krytyczna grubość warstwy
- Proces Lévy'ego
- Sieć dyfuzyjna
- Dyfuzyjność
- Dyfuzja neutronów
- Przeznaskórkowa utrata wody
literatura
- Peter W. Atkins , Charles A. Trapp: Chemia fizyczna. Wydanie trzecie poprawione. Wiley-VCH, Weinheim i in. 2001, ISBN 3-527-30236-0 .
- Klopfer, H.: Transport wody przez dyfuzję w ciałach stałych. Wiesbaden: Bauverlag 1974 ( streszczenie ).
- EL Cussler: Dyfuzja. Przenoszenie masy w układach płynów. Wydanie II. Cambridge University Press, Cambridge i in. 1997, ISBN 0-521-56477-8 .
- J. Crank: Matematyka dyfuzji. Wydanie drugie poprawione. Oxford University Press, Oxford et al. 1980, ISBN 0-19-853411-6 .
- Paul Heitjans , Jörg Kärger (red.): Dyfuzja w materii skondensowanej. Metody, materiały, modele. Wydanie znacznie powiększone i całkowicie zmienione. Springer, Berlin i in. 2005, ISBN 3-540-20043-6 .
- Jörg Kärger (red.): Lipsk, Einstein, Dyfuzja. Leipziger Universitätsverlag, Lipsk, 2007, (3 wydanie 2014), ISBN 978-3-86583-176-7 .
- Wilhelm Jost : Dyfuzja w ciałach stałych, cieczach, gazach (= Chemia fizyczna 1, ISSN 0079-1881 ). 6. druk. Wydawnictwo akademickie, Nowy Jork, NY 1970.
- HJV Tyrrell, KR Harris: Dyfuzja w cieczach. Studium teoretyczne i eksperymentalne. Butterworth, Londyn 1984, ISBN 0-408-17591-5 .
linki internetowe
- Prawa dyfuzji Ficka , H. Föll, Wydział Techniczny Christian-Albrechts-Universität zu Kiel
- Dyfuzja w fizycznych właściwościach materiału (PDF, 160 kb) w Instytucie Leibniza stałym oraz badania nad materiałami
- Siatka 3D Symulacja Monte Carlo dyfuzji na wyciętej wezynie powierzchni samochodu (100) autorstwa Larsa Röntgenzscha
- Model symulacyjny NetLogo do nauczania (aplet Java) autorstwa Johannesa Kottonau
- Wideo: prawa dyfuzji i Ficka – jak szybko transport masowy przebiega bez przepływu? . Jakob Günter Lauth (SciFox) 2013, udostępniony przez Bibliotekę Informacji Technicznych (TIB), doi : 10.5446 / 15654 .
Indywidualne dowody
- ↑ Def.: Słownik chemiczny Romppa . Franckhsche Verlagsbuchhandlung 1969 i Arnold Arni: Zrozumiała chemia . Wileg-VCH 1998. ISBN 3-527-29542-9 , s. 224.
- ↑ patrz m.in. Np.: KH Beckurts, K. Wirtz: Fizyka neutronów. Springer 1964, ISBN 978-3-642-87616-5
- ↑ a b Thomas Graham: Krótkie sprawozdanie z badań eksperymentalnych nad wzajemną dyfuzją gazów i ich separacją za pomocą środków mechanicznych. W: Kwartalnik Nauki, Literatury i Sztuki 27, 1829, s. 74-83.
- ↑ Thomas Graham: O prawie dyfuzji gazów w : Philosophical Magazine. 2, 1833, s. 175-190.
- ^ B Thomas Graham: The Bakerian wykład - na dyfuzji cieczy w zakresie: Philosophical Transactions Royal Society of London- 140, 1850, str. 1-46.
- ↑ Adolf Fick: O dyfuzji W: Annalen der Physik Poggendorffa. 94, 1855, s. 59-86 ( doi: 10.1002 / i s.18551700105 ).
- ↑ a b Albert Einstein: O ruchu cząstek zawieszonych w cieczy w spoczynku, wymaganym przez molekularną kinetyczną teorię ciepła . W: Roczniki Fizyki . 322, nr 8, 11 maja 1905, s. 549-560. Źródło 22 czerwca 2016.
- ↑ R. Neufeld, D. Stalke: Dokładne oznaczanie masy cząsteczkowej małych cząsteczek metodą DOSY NMR przy użyciu zewnętrznych krzywych kalibracji ze znormalizowanymi współczynnikami dyfuzji . W: Chem.Sci. Nie. 6 , 2015, s. 3354-3364 , doi : 10.1039 / C5SC00670H .
- ↑ Gerd Wedler: Podręcznik chemii fizycznej. Verlag Chemie, Weinheim, 1982, ISBN 3-527-25880-9 , s. 95.
- ↑ WA Kreiner: Entropia – co to jest? Przegląd. doi: 10.18725 / OPARU-2609
- ^ HS Carslaw, JC Jaeger: Przewodzenie ciepła w ciałach stałych . 2. wyd. Oxford University Press, Londyn, 1959. ISBN 0-19-853368-3 , s. 28.
- ↑ Georg Job, Regina Rüffler: Chemia fizyczna: Wprowadzenie do nowej koncepcji z licznymi eksperymentami (= podręczniki do nauki chemii ). Wydanie II. Springer Fachmedien Wiesbaden, Wiesbaden 2021, ISBN 978-3-658-32935-8 , s. 120 , doi : 10.1007 / 978-3-658-32936-5 ( springer.com [dostęp 3 czerwca 2021]).
- ↑ Yuan-Hui Li i Sandra Gregory: Dyfuzja jonów w wodzie morskiej i osadach głębinowych . Geochimica et Cosmochimica Acta, 38, 1974, s. 703-714.
- ^ H. Weingärtner, M. Holz: Badania NMR samodyfuzji w cieczach. W: Annu. Rep. Prog. Chem., rozdz. C. 98, 2002, s. 121-155.
- ↑ M. Holz, SR Heil, A. Sacco: Zależne od temperatury współczynniki samodyfuzji wody i sześciu wybranych cieczy molekularnych do kalibracji w dokładnych pomiarach 1H NMR PFG. W: Fiz. Chem. Chem. Fiz. 2, 2000, s. 4740-4742.
- ^ E. Bruce Watson, Ethan F. Baxter: Dyfuzja w układach naziemnych . W: Listy o Ziemi i Planetarnej Nauki. 253, 2007, s. 307-327.
- ^ M. Weiss, M. Elsner, F. Kartberg, T. Nilsson: Anomalne subdyfuzja jest miarą zagęszczenia cytoplazmatycznego w żywych komórkach . W: Czasopismo Biofizyczne . 87, nr 5, 2004, s. 3518-3524. doi : 10.1529 / biophysj.104.044263 . PMC 1304817 (darmowy pełny tekst).





























![{\ styl wyświetlania [J]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/50de4527394eeac6ace20edb789515c595c2c73a)
![{\ styl wyświetlania [\ częściowy c / \ częściowy x]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e0b90485811ae81287050bb8eb1634023b05290f)
![{\ styl wyświetlania [D]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1c4bcb25d77a0de74082c849178200b8cf1340b4)



















