Trietyloglin
| Formuła strukturalna | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 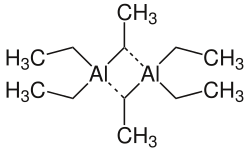
| ||||||||||||||||
| Monomer (na górze), dimer (na dole) | ||||||||||||||||
| Generał | ||||||||||||||||
| Nazwisko | Trietyloglin | |||||||||||||||
| inne nazwy |
|
|||||||||||||||
| Formuła molekularna | C 6 H 15 Al (monomer) | |||||||||||||||
| Krótki opis |
bezbarwna ciecz samozapalna |
|||||||||||||||
| Zewnętrzne identyfikatory / bazy danych | ||||||||||||||||
| ||||||||||||||||
| nieruchomości | ||||||||||||||||
| Masa cząsteczkowa | 114,17 g mol -1 | |||||||||||||||
| Stan fizyczny |
ciekły |
|||||||||||||||
| gęstość |
0,8324 g cm- 3 (25 ° C) |
|||||||||||||||
| Temperatura topnienia |
-52,5 ° C |
|||||||||||||||
| temperatura wrzenia |
187 ° C |
|||||||||||||||
| Ciśnienie pary |
4 h Pa (przy 20 ° C) |
|||||||||||||||
| rozpuszczalność |
gwałtowny rozkład w wodzie |
|||||||||||||||
| instrukcje bezpieczeństwa | ||||||||||||||||
| ||||||||||||||||
| O ile to możliwe i zwyczajowe, stosuje się jednostki SI . O ile nie zaznaczono inaczej, podane dane dotyczą warunków standardowych . | ||||||||||||||||
Trietyloglin , znany również jako TEA lub trietyl glinu (ATE), jest metaloorganicznym związkiem glinu . Związek jest piroforyczny i może samozapalić się w kontakcie z powietrzem. TEA reaguje niezwykle gwałtownie z wodą, tworząc wodorotlenek glinu i etan . TEA to kwas Lewisa, z powodu różnic w elektronów na atomie glinu, który ma tylko sześć elektronów walencyjnych .
Prezentacja i ekstrakcja
Synteza techniczna zachodzi poprzez konwersję glinu , wodoru i etenu , przy czym niezbędna jest wyjściowa ilość trietyloglinu. Sam aluminium nie reaguje bezpośrednio z wodorem. W obecności trietyloglinu tworzy się wodorek dietyloglinu jako związek pośredni, który wraz z etenem daje związek docelowy.
- i
Następnie zostanie odczytane równanie sumaryczne
Syntezę można przeprowadzić jako ciągły proces dwuetapowy, w którym część trietyloglinu podlega cyrkulacji.
Drugi wariant syntezy oparty jest na reakcji glinu z chlorkiem etylu , gdzie najpierw otrzymuje się półtorachlorek etyloglinu .
W wyniku reakcji redukcji sodem otrzymuje się docelowy związek.
- i
nieruchomości
Właściwości fizyczne
Trietyloglin jest piroforyczną cieczą bezbarwną do żółtawej. Związek wrze w 187 ° C pod normalnym ciśnieniem. Ciepło parowania o to 73,2 kJ mol -1 . Według Antoine'a funkcja prężności pary jest zgodna z log 10 (P) = A− (B / (T + C)) (P w barach, T w K) przy A = 7,41394, B = 3451,295 i C = 2, 14 w zakresie temperatur od 330 K do 399 K. Temperatura topnienia związku wynosi -50,7 ° C. Ciepło topnienia wynosi 10,6. kJ · mol −1 Punkt potrójny ma temperaturę -48 ° C. i 0,0017 Pa
Właściwości chemiczne
W stanie stałym i ciekłym trietyloglin występuje w postaci dimeru , natomiast w fazie gazowej występuje w postaci monomerycznej . Z halogenkami metali alkalicznych i cyjankami kompleksami 1: 1 typu M [(C 2 H 5 ) 3 AlX] i kompleksami 1: 2 typu M [(C 2 H 5 ) 6 Al 2 X] (z M - metalem alkalicznym jon i X - halogenek, cyjanek). Gdy stałe, bezwodne halogenki glinu są wprowadzane do trietyloglinu, tworzą się odpowiednie halogenki dietyloglinu lub dihalogenki etyloglinu, w zależności od stechiometrii.
- i
- gdzie X = Cl, Br, I
Prawdziwa transalkilacja kończy się sukcesem w reakcji z chlorkiem cynku , dzięki czemu pożądany dietylocynk można oddzielić od produktu ubocznego chlorku dietyloglinu przez destylację .
Z tlenem w rodnikowej reakcji łańcuchowej na wiązaniach glin-węgiel powstaje trietanolan glinu . Ta reakcja jest bardzo egzotermiczna z entalpią reakcji −1017 kJ mol −1 , dlatego konieczna jest odpowiednia kontrola reakcji w odniesieniu do dostarczania tlenu w celu uniknięcia niekontrolowanych procesów samozapłonu.
Trietyloglin reaguje łatwo i gwałtownie z substancjami protonowymi, takimi jak kwasy mineralne, woda, alkohole, merkaptany, fenole, kwasy karboksylowe, amoniak, aminy, acetylen i monopodstawione acetyleny.
posługiwać się
Jako składnik katalizatorów Zieglera-Natty, trietyloglin jest kokatalizatorem stosowanym na skalę przemysłową do produkcji poliolefin ; głównie z polietylenu i polipropylenu . W tak zwanym procesie Alfola TEA służy do syntezy wyższych nierozgałęzionych alkoholi pierwszorzędowych („ alkohole tłuszczowe ”) z etenu .
W systemach MOCVD i MBE trietyloglin jest używany jako medium reakcyjne do osadzania warstw półprzewodników III-V , na przykład diod LED .
W broni wojskowej, takiej jak miotacze ognia , stosuje się trietyloglin jako płynny środek przeciwpożarowy lub zagęszczacze, takie jak poliizobutylen, jako materiał o żółtej krawędzi (TPA, pol. Zagęszczony środek piroforyczny ). W zasadzie taką broń można uznać za następcę napalmu . Jeśli chodzi o temperaturę spalania i efekt zapalający, przewyższają to. Samej TEA nie można ugasić wodą, ponieważ reaguje z wodą wybuchowo. Jeśli walczy się z innymi środkami gaśniczymi, samozapłon może w każdej chwili wybuchnąć ponownie w wyniku kontaktu z powietrzem.
instrukcje bezpieczeństwa
Opary trietyloglinu działają silnie drażniąco i spalają błony śluzowe . Obrzęk płuc może wystąpić z opóźnieniem do dwóch dni . Często obserwuje się także tzw. Gorączkę odlewniczą . Wpływ na skórę może powodować bardzo bolesne i trudne do gojenia rany.
Indywidualne dowody
- ↑ b c d e f wejście na trietyloglinu w GESTIS bazie materiału z IFA , dostępne w dniu 1 lutego 2016 r. (Wymagany JavaScript)
- ↑ a b c d e M. J. Krause, F. Orlandi, AT Saurage, JR Zietz Jr .: Organic Aluminium Compounds. W: Encyklopedia chemii przemysłowej Ullmanna. Wiley-VCH, Weinheim 2005. doi : 10.1002 / 14356007.a01_543
- ↑ a b W. B. Heck, RL Johnson: Alkiloglin - bezpieczna obsługa. W: Ind. Eng. Chem. 54, 12, 1962, str. 35-38. doi: 10.1021 / ie50636a007
- ↑ nie są wyraźnie wymienione w rozporządzeniu (WE) nr 1272/2008 (CLP) , ale z określonym znakowania spada w grupie wjazdowych alkiloglinów w wykazie klasyfikacji i oznakowania w Europejskiej Agencji Chemikaliów (ECHA), dostępnych w dniu 1 lutego , 2016. marketer może skorzystać ze zharmonizowanej klasyfikacji i rozszerzyć oznakowanie .
- ↑ K. Ziegler: Konsekwencje i rozwój wynalazku - Wykład Nobla z 12 grudnia 1963 r. W: Angew. Chem. 76, 1964, str. 545-553. doi: 10.1002 / anie.19640761302
- ↑ K. Ziegler, H.-G. Gellert, H. Lehmkuhl, W. Pfohl, K. Zosel: związki metaloorganiczne, trialkiloglin XXVI i wodorki dialkiloglinu z olefin, wodoru i glinu. W: Liebigs Ann. Chem. 629, 1960, str. 1-13. doi: 10.1002 / jlac.19606290102
- ↑ A. Lobo, DC Coldiron: Patent ZA 635722, 1963 Continental Oil Co. W: Chem. Abstr. 63, 1965, s. 13314h.
- ↑ a b A. von Grosse, JM Mavity: Związki glinoorganiczne: Metody przygotowania. W: J. Org. Chem. 5, 1940, str. 106-121. doi: 10.1021 / jo01208a004
- ^ PA Fowell, Ph. D. Thesis, University of Manchester, 1961.
- ^ V. Fic, J. Dvorak: związki organiczno-glinowe. 1. Prężność par trietyloglinu i chlorku dietyloglinu. W: Chem. Prum. 15, 1965, strony 732-735.
- ^ A b I. B. Rabinovich, VP Nistratov, MS Sheiman, KN Klimov, GP Kamelov, AD Zorin: Ciepło właściwe i funkcje termodynamiczne trietyloglinu. W: Zhur. Fiz. Khim. 63, 1989, str. 522-525.
- ↑ MS Sheiman, VP Nistratov, GP Kamelova, IB Rabinovich: Niskotemperaturowa pojemność cieplna organicznych związków glinu i cynku. W: Probl. Kalorim. Khim. Termodin., Docl. Vses. Conf. 10, 2, 1984, str. 457-459.
- ↑ obliczone z funkcji prężności par
- ↑ Gábor Vass, György Tarczay, Gábor Magyarfalvi, András Bödi, László Szepes: HeI Photoelectron Spectroscopy of Trialkylaluminum and Dialkylaluminum Hydride Compounds and their Oligomers. W: Organometallics. 21, 2002, str. 2751-2757. doi: 10.1021 / om010994h
- ↑ K. Ziegler, R. Köster, H. Lehmkuhl, K. Reinert: związki metaloorganiczne, XXX Nowe złożone związki alkiloglinów. W: Liebigs Ann. Chem. 629, 1960, str. 33-49. doi: 10.1002 / jlac.19606290106
- ↑ MB Smith: Ciepło powstające podczas tworzenia alkiloglinów i związków pokrewnych. W: J. Organomet. Chem. 76, 1974, str. 171-201. doi: 10.1016 / S0022-328X (00) 84630-6
- ↑ K. Ziegler, F. Krupp, K. Zosel: Związki metaloorganiczne, XL Synteza alkoholi ze związków glinoorganicznych. W: Liebigs Ann. Chem. 629, 1960, str. 241-250. doi: 10.1002 / jlac.19606290118
- ^ W. Baumann, B. Herberg-Liedtke: Chemikalia w obróbce metali: dane i fakty dotyczące ochrony środowiska. Springer, 1996, ISBN 3-540-60094-9 , str. 462-463.












