Siarkowodór
| Formuła strukturalna | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Generał | |||||||||||||||||||
| Nazwisko | Siarkowodór | ||||||||||||||||||
| inne nazwy |
|
||||||||||||||||||
| Formuła molekularna | H 2 S | ||||||||||||||||||
| Krótki opis |
bezbarwny, niezwykle toksyczny gaz o zapachu zgniłych jaj |
||||||||||||||||||
| Identyfikatory zewnętrzne / bazy danych | |||||||||||||||||||
| |||||||||||||||||||
| nieruchomości | |||||||||||||||||||
| Masa cząsteczkowa | 34,08 g mol- 1 − | ||||||||||||||||||
| Stan fizyczny |
gazowy |
||||||||||||||||||
| gęstość |
|
||||||||||||||||||
| Temperatura topnienia |
-85,7 ° C |
||||||||||||||||||
| temperatura wrzenia |
-60,2 ° C |
||||||||||||||||||
| Ciśnienie pary |
1,82 MPa (20 ° C) |
||||||||||||||||||
| Wartość p K S |
|
||||||||||||||||||
| rozpuszczalność |
|
||||||||||||||||||
| Moment dipolowy | |||||||||||||||||||
| Współczynnik załamania światła |
1,307 (16,85 ° C) |
||||||||||||||||||
| instrukcje bezpieczeństwa | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
DFG / Szwajcaria: 5 ml m -3 lub 7,1 mg m -3 |
||||||||||||||||||
| W miarę możliwości i zwyczajowo stosowane są jednostki SI . O ile nie zaznaczono inaczej, podane dane dotyczą warunków standardowych . Współczynnik załamania: linia Na-D , 20 ° C | |||||||||||||||||||
Siarkowodór (również siarkowodór , diwodorofosforan siarczek nie należy mylić z anionem siarkowodoru HS - ) jest związkiem chemicznym o siarkę i wodór z wzorem H 2 S. Siarkowodór jest bezbarwny cuchnące, wysoce toksyczny gaz . Jest żrący , łatwopalny, wysoce łatwopalny i nieco cięższy od powietrza. Jest słabo rozpuszczalny w wodzie i nieco lepiej rozpuszczalny w etanolu . H 2 S jest bardzo słabym kwasem , którego sole to siarczki i siarkowodór.
Nawet w bardzo niskich stężeniach siarkowodór można rozpoznać po typowym zapachu zgniłego jajka . Powstaje między innymi. w rozkładzie zawierające siarkę aminokwasy w tych białek z białka jaj i żółtka .
Występowanie
W naturze siarkowodór występuje jako bardzo zmienny składnik (od śladowych ilości do 80% objętości) w gazie ziemnym , jako gaz wulkaniczny i rozpuszczony w wodzie źródlanej . Powstaje również z rozkładu biomasy poprzez gnicie lub gnicie (np. zwłoki zwierząt, zwłoki, rozkład ściółki liściowej , tworzenie się osadów na dnie eutroficznych jezior itp.) lub podczas procesów trawiennych w jelicie , które opuszcza wraz z wzdęciami . Siarkowodór, który powstaje podczas takiej degradacji biomasy na składowiskach odpadów , dołach gnojowych , wysokociśnieniowych rurach kanalizacyjnych czy innych obiektach technicznych powoduje miliardowe uszkodzenia konstrukcji betonowych (korozja biogeniczna wywołana kwasem siarkowym). Jedną z przyczyn nieprzyjemnego halitozy u ludzi jest - obok innych lotnych związków organicznych zawierających siarkę ( metanotiol , siarczek dimetylu ) - siarkowodór.
Ekstrakcja i prezentacja
Siarkowodór można wytworzyć w skali laboratoryjnej przez wkroplenie kwasu solnego na siarczek żelaza (II) w aparacie Kippa :
- Siarczek żelaza (II) i kwas solny tworzą chlorek żelaza (II) i siarkowodór.
Powstały produkt jest zwykle zanieczyszczony gazami, takimi jak wodór i powietrze . W przypadku stosowania naturalnego siarczku żelaza (np. pirotynu ) produkt może być również zanieczyszczony śladami arsenu , monofosfiny , selenowodoru , tellurku wodoru i tym podobnych. Czysty siarkowodór można otrzymać przez ogrzewanie stężonego roztworu siarkowodoru magnezu lub z pierwiastków, ale także z siarczku sodu i kwasu fosforowego .
W przemyśle petrochemicznym ( rafinerii ), siarkowodór jest wytwarzany w dużych ilościach, podczas hydroodsiarczania z ropy naftowej .
nieruchomości
Właściwości fizyczne
- temperatura krytyczna : 100,15°C
- ciśnienie krytyczne : 89,7 bar
Termodynamika:
S 0 g, 1 bar : 205,77 J / (mol K)
Do 2.582 litrów gazowego siarkowodoru rozpuszcza się w 1 litrze wody w temperaturze pokojowej .
Siarkowodór jest nieco cięższy od powietrza , w normalnych warunkach różnica gęstości wynosi około 19%.
Siarkowodór skrapla się w temperaturze pokojowej pod ciśnieniem 18,2 bara. Mówi się, że przy 90 GPa siarkowodór przechodzi w fazę metaliczną, która staje się nadprzewodnikiem typu II w temperaturze 203 K (-70 ° C) ; zakłada się powstawanie jonów H 3 S + i HS - .
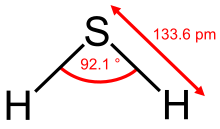
Cząsteczka H 2 S jest ustawiona pod kątem. Kąt wiązanie jest 92,1 °, a rdzeń rozstaw wynosi 133,6 pm. Ze względu na małą różnicę elektroujemności partnerów wiążących, a tym samym niską polarność wiązania , wiązania wodorowe nie odgrywają istotnej roli w siarkowodorze, co wyraża się w stosunkowo niskiej temperaturze topnienia i wrzenia .
Właściwości chemiczne
Z A Pk s wartości 7,0 Siarkowodór jest bardzo słaby kwas . W wodny roztwór reaguje z wielu soli metali ciężkich, tworząc nierozpuszczalne siarczki , które jest stosowane w rozdzielenia kationów procesu. Odpowiednio gaz jest wykrywany papierem z octanu ołowiu , ponieważ reaguje z jonami ołowiu (II) tworząc czarny siarczek ołowiu (II) . Reaguje również z jonami żelaza (II), tworząc siarczek czarnego żelaza (II) .
Powyższa reakcja odzyskiwania jest również odwracalna. W warunkach naturalnych (pH 5-10) siarkowodór można wiązać w roztworze wodnym z chlorkiem żelaza (II) z wytworzeniem siarczku żelaza (II) .
Jest to powszechna praktyka w przypadku biogazu , gazu fermentacyjnego iw kanałach ściekowych . Wielkie powinowactwo z żelaza do siarki stosuje się do oczyszczania biogazu i fermentacyjnej gazu. W przeciwnym wypadku, gdy biogaz jest spalany w silnikach gazowych, dwutlenek siarki produkowany będzie powodować znaczne korozji problemy.
W przypadku obfitego dopływu powietrza siarkowodór spala się niebieskim płomieniem, tworząc dwutlenek siarki i wodę , wytwarzając między innymi kwas siarkowy . Po dostarczeniu powietrza siarka stopniowo wydziela się z roztworu wodnego ( samoutlenianie ).
Z dwutlenkiem siarki , w obecności pary wodnej , siarkowodór jest dodawany do siarki i wody ( reakcja redoks ), przy niewielkich ilościach chloru powstaje gazowa siarka i chlorowodór . Siarkowodór jest również silnym środkiem redukującym .
Siarkowodór jest średnio rozpuszczalny w wodzie . Wodny roztwór nazywany jest siarkowodór wody. Siarkowodór dysocjuje w bardzo małym stopniu w roztworze wodnym ( dysocjacja (chemia) ):
Dysocjacja w drugim etapie praktycznie nie zachodzi ze względu na niezwykle małe stałe dysocjacji. Możliwości wpływania na proces dysocjacji pierwszej fazie przez dobór wartości pH w roztworze , to znaczy jest w stanie ustawić stężenie jonów siarkowodór dowolnie jest podstawą do oddzielania analitycznych kationów po H 2 S oddzielania proces. Należy założyć, że strącanie siarczków metali jest procesem wieloetapowym, w którym wodne kompleksy kationów metali najpierw przechodzą wymianę ligandów z jonami siarkowodoru, po czym nierozpuszczalne siarczki są ostatecznie tworzone przez wiele wielopierścieniowych kompleksów metali. Podczas gdy niskie stężenie jonów siarkowodoru występujące w roztworze kwaśnym wystarcza do wytrącenia szczególnie słabo rozpuszczalnych siarczków pierwiastków grupy H 2 S, to produkty rozpuszczalności nieco lepiej rozpuszczalnych siarczków pierwiastków grupy NH 4 HS są osiągane tylko w roztworze amoniaku . W powietrzu siarkowodór spala się tworząc siarkę lub dwutlenek siarki ( proces Clausa ), w zależności od panujących warunków . Z fluorem reaguje wybuchowo z fluorowodorem i sześciofluorkiem siarki :
Parametry związane z bezpieczeństwem
Siarkowodór tworzy wysoce łatwopalne mieszaniny gaz-powietrze. Zakres wybuchowości wynosi od 4,3% objętości (60 g/m 3 ) jako dolna granica wybuchowości (LEL) do 45,5% objętości (650 g/m 3 ) jako górna granica wybuchowości (LEU). Maksymalne ciśnienie wybuchu wynosi 5,9 bara. Określono graniczną szerokość szczeliny na 0,83 mm. Powoduje to przypisanie do grupy wybuchowości IIB. Temperatura zapłonu wynosi 270 ° C. Substancja należy zatem do klasy temperaturowej T3.
posługiwać się
Duża chemia
Siarkowodór jest głównym źródłem siarki elementarnej , która z kolei w ponad 80 procentach jest przekształcana w kwas siarkowy. Aby to zrobić, część siarkowodoru jest najpierw spalana do dwutlenku siarki :
Część pozostałego siarkowodoru reaguje z powstałym dwutlenkiem siarki, dzieląc go na siarkę elementarną:
Analiza chemiczna
W klasycznym procesie oddzielania kationów H 2 S do wytrącania całą grupę ( grupy siarkowodór ). Wprowadzając gaz H 2 S do słabo kwaśnych roztworów wytrącają się: As 2 S 3 , SnS 2 , Sb 2 S 3 , HgS , SnS , PbS , Bi 2 S 3 , CuS oraz po rozcieńczeniu wodą również CdS . Kationy te muszą być następnie dalej oddzielane i identyfikowane za pomocą reakcji wykrywania .
Ze względu na swoją toksyczność siarkowodór jest coraz częściej pomijany w procesie rozdzielania kationów. Zamiast tego potrzebne aniony siarkowodoru powstają in situ , na przykład przez hydrolizę tioacetamidu , a w mniejszych ilościach przez ogrzewanie siarki woskiem świecowym.
H 2 S-Gang : Ta procedura opiera się na klasycznym marszu separacyjnym. Kationy podobne chemicznie są wytrącane grupami przy użyciu określonych odczynników. Osad następnie oddziela się i analizuje, stosuje się supernatant (roztwór) i wytrąca się następną grupę.
toksykologia
toksyczność
Siarkowodór jest niezwykle trującym gazem, który bardzo szybko może doprowadzić do śmierci, o czym świadczą liczne doniesienia o wypadkach w przemyśle chemicznym. Ze względu na nieco większą gęstość niż powietrze, gaz gromadzi się na ziemi.
Charakterystyczny zapach zgniłych jaj (siarkowodór jest również wytwarzany w zgniłych jajach) jest odczuwany indywidualnie w stężeniu 0,0005 do 0,13 ppm i jest przewagą nad innymi śmiercionośnymi gazami. Jednak przyzwyczaja się do zapachu i przy wyższych stężeniach zapach nie jest odczuwalny, ponieważ siarkowodór ma właściwość znieczulania receptorów węchowych . U szczurów i myszy stwierdzono zależne od stężenia neurotoksyczne uszkodzenie nabłonka węchowego (błony śluzowej nosa) przy stężeniach 30 ppm lub większych. Maksymalne stężenie w miejscu pracy (MAK wartości od 2006) wynosi 5 ppm.
Wartość progowa dla uśpienie ludzkie receptory węchowe jest w stężeniu 200 ppm H 2 S.
Krótkotrwały efekt trujący
W kontakcie z błonami śluzowymi i płynem tkankowym w oczach, nosie, gardle i płucach siarkowodór tworzy siarczki alkaliczne, które są niezwykle drażniące. Jedną z konsekwencji tego jest zatrzymanie wody w płucach. Objawy zwykle ustępują w ciągu kilku tygodni.
Rzeczywisty efekt toksyczny polega na zniszczeniu hemoglobiny, czerwonego barwnika krwi, a tym samym paraliżu oddychania wewnątrzkomórkowego. Mechanizm ten jest do dziś niejasny, przyjmuje się, że enzymy przenoszące tlen zawierające metale ciężkie są inaktywowane. Mniejsza, nieutleniona część siarkowodoru może spowodować uszkodzenie ośrodkowego i prawdopodobnie także obwodowego układu nerwowego .
Na ludziach występują następujące skutki :
- od 20 ppm: uszkodzenie rogówki po dłuższej ekspozycji
- ≈ 100 ppm: podrażnienie błon śluzowych tych oczu i dróg oddechowych , ślinienie , podrażnienia gardła
- > 200 ppm: ból głowy , trudności w oddychaniu
- > 250 ppm: ogłuszanie receptorów węchowych
- > 300 ppm: nudności
- ≈ 500 ppm: osłabienie, senność, zawroty głowy
- > 500 ppm: drgawki , utrata przytomności
Długotrwałe narażenie na małe dawki może prowadzić do zmęczenia , utraty apetytu , bólu głowy , drażliwości , słabej pamięci i słabej koncentracji .
U ludzi pojawiają się zależne od stężenia objawy zatrucia :
- <100 ppm: po kilku godzinach
- > 100 ppm: <1 godzina
- ≈ 500 ppm: zagrożenie życia w 30 minut
- ≈ 1000 ppm: zagrożenie życia w kilka minut
- ≈ 5000 ppm (odpowiada ułamkowi objętości 0,5%): śmiertelne w ciągu kilku sekund
Oznacza to, że nawet stężenia H 2 S wynoszące 0,1% są śmiertelne już po kilku minutach. W takich stężeniach utrata przytomności pojawia się w ciągu jednego lub więcej oddechów.
Stężenie H 2 S, która w ludzkich komórkach przez hamowanie oddychania komórkowego jest szkodliwy, to in vitro, 0,32 ľ mol / l określona.
Efekt długoterminowy
Badania na zwierzętach pokazują, że świnie karmione pokarmem zawierającym siarkowodór cierpią na biegunkę po kilku dniach i wykazują utratę wagi po około 105 dniach.
fizjologia
metabolizm

Siarkowodór powstaje w organizmie przez krótki czas, gdy nadmiar cysteiny jest rozkładany za pomocą γ-liazy cystationinowej ( EC 4.4.1.1 ), która normalnie rozkłada cystationinę na cysteinę, ale może również rozkładać cysteinę dalej:
U szczurów wykazano inną reakcję tego samego enzymu, który pochodzi z cystyny , ale nie odgrywa roli u ludzi:
Gaz szybko łączy się z resztami tiolowymi białek w sąsiedztwie (-Cys staje się -CySSH) i tym samym zmienia ich aktywność biologiczną. W szczególności dezaktywuje to enzym oksydazę cytochromu c . Większość jednak jest utleniana do siarczanu w mitochondriach przez tiosiarczan i siarczyn lub przetwarzana na siarczyn/siarczan lub taurynę przez siarczyn cysteiny .
Utlenianie do siarczanu
Mitochondria chronią się przed H 2 S lub HS - poprzez jego utlenianie do siarczanu, które odbywa się w trzech etapach:
Po pierwsze, H 2 S utlenia się do tiosiarczanu przez kompleks enzymu. Szczegółowo zachodzą trzy indywidualne reakcje , które są katalizowane przez enzymy siarczkowe: oksydoreduktazę chinonową ( EC 1.8.5.- ), ditlenek siarki ( EC 1.13.11.18 ) i rodanazę .
Część utleniania tiosiarczanu do siarczynu odbywa się za pomocą glutationu i enzymu reduktazy tiosiarczanowej ( EC 2.8.1.3 ), w innej części wykorzystuje się tiosiarczanową transferazę siarki .
Wreszcie oksydaza siarczynowa utlenia siarczyn do siarczanu. Potwierdzeniem drodze degradacji wynikiem identyfikacji mitochondrialnego Schwefeldioxygenase z ETHE1 - gen , który w rzadkich mutacji w choroby genetyczne z uszkodzeniem spowodowanym przez zwiększenie H 2 S stężeń potencjalnych klientów.
funkcjonować
W ludzkim ciele siarkowodór działa jak tlenek azotu jako substancja przekaźnikowa (patrz także gazoprzekaźnik ) i ma działanie rozszerzające naczynia krwionośne (wazodylatator) . Jest ona wytwarzana z aminokwasu L - cysteiny w komórkach śródbłonka w naczyniach krwionośnych , jak również w komórkach mięśni gładkich . Jeśli śródbłonek naczyniowy jest stymulowany przez muskarynowe receptory acetylocholiny , uwalniany jest H 2 S. Prowadzi to do aktywacji kanałów potasowych aktywowanych napięciem i wapniem w komórkach mięśni gładkich mięśni naczyniowych . Prowadzi to do hiperpolaryzacji komórek mięśni gładkich i ostatecznie do rozszerzenia naczyń krwionośnych (rozszerzenie naczyń) .
podanie
Siarkowodór może być potencjalnie stosowany jako lek na zaburzenia erekcji. Powstaje naturalnie w tkance erekcyjnej prącia i mięśniach gładkich tętnicy prącia . Eksperymenty wykazały, że zarówno L- cysteina, jak i siarkowodór (sól) dostarczane z zewnątrz powodują zależną od stężenia erekcję w tkance erekcyjnej prącia ( Corpora cavernosa penis ).
W niskich stężeniach siarkowodór spowalnia procesy metaboliczne i obniża temperaturę ciała u myszy. Ten stan podobny do hibernacji jest w pełni odwracalny i nieszkodliwy dla zwierząt. Trwają badania, czy efekt ten można wykorzystać w medycynie transplantacyjnej do poprawy jakości i czasu przeżycia narządów przeznaczonych do przeszczepu. Ponadto badania na ludziach sprawdzają, czy siarkowodór może zwiększyć prawdopodobieństwo przeżycia pacjentów w nagłych wypadkach. Celem jest spowolnienie metabolizmu przez wdychanie lub wstrzykiwanie H 2 S, a tym samym zmniejszenie zapotrzebowania na tlen. Najlepiej byłoby, gdyby ten środek był już przedkliniczny, np. B. przez pogotowie ratunkowe .
W badaniu z 2007 roku przeprowadzonym na Uniwersytecie Alabama w Birmingham , które zostało opublikowane w czasopiśmie Proceedings of the National Academy of Sciences , uważa się, że bardzo niskie dawki siarkowodoru są głównym czynnikiem wpływającym na zdrowie czosnku . Autorzy donoszą, że czosnek obniża ryzyko chorób serca z powodu wysokiego ciśnienia krwi, zwiększonego poziomu tłuszczu we krwi ( cholesterolu ) i innych czynników. W grupach populacji, które spożywają dużo czosnku, problemy z wysokim ciśnieniem krwi są zatem mniejsze.
Analityka
Zarówno toksyczność, jak i jej znaczenie biologiczne stawiają wysokie wymagania analizie siarkowodoru. W przeciwieństwie do wyżej wspomnianego wykorzystania H 2 S w procesie separacji nieorganicznej , przedstawiono instrumentalne, ilościowe metody detekcji H 2 S.
Analityka instrumentalna
Oznaczanie optyczne
Najczęściej stosuje się reakcję chromogenną fotometrycznego wykrywania H 2 S i siarczków jest reakcji z N”, N-dimetylo-p-fenylenodiaminę do formy błękitu metylenowego . Sole żelaza (III) są stosowane jako katalizatory. Produkt reakcji ma maksimum absorpcji przy 670 nanometrów i można go określić fotometrycznie.
Elektroanaliza
Amperometria
Czujniki amperometryczne H 2 S są szeroko stosowane . W amperometrii do elektrody pracującej przykładany jest potencjał i mierzony jest wynikowy prąd; jest proporcjonalna do stężenia H 2 S. Siarkowodór utlenia się do siarczanu. Elektrody zmodyfikowane za pomocą nanorurek węglowych osiągnęły granicę wykrywalności 0,3 µmol/l przy potencjale utleniania 100 mV. Konstrukcja stosowanych elektrod jest ściśle związana z elektrodą Clarka do oznaczania tlenu.
Potencjometria
Sondy potencjometryczne zostały również opracowane dla technologii czujników gazowego H 2 S. Jako przykład można wymienić galwaniczne półogniwa na bazie stałego elektrolitu, które razem z H 2 S dostarczają mierzoną siłę elektromotoryczną. Dzięki rurkom cyrkonowym stabilizowanym tlenkiem itru jako czujnikom można było mierzyć stężenie H 2 S w powietrzu do 0,2 ppm z niezawodną powtarzalnością. Korzystanie heksacyjanożelazian jako partnera redoks, a nawet 30 części na miliard H 2 S może być wykryty.
Chromatografia gazowa
Chromatografia gazowa jest często pierwszym wyborem do analizy substancji gazowych . Po rozdzieleniu, związki siarki, takie jak H 2 S można wykrywać za pomocą fotometrii płomieniowej przy emisji o długości fali 397 nanometrów. Jedna metoda szybkiego wykrywania śladów siarkowodoru w gazie węglowym osiągnęła granicę wykrywalności 10 ppb.
Zobacz też
literatura
- Dieter Weismann, Manfred Lohse (hrsg.): Praktyczny podręcznik siarczkowy dotyczący technologii oczyszczania ścieków. Vulkan, Essen 2007, ISBN 978-3-8027-2845-7 .
- Tatjana Hildebrandt, Manfred K. Grieshaber: Wiele stron siarczku. Zabójczy, a jednocześnie żywotny . W: Biologia w naszych czasach . taśma 39 , nie. 5 , 2009, s. 328–334 , doi : 10.1002 / biuz.200910403 .
- FP Springer: O siarce i siarkowodorze – historia tych składników gazu ziemnego. Erdöl-Erdgas-Kohl, wydanie 10, 2011, s. 382-388.
- Ralf Steudel, David Scheschkewitz: Chemia niemetali: Syntezy - Struktury - Klejenie - Zastosowania , wyd. 2, De Gruyter, Berlin / Boston, 2020, ISBN 978-3-11-057805-8 , s. 555-564 .
linki internetowe
- baua.de: Ulotka do BK nr 1202: Choroby wywołane siarkowodorem
- Podwodna rzeka w Meksyku. W: Visboo. 17 listopada 2009 (zdjęcia widocznego nagromadzenia siarkowodoru na dnie jaskini)
- Bieżąca strona tylko na temat siarkowodoru
Indywidualne dowody
- ↑ b c d e f g h ı wejście na siarkowodoru na bazie substancji o GESTIS w IFA , do których dostęp 8 stycznia 2021 r. (wymagany JavaScript)
- ↑ a b Wpis dotyczący siarkowodoru. W: Rompp Online . Georg Thieme Verlag, dostęp 1 czerwca 2014 r.
- ↑ a b Ralf Steudel, David Scheschkewitz: Chemia niemetali: Syntezy - Struktury - Klejenie - Zastosowania , wyd. 2, De Gruyter, Berlin / Boston, 2020, ISBN 978-3-11-057805-8 , pp. 555-564.
- ↑ David R. Lide (red.): CRC Handbook of Chemistry and Physics . Wydanie 90. (Wersja internetowa: 2010), CRC Press / Taylor and Francis, Boca Raton, FL, Dipole Moments, s. 9-51.
- ↑ PG Sennikov VE Shkrunin Da Raldugin KG Tokhadze: słaby Wiązania wodorowe w etanolu i wodzie roztworów ciekłych, lotnych nieorganiczne wodorki grupy IV - VI elementów (SiH 4 GEH 4 , pH 3 , popiół 3 , H 2 S i H 2 Se). 1. Spektroskopia IR wiązania H w roztworach etanolu w wodorkach . W: Czasopismo Chemii Fizycznej . taśma 100 , nie. 16 , 1996, s. 6415-6420 , doi : 10.1021/jp953245k .
- ↑ Wpis na siarkowodór w wykazie klasyfikacji i oznakowania w Europejskiej Agencji Chemikaliów (ECHA), dostępne w dniu 1 lutego 2016 roku producenci lub dystrybutorzy mogą rozwinąć się zharmonizowanej klasyfikacji i oznakowania .
- ↑ Swiss Accident Insurance Fund (Suva): Wartości limitów - aktualne wartości MAK i BAT , dostęp 2 listopada 2015 r.
- ↑ Wolfgang Legrum: Zapachy, między smrodem a zapachem , Vieweg + Teubner Verlag (2011) s. 61-62, ISBN 978-3-8348-1245-2 .
- ^ Franz Fehér w: Georg Brauer (Hrsg.): Podręcznik preparatywnej chemii nieorganicznej , tom 1, wydanie 3, F. Enke Verlag, Stuttgart, 1975, s. 360-361.
- ↑ a b A.G. Cubitt i wsp.: Wybrane właściwości termodynamiczne ciekłego siarkowodoru i siarczku deuteru w J. Chem. Thermodyn. 19 (1987) 703.
- ^ AP Drozdov i in.: Konwencjonalne nadprzewodnictwo przy 203 kelwinach przy wysokich ciśnieniach w układzie wodorku siarki . Nature Letter 525, 2015, s. 73–76, doi: 10.1038 / nature14964 .
- ↑ Manfred Lindinger: Idealny przewodnik na arktyczne zimno . FAZ 21 sierpnia 2015 r.
- ↑ Ralf Steudel: Chemia niemetali: Syntezy - Struktury - Klejenie - Zastosowanie , wydanie 4, de Gruyter, Berlin / Boston, 2013, s. 173.
- ↑ PM May, D. Batka, G. Hefter, E. Königsberger, D. Rowland, Goodbye to S 2 w roztworze wodnym. Chemical Communications 2018, 54, strony 1980-1983. DOI: 10.1039 / c8cc00187a
- ↑ Elisabeth Brandes, Wolfgang Möller: Ciecze i gazy łatwopalne. Wirtschaftsverlag NW, Bremerhaven 2003, ISBN 3-89701-745-8 ( Parametry związane z bezpieczeństwem. Tom 1).
- ↑ https://onlinelibrary.wiley.com/doi/epdf/10.1002/3527600418.mb778306d0043 Substancje szkodliwe dla zdrowia , dostawa 43, wydanie 2007, dostęp 30 stycznia 2021
- ↑ Jürgen Falbe, Manfred Regitz (red.): Römpp Chemie-Lexikon . Thieme, Stuttgart 2007, ISBN 978-3-13-149231-9 .
- ↑ RJ Reiffenstein, WC Hulbert, SH Roth: Toksykologia siarkowodoru. W: Annual Review of Pharmacology and Toxicology Tom 32, 1992, s. 109-134. doi: 10.1146 / annurev.pa.32.040192.00045 , PMID 1605565 (przegląd).
- ↑ M. Goubern, M. Andriamihaja i in.: Siarczek, pierwszy nieorganiczny substrat dla komórek ludzkich. W: Czasopismo FASEB : oficjalna publikacja Federacji Amerykańskich Towarzystw Biologii Eksperymentalnej, tom 21, numer 8, czerwiec 2007, s. 1699-1706. doi: 10.1096/fj.06-7407com . PMID 17314140 .
- ↑ a b c M. H. Stipanuk, I. Ueki: Postępowanie z siarką metioniny/homocysteiny: metabolizm cysteiny do tauryny i siarki nieorganicznej. W: Journal of dziedzicznej choroby metabolicznej tom 34, numer 1, luty 2011, s. 17-32. doi: 10.1007 / s10545-009-9006-9 . PMID 20162368 . PMC 290177 (darmowy pełny tekst). (Przejrzeć).
- ↑ TM Hildebrandt, MK Grieshaber: aktywności enzymatyczne trzech katalizują utlenianie siarczku do tiosiarczan w mitochondriach ssaków i bezkręgowców. W: The FEBS Journal Volume 275, Number 13, July 2008, s. 3352-3361. doi: 10.1111 / j.1742-4658.2008.06482.x . PMID 18494801 .
- ↑ Rui Wang: Siarkowodór: nowy EDRF . W: Nerka International . taśma 76 , nie. 7 , 2009, s. 700-704 , doi : 10.1038 / ki.2009.221 .
- ↑ Roberta d'Emmanuele di Villa Biancaa et al.: Siarkowodór jako mediator rozluźnienia mięśni gładkich ciał jamistych człowieka. W: Materiały Narodowej Akademii Nauk . 106, nr 11, 2009, doi: 10.1073 / pnas.0807974105 .
- ↑ Eric Blackstone, Mike Morrison, Mark B. Roth: H2S wywołuje stan podobny do animacji u myszy . W: Nauka . taśma 308 , nie. 5721 , 2005, s. 518 , doi : 10.1126 / nauka.1108581 .
- ↑ Eelke M. Bos i wsp.: Hipometabolizm wywołany siarkowodorem zapobiega niedokrwieniu nerek / urazom reperfuzyjnym . W: Journal of the American Society of Nefrology . taśma 20 , nie. 9 , 2009, s. 1901-1905 , doi : 10.1681 / ASN.2008121269 .
- ↑ Ikaria: Pipeline ( Memento z 21 czerwca 2009 w Internet Archive )
- ↑ Mark Roth: Zawieszona animacja jest w naszym zasięgu. W: TED . luty 2010, dostęp 4 października 2020 (w języku angielskim, wideo).
- ↑ Gloria A. Benavides i wsp.: Siarkowodór pośredniczy w wazoaktywności czosnku. W: Proceedings of National Academy of Sciences. 104, nr 46, 2007, s. 17977-17982, doi: 10.1073 / pnas.0705710104 .
- ↑ B. Lange, ZJ Vejdelek: Analiza fotometryczna. Verlag Chemie, Weinheim 1980, ISBN 3-527-25853-1 .
- ↑ NS Lawrence, RP Deo, J. Wang; Elektrochemiczne oznaczanie siarkowodoru na elektrodach modyfikowanych nanorurek węglowych W: Analytica Chimica Acta . 517, nr 1-2, 2004, str. 131-137, doi: 10.1016/j.aca.2004.03.101 .
- ↑ P. Jeroschewski, C. Steuckart, M. Kühl: Amperometryczny mikroczujnik do oznaczania H 2 S w środowiskach wodnych. W: Chemia analityczna . 68, nr 24, 1996, s. 4351-4357, doi: 10.1021/ac960091b .
- ↑ N. Miura, Y. Yan, G. Lu, N. Yamazoe; Charakterystyka i mechanizm wykrywania czujnika siarkowodoru za pomocą stabilizowanej elektrody cyrkonowej i tlenkowej. W: Czujniki i siłowniki B: Chemiczne . 34, nr 1-3, 1996, s. 367-372, doi: 10.1016 / S0925-4005 (96) 01828-X .
- ↑ P. Jeroschewski, K. Haase, A. Trommer, P. Gruendler: Czujnik galwaniczny do oznaczania siarkowodoru. W: Elektroanaliza . 6, nr 9, 2005, str. 769-772, doi: 10.1002/elan.1140060910 .
- ↑ T. Ubuka, T. Abe, R. Kajikawa, K. Morino: Oznaczanie siarkowodoru i siarki kwasoodpornej w tkankach zwierzęcych metodą chromatografii gazowej i jonowej. W: Journal of Chromatography B: Biomedical Sciences and Applications . 757, nr 1, 2001, s. 31-37, doi: 10.1016 / S0378-4347 (01) 00046-9 .
- ↑ JB Laurens, ER Rowher; Szybka analiza zanieczyszczeń H 2 S i COS w gazie węglowym metodą kapilarnej chromatografii gazowej. W: Journal of High Resolution Chromatography . 19, nr 4, 1996, s. 217-223, doi: 10.1002/jhrc.1240190408 .
- ↑ M. Jiang, P. Ning, Y. Shi: Oznaczanie siarkowodoru w gazach odlotowych metodą chromatografii gazowej. W: Journal of Environment and Health. 25, 2008 s. 1088-1089 ( streszczenie ).