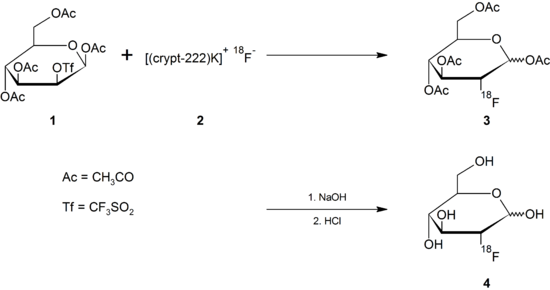Fluorodeoksyglukoza
| Formuła strukturalna | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Generał | ||||||||||||||||
| Nazwa niezastrzeżona | Fludeoksyglukoza ( 18 F) | |||||||||||||||
| inne nazwy |
|
|||||||||||||||
| Formuła molekularna | C 6 H 11 FO 5 | |||||||||||||||
| Identyfikatory zewnętrzne / bazy danych | ||||||||||||||||
| ||||||||||||||||
| Informacje o narkotykach | ||||||||||||||||
| Kod ATC | ||||||||||||||||
| nieruchomości | ||||||||||||||||
| Masa cząsteczkowa | ||||||||||||||||
| Stan fizyczny |
mocno |
|||||||||||||||
| Temperatura topnienia |
170-176 °C |
|||||||||||||||
| instrukcje bezpieczeństwa | ||||||||||||||||
| ||||||||||||||||
| W miarę możliwości i zwyczajowo stosowane są jednostki SI . O ile nie zaznaczono inaczej, podane dane dotyczą warunków standardowych . | ||||||||||||||||
2-fluoro-2-dezoksy D -glukozy (uproszczony fluorodeoksyglukozy , FDG przez krótki ) jest strukturalnym odpowiednikiem do monosacharydu D - glukoza . W pozycji 2 zamiast grupy OH znajduje się atom fluoru .
Jest stosowany jako narzędzie diagnostyczne in vivo w medycynie. Naturalny cukier i jego mimetyk FDG są początkowo wchłaniane przez komórki ludzkiego ciała w ten sam sposób, ale później są inaczej metabolizowane. Powoduje to zamierzone wzbogacenie środka diagnostycznego w niektórych komórkach organizmu. Stężenie znacznika FDG w badanych tkankach jest rejestrowane tomograficznie . W ten sposób lokalizowane są odchylenia od normy i tym samym uzyskuje się wskazania organicznych zaburzeń czynnościowych . FDG znakowany radionuklidem fluoru-18 ( 18 F) jest najczęściej stosowanym radiofarmaceutykiem w pozytonowej tomografii emisyjnej . Wolny od promieniowania FDG jest eksperymentalnie testowany w tomografii rezonansu magnetycznego . FDG nie jest zatwierdzony jako środek terapeutyczny .
historia
Syntezę fluorodeoksyglukozy po raz pierwszy opracowali w 1968 roku Josef Pacák, Zdeněk Točík i Miloslav Černý na Uniwersytecie Karola w Pradze . W 1970 roku opublikowano alternatywną drogę syntetyczną. Właściwość FDG do hamowania enzymu heksokinazy , który jest ważny dla metabolizmu cukrów , została opisana w 1972 roku. Tatsuo Ido, Alfred P. Wolf i Joanna Fowler z Brookhaven National Laboratory jako pierwsi opisali syntezę radioaktywnego 18 F-FDG w 1976 roku . Pierwsza synteza Tatsuo Ido odniosła sukces w grupie Wolf. Związek ten został wstrzyknięty przez Abass Alavi dwóm ochotnikom na Uniwersytecie Pensylwanii w sierpniu tego roku . Pierwsze zdjęcia mózgu, na których po raz pierwszy pokazano rozkład FDG w tym narządzie, wykonano konwencjonalną kamerą gamma , a nie pozytonowym tomografem emisyjnym. W 1984 r. opisano proces, który po dalszym rozwoju w 1986 r. służył od tego czasu jako szablon do wytwarzania radiofarmaceutyku. Obecnie jest stosowany w onkologii i neurologii, gdzie jest zdecydowanie najszerzej stosowanym narzędziem diagnostycznym.
synteza
Krótki okres półtrwania radioaktywnego izotopu fluoru stawia wysokie wymagania przy produkcji radiofarmaceutyku. Należy zapewnić szybkie procesy syntezy, czyszczenia i sterylizacji. Obecnie wytwarzanie 18 F-2-fluoro-2-dezoksy D- glukoza jest zautomatyzowane. Zakres kontroli jakości jest ograniczony okolicznościami.
Opisano szereg możliwych reakcji na produkcję. Istnieją dwa główne sposoby: poprzez syntetyczne addycji elektrofilowej , to znaczy dodanie 18 F-F 2 do podwójnego wiązania, a podstawienia nukleofilowego z 18 F - .
Substytucja nukleofilowa
Droga przez podstawienie nukleofilowe jest drogą rutynową i jest tu opisana przykładowo, z grupami ochronnymi usuwanymi za pomocą kwasów lub zasad w różnych procesach podstawienia nukleofilowego .
Dokonywanie 18 F -
W tym przypadku naturalne atom fluoru liczby nukleon 19 cząsteczki 2-FDG jest zastąpiony radioaktywnego fluor-18 izotopu . Ten izotop jest emiterem pozytonów o okresie półtrwania wynoszącym zaledwie 109,8 minuty. Nie istnieje w naturze ze względu na szybki rozkład . W celu otrzymania 18 -F 2-FDG tego izotopu uzyskuje się zazwyczaj za pomocą cyklotronu na przykład przez bombardowanie ciężkiego tlenu izotop 18 O z protonów lub 20 Ne . Od bezpośredniego napromieniowania normalnego glukozy protonami wysokiej energii dla zamierzonego formowania 18 F-2-FDG tylko prowadzi do zniszczenia cząsteczki organicznej, izotop radioaktywny muszą być wytwarzane oddzielnie za pomocą cyklotronu, a następnie poddaje dalszej obróbce.
W cyklotronie tarcza zbudowana z wody H 2 18 O wzbogacona izotopem tlenu 18 O jest bombardowana wysokoenergetycznymi protonami (ok. 15 MeV ). W reakcji jądrowej niewielka część tlenu 18 O jest przekształcana w radioaktywny izotop fluoru 18 F, wychwytując proton i uwalniając neutron .
Wdrożenie z prekursorem
Utworzony fluorek jest oddzielany od wody przez wymieniacz jonowy, a następnie oddzielany (eluowany) z wymieniacza jonowego roztworem acetonitrylu , Kryptofix 222 i węglanu potasu ( 2 ).
W rzeczywistym podstawieniu nukleofilowym radioaktywny jon fluorkowy zastępuje łatwo usuwalną grupę opuszczającą , taką jak triflat . Odpowiednim prekursorem do wytwarzania 2-FDG drogą nukleofilowego podstawienia wynosi 1,3,4,6- O- acetylo-2- O -trifluoromethanesulfonyl-β- D -mannopyranose ( 1 ), określa się jako mannozy trifluorometanosulfonianu dla zwarcia . Po podstawieniu trifluorometanosulfonianu usuwa się cztery acetylowe grupy zabezpieczające za pomocą zasadowej lub kwasowej hydrolizy rozcieńczonym roztworem wodorotlenku sodu lub rozcieńczonym kwasem solnym ( 4 ).
Dodatek elektrofilowy
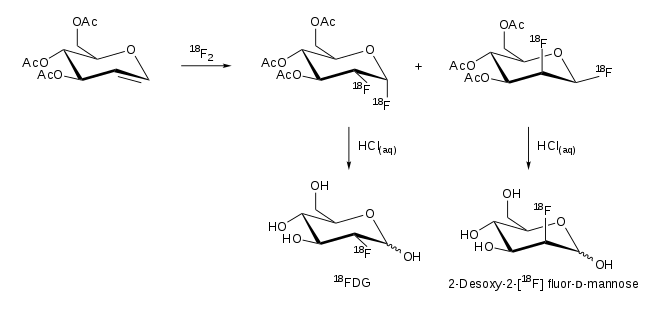
Ponadto, nie jest droga syntezy dodatkowo z 18 F-F 2 . W wyniku reakcji 3,4,5-tri- O- acetylo- D- glukalu powstają dwa produkty, 2-FDG i 2-fluorodeoksymannoza:
Oczyszczenie
Utworzony 2-FDG można czysto oddzielić od materiałów wyjściowych przez ekstrakcję w fazie stałej lub wysokosprawną chromatografię cieczową z odwróconą fazą (RP-HPLC). Oczyszczanie jest ważnym krokiem w produkcji 2-FDG w celu spełnienia wymagań poszczególnych farmakopei i Dobrej Praktyki Wytwarzania (GMP). Zgodnie z Farmakopeą Europejską ponad 95% radioaktywności musi pochodzić z fluorodeoksyglukozy i fluorodeoksymannozy , przy czym udział fluorodeoksymannozy nie może przekraczać 10% radioaktywności. Etapy oczyszczania odbywają się w zamkniętych urządzeniach osłoniętych ogniwami ołowianymi.
metabolizm
18 F fluorodeoksyglukozy rozpuszcza się w komórkach ludzkiego ciała, takie jak glukoza, mimo że grupa hydroksylowa jest zastąpiona przez radionuklidów 18 F w jednym miejscu w cząsteczce . 2-FDG jest wychwytywany przez komórki z krwi za pomocą transporterów glukozy . W ramach projektu genomu ludzkiego zidentyfikowano u ludzi 14 transporterów glukozy (GLUT).
GLUT-1 jest najważniejszym białkiem transportowym dla wychwytu 2-FDG w nowotworach i prawidłowej tkance mózgowej. Wychwyt w mięśniach szkieletowych i mięśniu sercowym może być stymulowany insuliną i odbywa się za pośrednictwem transportera GLUT-4 . Enzym heksokinazy następnie fosforyluje 2-FDG w komórce. Jednak 2-FDG nie może być dalej metabolizowany przez komórki po fosforylacji. Reakcja odwrotna , defosforylację FDG-6 fosforanu do FDG, odbywa się bardzo powoli, we wszystkich narządach - z wyłączeniem wątroby, - oraz w tkance guza. W związku z tym w komórkach dochodzi do akumulacji fosforanu FDG-6 ( pułapkowanie metaboliczne ). Na podstawie rozpadu 18 F można wykryć 2-FDG. Dystrybucja 2-FDG w organizmie pozwala na wyciągnięcie wniosków na temat metabolizmu glukozy w różnych tkankach. Jest to szczególnie korzystne dla wczesnej diagnozy raka, ponieważ komórka nowotworowa zazwyczaj zużywa dużo glukozy z powodu zwiększonego metabolizmu i odpowiednio gromadzi 2-FDG. Aktywność metaboliczną guza opisuje się ilościowo za pomocą wartości SUV .
Jako cząsteczka bardzo podobna do glukozy, 2-FDG z łatwością przekracza barierę krew-mózg . Ponieważ ludzki mózg ma wysokie zapotrzebowanie na glukozę, odpowiednio duża część 2-FDG jest akumulowana w mózgu. Ponadto u zdrowych ludzi 2-FDG gromadzi się w nerkach i drogach moczowych.
18 C rozkłada się do 18 O, naturalnym izotopie tlenu. Bezpośrednio po rozkładzie, po pobraniu z otoczenia wolnego atomu wodoru, tworzy się grupa hydroksylowa . Tak więc po rozpadzie radioaktywnym z 2-FDG powstaje „normalna” glukoza.
Glukoza osad następnie metabolizowane w zwykły sposób w glikolizie , a 18 C-2-FDG hamuje fosforanowe enzymu w następnym etapie reakcji glikolizy ( glukoza-izomeraza 6-fosforanu ). Komórki nowotworowe również nie ma wystarczającej ilości enzymu glukozo-6-fosfatazy , aby pobudzać odwrotną reakcję 18 F-2-FDG-fosforanu do 18 F-2-FDG.
Obrazu możliwe z rozpadu 18 F-2-FDG jest to obraz rozkładu wychwytu glukozy i fosforylacji komórek w organizmie człowieka. FDG wykazuje również zwiększony wychwyt w guzach myszy, szczurów, chomików i królików. U szczurów 2-FDG w nowotworach, ze względu na zwiększoną aktywność metaboliczną, wykazuje 22-krotną akumulację w porównaniu z krążeniem krwi godzinę po wstrzyknięciu, które pozostaje stałe przez kolejną godzinę.
Aplikacje
2-FDG jest stosowany w PET do diagnozy , określania stopnia zaawansowania , dostosowania terapii i kontroli terapii. W tym kontekście często mówi się o „FDG-PET”. Jako środek diagnostyczny 2-FDG jest niezwykle użytecznym i sprawdzonym związkiem. Aplikacja ma podłoże czysto diagnostyczne. Wykorzystywane jest promieniowanie gamma wytwarzane przez anihilację pozytonu i elektronu . Podczas anihilacji powstają dwa wysokoenergetyczne fotony (kwanty gamma), które mają energię 511 keV i są emitowane pod kątem 180 stopni względem siebie. Kwanty gamma stosowane w diagnostyce nie nadają się do terapii ( radioterapia , w tym przypadku mówi się o endoradioterapii).
Oprócz głównego zastosowania w onkologii, 2-FDG jest również wykorzystywany do diagnozowania choroby Alzheimera , choroby Parkinsona , padaczkę , w kardiologii i zapalenie diagnostyki , choć w znacznie mniejszym stopniu niż w onkologii.
FDG-PET ma trzy główne wskazania do badania pacjentów z chorobami onkologicznymi: różnicowanie między guzami łagodnymi lub złośliwymi (łagodnymi lub złośliwymi), stopniowanie guza w odniesieniu do węzłów chłonnych i przerzutów odległych oraz różnicowanie między tkanką bliznowatą a żywą tkanką nowotworową ( nawrót , guz resztkowy). FDG-PET stosowane w onkologii do badania raka płuc , raka jelita grubego , raka przełyku , raka żołądka , raka głowy i szyi , raka szyjki macicy , raka jajnika , raka piersi , czerniaka złośliwego i większość rodzajów chłoniaków . W szczególności, bardzo wolno rosnące guzy na ogół nie wykazują znacząco zwiększonego wychwytu FDG. Badanie FDG PET jest zwykle przydatne tylko w wyjątkowych przypadkach. Należą do nich rak prostaty , zróżnicowane guzy neuroendokrynne (np. rakowiak ), raki oskrzelowo-pęcherzykowe, chłoniaki nieziarnicze o niskim stopniu złośliwości, guzy mózgu o niskim stopniu złośliwości ( gwiaździak II, skąpodrzewiak II) oraz rak wątrobowokomórkowy (szczególnie bardziej zróżnicowane formy). Oprócz tkanki nowotworowej stany zapalne lub gojenia wykazują również zwiększoną aktywność metaboliczną, a tym samym zwiększony wychwyt FDG. W związku z tym badanie w celu odróżnienia np. ropni i tkanki nowotworowej, sarkoidozy , raka oskrzeli itp. jest trudne do przeprowadzenia za pomocą 2-FDG.
Wysoki poziom cukru we krwi prowadzi do zmniejszonego wychwytu 2-FDG w tkance guza, co pogarsza stosunek sygnału do szumu . W przypadku wartości cukru we krwi na czczo powyżej 150 mg/dl, wskazanie do FDG-PET jest więc zazwyczaj krytycznie sprawdzane. Po zakończeniu chemioterapii lub radioterapii często dochodzi do zmniejszenia wychwytu FDG nawet w przypadku żywotnych komórek nowotworowych. Dlatego między badaniem PET a zakończeniem terapii powinien upłynąć co najmniej 4 tygodnie. Wyjątkiem są badania kontrolne i niektóre badania kliniczne . Alternatywami dla 2-FDG są m.in. B. radioaktywnie kwasy aminowe , takich jak 11 C- metioninę określania biosyntezy białka , radioaktywnie 11 C - choliny do określenia syntezy lipidów błonowych i radioaktywnie 11 C- octanu do oznaczania tłuszczowego syntezy kwasów . Jednak tylko 2-FDG jest zatwierdzony jako znacznik przez Food and Drug Administration w Stanach Zjednoczonych . W Niemczech FDG został zatwierdzony jako znacznik w 2000 i 2005 roku.
podanie
W przypadku skanowania całego ciała poszukuje nowotworów lub ich przerzutów , w dawce około 200 do 400 MBq jest wtryskiwany do pacjenta żyły za pomocą izotonicznego roztworu chlorku sodu . Poziom aktywności do zastosowania jest liczony od pacjenta, powierzchni ciała . Celem jest umożliwienie rejestracji około 210 000 zdarzeń na zmianę w PET. Maksymalna zalecana dawka roztworu FDG do wstrzykiwań wynosi 10 mg, co odpowiada 55 mikromoli .
Pacjent musi pościć przez co najmniej sześć godzin przed zastosowaniem 2-FDG, aby uzyskać jak najniższy poziom cukru we krwi . Wymóg ten jest problematyczny dla niektórych diabetyków , ponieważ odpowiednie kliniki zwykle nie przeprowadzają badania PET, jeśli poziom cukru we krwi przekracza 10 mmol/l. Poziom cukru we krwi żylnej jest określany przed każdym badaniem FDG-PET.
Po wstrzyknięciu pacjent zwykle musi leżeć w jak największym stopniu bez aktywności fizycznej przez godzinę, aby zapewnić równomierne rozmieszczenie 2-FDG w organizmie. Wysiłek mięśniowy kierowałby 2-FDG do odpowiednich mięśni i fałszował wynik lub prowadziłby do artefaktów w obrazowaniu. Często obserwuje się silną akumulację 2-FDG w okolicy języka, co jest spowodowane częstymi i silnymi ruchami połykania u pacjentów, z których część znajduje się w skrajnym stresie psychicznym .
Przed aplikacją pacjent może spożyć wodę lub inne napoje bez kalorii. Bezpośrednio przed rozpoczęciem ekspozycji pacjent powinien opróżnić pęcherz.
Narażenie na promieniowanie
Dawka promieniowania dla PET z 2-FDG wynosi ok. 7–10 mSv . Dla porównania dawka promieniowania dla tomografii komputerowej z kontrastem wynosi ok. 20–40 mSv. Poziom tej dawki jest w przybliżeniu dwu-, a nawet trzykrotnie wyższy od dawki promieniowania naturalnego, na które narażona jest średniorocznie ludność europejska (ok. 3 mSv rocznie). Z tego powodu ryzyko wystąpienia skutków ubocznych związanych z promieniowaniem jest pomijalnie małe. Skuteczna dawka po dożylnym wstrzyknięciu 2-FDG wynosi 2,0 × 10-2 mSv/MBq. Najwyższa ekspozycja na promieniowanie pęcherza moczowego wynosi 1,7 × 10-1 mSv / MBq. Po aplikacji nie należy karmić piersią przez co najmniej 10 okresów półtrwania (1098 minut, co odpowiada około 18 godzinom) .
Skutki uboczne
Nie są znane żadne alergiczne lub toksyczne skutki uboczne. Zlokalizowana jest ekstremalnie niska dawka wstrzykiwanego 2-FDG w zakresie pikomoli do nanomoli , a stosunkowo łagodny rodzaj promieniowania to wyklucza. Dla porównania , ilości środków kontrastowych stosowanych w tomografii komputerowej lub tomografii rezonansu magnetycznego mieszczą się w zakresie kilku milimoli, czyli są o około 6 do 9 rzędów wielkości wyższe.
Zastosowania terapeutyczne
Podczas gdy promieniowanie gamma z 2-FDG jest w dużej mierze bezużyteczne terapeutycznie, promieniowanie β + pozytonu, podobnie jak promieniowanie β - elektronu, ma potencjał terapeutyczny. Wynika to głównie z krótkiego zasięgu pozytonów w tkance guza – tylko 1 do 2 mm – oraz dość wysokiej selektywnej akumulacji 2-FDG w tkance guza. Wstępne badania zostały przeprowadzone w czerniaku , raku piersi i raku jelita grubego . Zatwierdzenie do leczenia raka nie było 2-FDG.
literatura
- Klaus Wienhard, Rainer Wagner, Wolf-D. Gorący: PET. Podstawy i zastosowania pozytonowej tomografii emisyjnej. Springer, Berlin i in. 1989, ISBN 3-540-19451-7 .
- Klaus Kopka, Otmar Schober , Stefan Wagner: Znaczniki sercowe PET znakowane 18 F: wybrane sondy do obrazowania molekularnego transporterów, receptorów i proteaz . W: Basic Research in Cardiology , 2008, tom 103, wydanie 2, s. 131-143; doi: 10.1007 / s00395-008-0703-6 ; PMID 18324369 .
- A. Zhu, DM Marcus, HK Shu, H. Shim: Zastosowanie obrazowania metabolicznego PET w radioterapii onkologicznej . W: Radiation Research , 2012, tom 177, wydanie 4, s. 436-448; PMID 22339451 ; PMC 3922713 (darmowy pełny tekst).
linki internetowe
Indywidualne dowody
- ^ B Josef Pacák Zdenek Točík Miloslav Černý: Synteza 2-dezoksy-2-fluoro- D -glukozy . W: Journal of the Chemical Society D: Chemical Communications , 1969, s. 77-77; doi: 10.1039 / C2969000077 .
- ↑ a b Karta danych 2-Fluoro-2-deoksy- D- glukoza z Sigma-Aldrich , dostęp 16 listopada 2016 ( PDF ).
- ^ J. Adamson, AB Foster, LD Hall, RN Johnson, RH Heese: fluorowane węglowodany: część III. 2-deoksy-2-fluoro- D- glukoza i 2-deoksy-2-fluoro- D- mannoza . W: Carbohydrate Research , 1970, rok 15, tom 3, s. 351-359; doi: 10.1016 / S0008-6215 (00) 80451-6 .
- ↑ EM Bessell, AB Foster, JH Westwood: The Use of Deoxyfluoro- D- glucopyranoses and Related Compounds in a Study of Yeast Hexokinas Specificity . W: The Biochemical Journal , 1972, tom 128, wydanie 2, str. 199-204, PMID 4563639 , PMC 1173755 (pełny tekst).
- ^ B T. Ido cn Wan JS Fowler AP Wilk: fluorowania F 2 . Wygodna synteza 2-dezoksy-2-fluoro- D- glukozy . W: J.Org.Chem. , 1977, tom 42, wydanie 13, str. 2341-2342; doi: 10.1021/jo00433a037 .
- ↑ a b T. Ido, C.-N. Wan, V. Casella, JS Fowler, AP Wolf, M. Reivich, DE Kuhl: Znakowane analogi 2-deoksy-D-glukozy: 2-deoksy-2-fluoro-D-glukoza znakowana 18 F, 2-deoksy-2 -fluoro-D-mannoza i 14C -2-deoksy-2-fluoro-D-glukoza . W: Journal of Labeled Compounds and Radiopharmaceuticals , 1978, tom 14, wydanie 2, str. 174-183; doi: 10.1002 / jlcr.2580140204 .
- ↑ Joanna S. Fowler, Michael J. Welch: Alfred P. Wolf, Biographical Memoirs National Academy of Sciences, tom 78, s. 361, nap.edu
- ↑ Abass Alavi, Martin Reivich: Koncepcja obrazowania FDG-PET . W: Seminars in Nuclear Medicine , 2002, tom 32, wydanie 1, s. 2–5; doi: 10.1053 / snuc.2002.29269 ; PMID 11839067 .
- ↑ K. Hamacher: fazowego katalizowanej Synteza 4-S-P- D -glucopyranosyl-4-tio- D -glucopyranose (thiocellobiose) 2-S-P- D -glucopyranosyl-2-tio- D -glucopyranose ( tiozoforoza) . W: Carbohydrate Research , 1984, tom 128, wydanie 2, str. 291-295; doi: 10.1016 / 0008-6215 (84) 85336-7 .
- ↑ K. Hamacher HH Coenen G. Stöcklin: Skuteczne stereospecyficznej Synteza nr-nośnik dodano 2- [ 18 F] fluoro-2-dezoksy D- glukozę z użyciem Aminopolyether Obsługiwane nukleofilowego podstawienia . W: Journal of Nuclear Medicine , 1986, tom 27, wydanie 2, s. 235-238; PMID 3712040 ; jnm.snmjournals.org (PDF)
- ↑ Załączniki do stanowiska Sekcji Chemii Jądrowej. ( Pamiątka z 31 marca 2010 r. w archiwum internetowym ; PDF) Towarzystwo Niemieckich Chemików, luty 2000 r.
- ↑ Simone Maschauer, Olaf Prante: Słodzenie radiochemii farmaceutycznej przez 18 F-fluoroglikozylację: krótki przegląd . W: BioMed Research International , tom 2014, artykuł nr 214748; doi: 10.1155 / 2014/214748 ; PMID 24991541 ; PMC 4058687 (darmowy pełny tekst).
- ↑ a b S. Yu: Przegląd syntezy 18 F-FDG i kontroli jakości . W: Biomedical Imaging and Intervention Journal , 2006, tom 2, wydanie 4, e57; PMID 21614337 ; PMC 3097819 (darmowy pełny tekst).
- ↑ G. Audi, O. Bersillon, J. Blachot, AH Wapstra: Ocena NUBASE właściwości jądrowych i rozpadu . W: Nuclear Physics A , 729, 2003, s. 3–128, tutaj: s. 29. doi: 10.1016 / j.nuclphysa.2003.11.001 ; amdc.in2p3.fr (PDF; 1,0 MB).
- ↑ a b c d e Harald Schicha: Medycyna nuklearna. Schattauer Verlag, 2007, ISBN 978-3-7945-2438-9 , s. 55-58.
- ^ R. Lambrecht, AP Wolf: Cyklotron i krótkotrwałe izotopy halogenowe do zastosowań radiofarmaceutycznych. W: Radiopharmaceuticals and Labeled Compounds , Międzynarodowa Agencja Energii Atomowej, Wiedeń 1973, m.1 : s. 275-290.
- ↑ Ali Mobasheri: Ułatwiający transporter glukozy w chondrocytach stawowych. Springer Science & Business Media, 2008, ISBN 978-3-540-78899-7 , s. 22 ( ograniczony podgląd w wyszukiwarce książek Google).
- ↑ a b c d e f g h i j pozytonowa tomografia emisyjna (PET) dla zagadnień onkologicznych. ( Pamiątka z 29 września 2007 w Internet Archive ; PDF) TU Monachium.
- ^ Daniel N. DeMaio: Recenzja egzaminu Mosby'ego dla tomografii komputerowej. Elsevier Health Sciences, 2010, ISBN 978-0-323-06589-4 , s. 184.
- ↑ b Kam Leung: [ 18 d] fluoro-2-dezoksy-2- D -glukozy . W: Molecular Imaging and Contrast Agent Database (MICAD) , 2005; Pełny tekst . PMID 20641537 .
- ↑ P. Som, HL Atkins, D. Bandoypadhyay, JS Fowler, RR MacGregor, K. Matsui, ZH Oster, DF Sacker, CY Shiue, H. Turner, CN Wan, AP Wolf, SV Zabinski: fluorowany analog glukozy, 2 -fluoro-2-deoksy- D- glukoza (F-18): Nietoksyczny znacznik do szybkiego wykrywania guza . W: Journal of Nuclear Medicine , 1980, tom 21, wydanie 7, str. 670-675, PMID 7391842 ; jnm.snmjournals.org (PDF)
- ↑ H. Fukuda, T. Matsuzawa, Y. Abe, S. Endo, K. Yamada, K. Kubota, J. Hatazawa, T. Sato, M. Ito, T. Takahashi, R. Iwata, T. Ido: Eksperymentalne badanie do diagnozowania raka pozytronowo znakowanej glukozy fluorowanych analogów: [ 18 F] -2-fluoro-2-dezoksy-D-mannozy: nowego wskaźnika do wykrywania raka . W: European Journal of Nuclear Medicine , 1982, tom 7, wydanie 7, s. 294-297; doi: 10.1007 / BF00253423 ; PMID 6981508 .
- ^ E. Croteau, JM Renaud, MA Richard, TD Ruddy, F. Benard, RA deKemp: Biomarkery metabolizmu PET dla raka . W: Biomarkery w raku , 2016, 8, Suppl 2, s. 61-69; doi: 10.4137 / BIC.S27483 ; PMID 27679534 ; PMC 5030827 (darmowy pełny tekst).
- ^ S. Hofman, RJ Hicks: Jak czytamy Onkologiczne FDG PET / CT . W: Cancer Imaging : oficjalna publikacja International Cancer Imaging Society , 2016, tom 16, wydanie 1, s. 35; doi: 10.1186 / s40644-016-0091-3 ; PMID 27756360 ; PMC 5067887 (darmowy pełny tekst).
- ↑ S. Segobin, R. La Joie, L. Ritz, H. Beaunieux, B. Desgranges, G. Chételat, AL Pitel, F. Eustache: Wkład FDG-PET do patofizjologii upośledzenia pamięci . W: Neuropsychology Review , 2015, tom 25, wydanie 3, s. 326–355; doi: 10.1007/s11065-015-9297-6 ; PMID 26319237 .
- ^ I. Sarikaya: Obrazowanie PET w neurologii: choroby Alzheimera i Parkinsona . W: Nuclear Medicine Communications , 2015, tom 36, wydanie 8, s. 775–781; doi: 10.1097/MNM.000000000000320 ; PMID 25920047 .
- ↑ JG Burneo, R. Poon, S. Kellett, OC Snead: użyteczność pozytonowej tomografii emisyjnej w padaczce . W: Canadian Journal of Neurological Sciences . Le journal canadien des sciences neurologiques , 2015, rok 42, zeszyt 6, s. 360–371; doi: 10.1017 / cjn.2015.279 ; PMID 26437611 .
- ↑ D. Jain, ZX He, V. Lele: Obrazowanie gorących punktów serca z 18 FDG . W: Seminars in Nuclear Medicine , 2014, tom 44, wydanie 5, s. 375–385; doi: 10.1053 / j.semnuclmed.2014.06.010 ; PMID 25234081 .
- ^ S. Vaidyanathan, CN Patel, AF Scarsbrook, FU Chowdhury: FDG PET / CT w zakażeniach i stanach zapalnych obecnych i pojawiających się zastosowaniach klinicznych . W: Radiologia kliniczna , 2015, tom 70, wydanie 7, s. 787-800; doi: 10.1016 / j.crad.2015.03.010 ; PMID 25917543 .
- ↑ a b c A. Zhu, DM Marcus, HK Shu, H. Shim: Zastosowanie obrazowania metabolicznego PET w radioterapii onkologicznej . W: Radiation Research , 2012, tom 177, wydanie 4, s. 436-448; PMID 22339451 ; PMC 3922713 (darmowy pełny tekst).
- ↑ K.-J. Langen, U. Braun, E. Rota Kops, H. Herzog, T. Kuwert, B. Nebeling, LE Feinendegen: Wpływ poziomów glukozy w osoczu na wychwyt fluoru-18-fluorodeoksyglukozy w rakach oskrzeli . W: Journal of Nuclear Medicine , 1993, tom 34, s. 355-359; PMID 8441023 ; jnm.snmjournals.org (PDF)
- ↑ a b Kliniczne zastosowanie FDG-PET Scan ( pamiątka z 3 lipca 2007 r. w Internet Archive ).
- ↑ Jak wysokie jest narażenie na promieniowanie? ( Pamiątka z 30 września 2007 r. w Internetowym Archiwum ).
- ^ Dawka promieniowania dla pacjentów z radiofarmaceutyków . Publikacja ICRP 53. Pergamon Press, 1987.
- ^ Zalecenia Międzynarodowej Komisji Ochrony Radiologicznej , publikacja ICRP 60, Pergamon Press, 1990.
- ^ Lennart Johansson, Sören Mattsson, Bertil Nosslin, Sigrid Leide-Svegborn: Skuteczna dawka od radiofarmaceutyków . W: European Journal of Nuclear Medicine , 1992, 19, s. 933-938; doi: 10.1007 / BF00175858 ; PMID 1308762 .
- ↑ Jerome Z. Litt: Podręcznik Erupcji i Reakcji Litta, wydanie 17. CRC Press, 2011, ISBN 978-1-84184-837-2 , s. 268.
- ↑ Renee M. Moadel Andrew V. Nguyen Elaine Y. Lin Ping Lu Mani Joseph M. Donald Blaufox Jeffrey W. Pollard Ekaterina Dadachova: pozytronowej tomografii czynnik 2-deoksy-2- [ 18 F], fluoru - D -glukozą ma potencjał terapeutyczny w leczeniu raka piersi . W: Breast Cancer Research , 2003, rok 5, zeszyt 6, s. R199 – R205; doi: 10.1186 / bcr643 ; PMID 14580255 ; PMC 314404 (darmowy pełny tekst).
- ↑ S. Jaini, E. Dadachova: FDG do terapii guzów aktywnych metabolicznie . W: Seminars in Nuclear Medicine , 2012, Volume 42, Issue 3, s. 185–189; doi: 10.1053 / j.semnuclmed.2011.12.001 ; PMID 22475427 (przegląd).