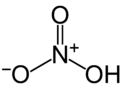
kwas azotowy
| Formuła strukturalna | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Generał | ||||||||||||||||
| Nazwisko | kwas azotowy | |||||||||||||||
| inne nazwy |
|
|||||||||||||||
| Formuła molekularna | ENT 3 | |||||||||||||||
| Krótki opis |
w czystej postaci bezbarwna ciecz, częściowo rozkładana pod wpływem światła lub ciepła do tlenków azotu o barwie od żółtej do czerwonej |
|||||||||||||||
| Identyfikatory zewnętrzne / bazy danych | ||||||||||||||||
| ||||||||||||||||
| nieruchomości | ||||||||||||||||
| Masa cząsteczkowa | 63,01 g mol- 1 | |||||||||||||||
| Stan fizyczny |
ciekły |
|||||||||||||||
| gęstość |
1,51 g cm- 3 (20°C) |
|||||||||||||||
| Temperatura topnienia |
-42 °C |
|||||||||||||||
| temperatura wrzenia |
86°C |
|||||||||||||||
| Ciśnienie pary |
56 hPa (20 ° C) |
|||||||||||||||
| Wartość p K S |
-1,37 |
|||||||||||||||
| rozpuszczalność |
Mieszalny z wodą we wszystkich proporcjach, gwałtowna reakcja z etanolem |
|||||||||||||||
| instrukcje bezpieczeństwa | ||||||||||||||||
| ||||||||||||||||
| MAK |
|
|||||||||||||||
| Dane toksykologiczne | ||||||||||||||||
| W miarę możliwości i zwyczajowo stosowane są jednostki SI . O ile nie zaznaczono inaczej, podane dane dotyczą warunków standardowych . | ||||||||||||||||
Kwas azotowy (HNO 3 ), znany również jako płyn septycznym , jest najlepszym znanym i stabilny kwas tlen od azotu . Kwas produkowany jest na skalę przemysłową od 1908 roku w procesie Ostwalda poprzez katalityczne utlenianie amoniaku. Amoniak był wcześniej wytwarzany z atmosferycznego azotu i wodoru w procesie Habera-Boscha .
Do soli kwasu azotowego o nazwie azotany . Nazwa kwas azotowy pochodzi od zwyczajowych nazw niektórych soli alkalicznych i ziem alkalicznych kwasu, które kończą się nazwą azotowy, np. Np.: saletra sodowa ( saletra chilijska), saletra potasowa ( saletra potasowa), saletra amonowa (saletra amonowa), saletra wapniowa ( saletra wapniowa lub saletrzak ), saletra barowa ( saletra barytowa). Do 1908 r. kwas azotowy otrzymywano z różnych rodzajów azotu przez dodanie silnego, słabo lotnego kwasu (kwas siarkowy). Nazwą soli azotanów kwasu azotowego bardzo często używa się nazwy niektórych organicznych związków kwasu azotowego – a mianowicie estrów kwasu azotowego. Więc z. Na przykład ester metylowy kwasu azotowego nazywany jest azotanem metylu (patrz także azotany ), chociaż warunki wiązania w estrach są zupełnie inne niż w solach. Sytuację komplikuje i pogłębia zamieszanie fakt, że niektóre specjalne estry kwasu azotowego nie są ani poprawnie określane jako estry, ani błędnie jako azotany w potocznym języku. B. Nitrogliceryna (nazwa prawidłowa: ester glicerolu kwasu tris-azotowego) lub nitroceluloza lub azotan celulozy .
Jako silny kwas nieorganiczny, kwas azotowy jest w dużej mierze zdysocjowany w roztworze wodnym i jest jednym z kwasów mineralnych . Czysty kwas jest bezbarwny i ma ostry, ostry zapach. Wykorzystywany jest m.in. do produkcji nawozów, barwników i materiałów wybuchowych.
historia
W piśmie Deventione veritatis z XII wieku wspomina się, że już w IX wieku arabski alchemik Geber stosował surowy kwas azotowy („Aqua dissolutiva”) przez ogrzewanie saletry na sucho ( łac. Sal petrae = sól kamienna; KNO 3 ) Cyprian Vitriol (CuSO 4 · 5 H 2 O) i ałun (KAl (SO 4 ) 2 · 12 H 2 O) mówi się, że zostały otrzymane. Mówi się, że w XIII wieku Albertus Magnus używał kwasu azotowego do oddzielania złota i srebra (oddzielanie wody, aqua fortis ). Jednak wiele pism przypisywano Albertusowi Magnusowi tylko po to, by nadać im większą wagę, prawdopodobnie w tym te dotyczące stosowania kwasu azotowego. Następnie saletrę ogrzewano witriolem żelaza (FeSO 4 · 7 H 2 O), co dawało wyższe wydajności w niższych temperaturach.
W połowie XVII wieku JR Glauber uzyskał czysty spirytus nitri poprzez konwersję i destylację kwasu azotowego z kwasem siarkowym , proces laboratoryjny, który jest nadal używany do produkcji kwasu azotowego, który w średniowieczu nazywany był również aqua fortis lub aqua valens i w świecie anglojęzycznym nazywany był mocną wodą . W połowie XVIII wieku AL Lavoisier uznał pierwiastki chemiczne azot i tlen za składniki kwasu azotowego . Dokładny skład został określony przez Henry'ego Cavendisha , któremu również udało się zsyntetyzować go z azotu w powietrzu za pomocą wyładowania elektrycznego .
Wydajna produkcja rozpoczęła się dopiero na początku XIX wieku, kiedy tani kwas siarkowy i azotan Chile były dostępne w wystarczających ilościach. Spalanie powietrza w łuku elektrycznym również zostało opracowane na dużą skalę (proces Birkelanda-Eyde'a , za Kristian Birkeland i Sam Eyde ), ale było konkurencyjne tylko w krajach o taniej energii elektrycznej . Katalityczne utlenianie amoniaku nad platyną odkrył CF Kuhlmann (1838). Jednak do czasu wynalezienia syntezy amoniaku przez Habera i Boscha amoniak pozostawał zbyt drogi w porównaniu z chilijskim azotanem. Na początku XX wieku Wilhelm Ostwald rozwinął produkcję kwasu azotowego od amoniaku do dojrzałości przemysłowej. Tanie utlenianie amoniakiem zastąpiło obecnie wszystkie inne procesy wielkoskalowe.
Produkcja

Kwas azotowy jest produkowany technicznie od 1908 roku w procesie Ostwalda . To jest katalizator utleniania z amoniakiem . Mieszanina amoniak-powietrze przepuszczana jest szybko (czas kontaktu 1/1000 s) przez gorące sieci platynowo - rodowe ( katalizator ). W temperaturze 800°C powstaje tlenek azotu , który po schłodzeniu reaguje z nadmiarem tlenu, tworząc dwutlenek azotu, a następnie w wieżach ociekowych z wodą, tworząc około 60% kwasu azotowego. 60% kwas azotowy można zatężyć przez destylację do 68%, co odpowiada azeotropowi o maksymalnej temperaturze wrzenia (122 ° C). Wyższe stężenia można osiągnąć przez rektyfikację (odwodnienie) kwasem siarkowym (H 2 SO 4 ) lub wodnym roztworem azotanu magnezu (Mg (NO 3 ) 2 ) lub traktując czterotlenek azotu (N 2 O 4 ) stechiometrycznie wymaganą ilością tlen (lub powietrze) i woda.
W skali laboratoryjnej kwas azotowy można wytwarzać w reakcji stężonego kwasu siarkowego z azotanami . Przed 1908 kwas azotowy otrzymywano w tym procesie przy użyciu azotanu sodu ( azotan Chile ).
Często występujące zanieczyszczenia kwasu halogenami lub halogenowodorami można usunąć przez dodanie azotanu srebra i późniejszą destylację. Bezwodny kwas azotowy otrzymuje się, wychodząc z kwasu o wysokim stężeniu przez destylację, przepuszczenie przez gaz obojętny lub destylację nad pięciotlenkiem fosforu lub oleum .
nieruchomości
Kwas azotowy w stanie czystym jest bezbarwny. Stężony kwas azotowy jednak łatwo się rozkłada (zwłaszcza pod wpływem światła) i często ma żółtawy lub czerwonawy odcień z powodu rozpuszczonego w nim dwutlenku azotu (NO 2 ).
Czysty kwas azotowy, który zawiera wolny dwutlenek azotu, nazywany jest dymiącym kwasem azotowym. Zawiera ponad 90% HNO 3 , ma silne działanie utleniające i może zapalić niektóre wysoce łatwopalne substancje; dlatego kwas azotowy od 70% jest uważany za utleniający . Kwas azotowy, który jest zabarwiony na żółto przez rozpuszczony dwutlenek azotu, może zostać odbarwiony przez niewielką ilość mocznika lub, lepiej, azotanu mocznika .
Kwas azotowy jest zarówno silnym utleniaczem, jak i mocnym kwasem . Pierwiastki niemetaliczne takie jak węgiel , jod , fosfor i siarka są utleniane stężonym kwasem azotowym do ich tlenków lub kwasów okso z wytworzeniem np. dwutlenku azotu
Ponadto wiele związków jest utlenianych kwasem azotowym. Kwas solny utlenia się do chloru i dwutlenku chloru .
Azotany , sole kwasu azotowego, powstają w wyniku reakcji metali lub ich tlenków , wodorotlenków lub węglanów z kwasem azotowym. Większość azotanów jest rozpuszczalna w wodzie, a kwas azotowy jest używany głównie do wytwarzania rozpuszczalnych azotanów metali.
Kwas azotowy reaguje z większością metali, tworząc rozpuszczalne w wodzie azotany. Wyjątkiem są metale szlachetne złoto , platyna i iryd . Również aluminium , tytan , cyrkon , hafn , niob , tantal i wolfram są odporne na pasywację kwasem azotowym . Ponadto w wyniku pasywacji żelazo jest odporne na zimno, a chrom również na gorący kwas azotowy. Na metalu tworzy się ściśle przylegająca, nieprzepuszczalna warstwa tlenku. Ponieważ w ten sposób można było rozdzielić złoto i srebro , nazywano to rozdzielaniem wody . Mieszaniny kwasu azotowego z kwasem solnym ( aqua regia ) lub kwasem selenowym również reagują ze złotem i platyną.
Kolory kwas azotowy białka , które zawierają aromatyczne kwasy aminowe , takie jak L- fenyloalanina i L- tyrozyna żółty przez nitrowanie z pierścieniem benzenowym . Ta reakcja ksantoproteinowa może być wykorzystana do wykrywania aromatycznych aminokwasów i białek.
| % wag. HNO 3 | 0 | 10 | 20. | 30. | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
|---|---|---|---|---|---|---|---|---|---|---|---|
|
Gęstość (g/cm 3 ) |
1,00 | 1,05 | 1.12 | 1,18 | 1,25 | 1.31 | 1,37 | 1,42 | 1,46 | 1,48 | 1,513 |
|
Lepkość (mPas) |
1,00 | 1,04 | 1.14 | 1,32 | 1,55 | 1,82 | 2,02 | 2,02 | 1.84 | 1,47 | 0,88 |
| Temperatura topnienia (°C) | 0 | -7 | -17 | −36 | -30 | -20 | −22 | −41 | −39 | -60 | −42 |
| Bp (°C) | 100,0 | 101,2 | 103,4 | 107,0 | 112,0 | 116,4 | 120,4 | 121,6 | 116,6 | 102,0 | 86,0 |
| p (HNO 3 ) (mbar) | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 | 0,3 | 1.2 | 3,9 | 14,0 | 36,0 | 60,0 |
| s (H 2 O) (mbar) | 23,3 | 22,6 | 20,2 | 17,6 | 14,4 | 10,5 | 6,5 | 3,5 | 1.2 | 0,3 | 0.0 |
| HNO 3 (mol / L) | 1,7 | 3,6 | 5,6 | 7,9 | 10,4 | 13,0 | 15,8 | 18,5 | 21 | 24.01 |
posługiwać się
Kwas azotowy jest jednym z najważniejszych surowców w przemyśle chemicznym. Ona służy:
- do produkcji azotanów i nawozów ,
- jako woda rozdzielająca do separacji ( kwaracji ) złota i srebra (srebro reaguje tworząc rozpuszczalny azotan srebra ),
- w mieszaninach z kwasem solnym jako woda królewska do rozpuszczania złota, a także do złocenia i wykrywania złota,
- do wytrawiania i wypalania metali (technologia graficzna i galwaniczna),
- do nitrowania substancji organicznych przy produkcji barwników , leków , środków odkażających i materiałów wybuchowych takich jak nitrogliceryna czy bawełna pistoletowa ,
- do produkcji celuloidu , nitro lakierów i lakierów zaponowych ,
- do wymiany tłuszczów (rozpuszczalność w wodzie) do celów czyszczących,
- do polerowania metali,
- w paliwach rakietowych jako utleniacze ( WFNA i RFNA ).
dowód
Jak azotany, kwas azotowy może być wykryta w laboratorium stosując do testu dzwonienia i odczynnika Lonża za .
instrukcje bezpieczeństwa
Kwas azotowy działa żrąco na skórę, drogi oddechowe i błony śluzowe. Wdychanie oparów może prowadzić do toksycznego obrzęku płuc . To niebezpieczeństwo powstaje zwłaszcza w przypadku ogrzewania lub stężonego kwasu. W wysokich stężeniach jest silnym środkiem utleniającym i ma działanie przeciwpożarowe. Kwas azotowy reaguje z większością metali tworząc toksyczny dwutlenek azotu . Podczas pracy z kwasem azotowym należy nosić okulary ochronne lub osłonę twarzy, odpowiednie rękawice ochronne i zamknięty płaszcz roboczy. Jeżeli istnieje ryzyko uwolnienia oparów kwasu azotowego lub tlenków azotu do pomieszczenia, należy nosić aparat oddechowy. Z tego powodu kwas azotowy nie nadaje się do czyszczenia w gospodarstwie domowym. Praca w laboratorium odbywa się zawsze w dygestorium. Nakrętka teflonowa jest zalecana do butelek ze stężonym kwasem azotowym.
Zobacz też
- Kwas azotawy (HNO 2 )
linki internetowe
- Szkolne informacje o kwasie azotowym na www.seilnacht.com, nauczanie nauk przyrodniczych .
Indywidualne dowody
- ↑ Wpis dotyczący kwasu azotowego. W: Rompp Online . Georg Thieme Verlag, dostęp 12 listopada 2014 r.
- ↑ b c d e f g h wejście na kwas azotowy w bazie substancji GESTIS o w IFA , do których dostęp 8 stycznia 2021 r. (wymagany JavaScript)
- ↑ CCI ETH: pK s stół
- ↑ Karta katalogowa 100% kwasu azotowego (PDF) firmy Merck , dostęp 23 stycznia 2018 r.
- ↑ Wpis na kwas azotowy ...% w wykazie klasyfikacji i oznakowania w Europejskiej Agencji Chemikaliów (ECHA), dostępne w dniu 24 stycznia 2017. Producenci i dystrybutorzy mogą rozwinąć się zharmonizowanej klasyfikacji i oznakowania .
- ↑ Komitet Hazardous Substances (AGS) o tym Federalny Instytut Bezpieczeństwa i Higieny Pracy (BAuA) : Reguły techniczne dla substancji niebezpiecznych (TRGS) 900 ( PDF ), dostępnych w dniu 10 czerwca 2014 r.
- ↑ Swiss Accident Insurance Fund (Suva): Wartości graniczne - aktualne wartości MAK i BAT (szukaj 7697-37-2 lub kwas azotowy ), dostęp 2 listopada 2015 r.
- ↑ Karta charakterystyki Bernd Kraft z dnia 29 maja 2019 r. PDF , dostęp 20 stycznia 2020 r.
- ↑ Thomas Gleinser: Berneńska „Farmakopea” Anny von Diesbach w wersji Erlacher Daniela von Werdts (1658), Część II: Słownik. (Rozprawa medyczna Würzburg), obecnie w Königshausen & Neumann, Würzburg 1989 (= Badania medyczno-historyczne Würzburga. Tom 46), s. 38.
- ↑ G. Brauer (wyd.), Podręcznik preparatywnej chemii nieorganicznej , wyd. 2, tom. 1, Wydawnictwo Akademickie 1963, s. 491-492.
- ↑ Erwin Riedel , Christoph Janiak : Chemia nieorganiczna. Wydanie ósme. de Gruyter, 2011, ISBN 3-11-022566-2 , s. 458.
- ↑ M. Thiemann, E. Scheibler, KW Wiegand: Kwas azotowy, kwas azotowy i tlenki azotu w Ullmanns Enzyklopädie der Technischen Chemie , Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2005, doi : 10.1002 / 14356007.a17_293 .
- ↑ Thomas Seilnacht: nauczanie nauk przyrodniczych , hasło kwas azotowy oraz Thomas Seilnacht: chemia DVD-ROM , Seilnacht Verlag & Atelier, Bern 2017.








