Hemostaza
Hemostazy (składa się z starożytnego greckiego αἷμα Haima , niemieckim , krwią „ i zastoju w στάσις zastoju , Niemiecki , rozmieszczenia” , hemostazy „stagnacja”, «Stop») jest istotnym procesem w urazach naczyń krwionośnych wynikającej krwawienia przynosi do zatrzymania. Zapobiega to nadmiernemu wyciekowi krwi z krwiobiegu i stwarza warunki do gojenia się ran . W przypadku urazu hemostaza musi rozpocząć się wystarczająco szybko, aby uniknąć znacznej utraty krwi. Musi być ograniczona do obszaru urazu i nie może być błędnie wywołana przez inne zdarzenia, takie jak stan zapalny lub infekcja .
Hemostazę można podzielić na dwa podprocesy, które jednak wzajemnie na siebie oddziałują. W hemostazie pierwotnej (także komórkowej) zaangażowana jest hemostaza (fizjologiczna ), płytki krwi ( trombocyty ), komórki ściany zajętego naczynia krwionośnego ( komórki śródbłonka i mięśni gładkich ), a także tkanki poza naczyniem. Mówiąc prościej, naczynie najpierw się zwęża, a następnie płytki krwi przylegają do przecieku, sklejają się i tworzą w ten sposób pierwsze zamknięcie rany. We wtórnej (także: plazmatycznej) hemostazie, krzepnięciu krwi , to wciąż luźne zamknięcie jest wzmacniane tworzeniem się włókien fibrynowych . Ważną rolę odgrywa tu aktywacja kilkunastu czynników krzepnięcia zawartych w osoczu krwi . Defekt genetyczny czynników krzepnięcia może prowadzić do chorób takich jak hemofilia (choroba krwi ). Początek gojenia ran jest inicjowany przez czynniki wzrostu uwalniane przez płytki krwi i komórki śródbłonka. Pod koniec procesu gojenia się rany fibryna jest rozpuszczana przez układ fibrynolityczny osocza krwi.
Hemostaza, składająca się z dwóch elementów, hemostazy pierwotnej i wtórnej, jest często określana jako hemostaza.
Pod nadkrzepliwością oznacza zwiększoną aktywność krzepnięcia. Hemostaza jest badanie hemostazy. Przez koagulopatię lub zaburzenie krzepnięcia krwi rozumie się patologicznie zmienioną hemostazę.
W tym artykule opisano hemostazę u ludzi. Większość stwierdzeń odnosi się również do innych ssaków , ale tylko w ograniczonym zakresie do innych klas zwierząt .
Procesy fizjologiczne po urazie naczyniowym
Po uszkodzeniu mniejszych naczyń krwawienie zwykle szybko ustaje. Odpowiedzialna za to hemostaza może być postrzegana jako sekwencja następujących procesów. Ten podział służy przede wszystkim ułatwieniu zrozumienia. Między procesami istnieją ścisłe zależności funkcjonalne i czasowe, nie jest możliwe wyraźne rozgraniczenie.
- Spontaniczna hemostaza tętnicza
- Tętnice ( tętnice ) typu mięśniowego mają właściwość "einzukrempeln" po samo przecięciu. Ta właściwość wynika z budowy ścian tętnic: elastyczna wewnętrzna skóra tętnicy (wewnętrzna membrana elastica) kurczy się bardziej niż inne warstwy ściany po jej odcięciu. W rezultacie wolny brzeg odciętej tętnicy zostaje wciągnięty do wnętrza naczynia, co zapewnia bardzo szybkie, tymczasowe zamknięcie.
- Hemostaza komórkowa
- Polega na przyczepianiu (adhezji) i sklejaniu (agregacji) płytek krwi, aktywacji kolejnych płytek i powstawaniu okluzyjnego, białego skrzepliny płytkowej. Dodatkowo uwalnianie substancji powoduje skurcz naczyń, czyli zwężenie naczyń krwionośnych. Zmniejszy to przepływ krwi, a tym samym zminimalizuje utratę krwi.
- Hemostaza osocza
- Składniki osocza krwi tworzą siatkę mechanicznie stabilnych nitek fibrynowych, w które zostają wyłapane krążące krwinki czerwone (erytrocyty) i na końcu tworzy się czerwony skrzeplina, który ostatecznie zestala się i kurczy.
Hemostaza komórkowa
Krew człowieka zwykle zawiera od 150 000 do 400 000 płytek krwi na mikrolitr . Błona komórkowa płytek krwi zawiera liczne glikoproteiny i receptory, które odgrywają ważną rolę w hemostazie komórkowej.
Wewnętrzna warstwa komórek naczyń krwionośnych nazywana jest śródbłonkiem . Jest on pokryty od wewnątrz glikokaliksem , rodzajem warstwy śluzu, dla której płytki krwi nie mają receptorów. Między innymi z tego powodu płytki krwi pozostają nieaktywne w nieuszkodzonych naczyniach i nie mogą przyczepiać się do ścian naczynia. Aktywacji przeciwdziałają też różne czynniki, np. prostacyklina i tlenek azotu oraz heparyna , którą tworzą m.in. mastocyty i której hamujący wpływ na hemostazę można stosować terapeutycznie .
Adhezja i aktywacja płytek krwi
Kiedy naczynie jest uszkodzone, krew wchodzi w kontakt z otaczającą tkanką łączną, w tym z włóknami kolagenowymi. Kolagen to białko strukturalne obecne niemal wszędzie w przestrzeni pozakomórkowej . Płytki krwi najpierw przylegają do tych włókien ( adhezja płytek ), co prowadzi do powstania cienkiego pokrycia rany. Adhezję (kleistość) wytwarza się przez czynnik von Willebranda pośredniczy (vWF), rozpuszczalnego białka krwi z komórkami śródbłonka i megakariocytów powstaje. Wraz z fibronektyną i lamininą tworzy połączenie między włóknami kolagenu a receptorem na płytkach krwi (GP Ib/V/IX). Wada czynnika von Willebranda prowadzi do zespołu Willebranda-Jürgensa .
Adhezja wyzwala aktywację płytek krwi: uwalniają jony wapnia , ADP , serotoninę , tromboksan A 2 i inne substancje z tak zwanych „gęstych elektronowo granulek” . To przyciąga więcej płytek krwi ( chemotaksja ). Tromboksan A 2 znacząco przyczynia się również do zwężenia naczyń krwionośnych, co przeciwdziała wysokiemu przepływowi krwi. Z płytek krwi uwalniana jest również zawartość tak zwanych „α-granulek”: czynniki krzepnięcia (czynnik V, czynnik VIII), substancje adhezyjne (vWF, fibronektyna, trombospondyna) oraz czynniki wzrostu . Poprzez aktywację różnych szlaków metabolicznych , takich jak substancje tromboksanu A 2 i PAF (czynnik aktywujący płytki krwi), są w coraz większym stopniu osad. Niektóre z tych substancji wywołują koagulację plazmatyczną.
Agregacja płytek

Agregacji aktywowanych płytek krwi sprzyja reorganizacja cytoszkieletu , co powoduje wielokrotne powiększenie powierzchni komórki. O ile płytki krwi są nieaktywne, soczewkowate , o tyle gdy są aktywne, przybierają kulisty kształt i niosą długie pseudopodia ( pseupodia ), za pomocą których mogą się zaczepiać – płytki stają się „kłujące” i „lepkie”. Zagregowane płytki ostatecznie tworzą czop płytkowy znany jako biały zakrzep. To kończy hemostazę komórkową. Zwykle proces trwa od jednej do czterech minut, czas ten nazywany jest czasem krwawienia .
Biały zakrzep nie jest bardzo stabilny i można go zmyć. Hemostaza osocza tworzy ściślejsze uszczelnienie .
Hemostaza osocza
Hemostaza osocza tworzy siatkę mechanicznie stabilnej fibryny, w której wychwytywane są nie tylko trombocyty, ale także czerwone krwinki ( erytrocyty ), co jest określane jako „czerwony zakrzep”.
Aktywowane płytki krwi posiadają na błonie komórkowej kompleks receptorowy (glikoproteina IIb/IIIa), z którym wiąże się fibrynogen z osocza i kleje uwalniane z aktywowanych płytek (fibronektyna, trombospondyna). Mechanizmy sprzężenia zwrotnego uwalnianych substancji ostatecznie prowadzą do nieodwracalnej agregacji, w której błony komórkowe płytek krwi łączą się ze sobą.
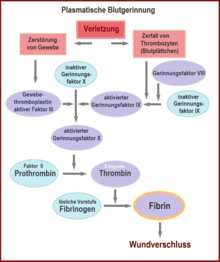
Ta wtórna hemostaza, krzepnięcie krwi, jest również znana jako kaskada krzepnięcia. Podzielony jest na trzy fazy: fazę aktywacji, koagulacji i retrakcji.
Faza aktywacji
Kiedy płytki krwi wchodzą w kontakt z ujemnie naładowanymi powierzchniami, takimi jak szkło, aktywowane są czynniki XII i XI, które wprawiają w ruch kaskadę krzepnięcia ( układ wewnętrzny , patrz rysunek). Jeśli czynnik XII nie jest wytwarzany u osobnika, nie powoduje to istotnych zaburzeń krzepnięcia, w przeciwieństwie do niedoboru czynników VIII, IX i XI, co prowadzi do hemofilii A, B i C.
Normalny proces fizjologiczny ( układ zewnętrzny lub mechanizm egzogenny) jest inicjowany przez kontakt krwi z tromboplastyną tkankową z uszkodzonej tkanki podśródbłonkowej. Czynnik tkankowy (również czynnik tkankowy (TF), tromboplastyna tkankowa czy czynnik III) to białko błonowe, które np. w przydance występuje w naczyniach krwionośnych – przez komórki śródbłonka jest uwalniane dopiero po aktywacji. Tworzy kompleks z czynnikiem VII, który przekształca się w jego aktywną formę. W rezultacie powstaje pewna ilość trombiny , ale proces ten jest stosunkowo szybko hamowany przez TFPI (inhibitor szlaku czynnika tkankowego). Gdy utworzy się wystarczająca ilość trombiny, aktywowany jest tak zwany kompleks aktywatorowy czynników IX i VIII (patrz IXa i VIIIa na Figurze). Ten kompleks z kolei aktywuje czynnik X.
Brak czynników VIII lub IX prowadzi do hemofilii, hemofilii: kaskada zostaje przerwana, a krzepnięcie nie jest nasilone. Pacjenci mogą wykrwawić się na śmierć z powodu najmniejszych obrażeń wewnętrznych.
Dzięki obu mechanizmom – szlakowi wewnętrznemu i zewnętrznemu – czynnik X jest ostatecznie aktywowany do czynnika Xa. To z kolei powoduje rozszczepienie protrombiny (czynnik II), w wyniku czego powstaje trombina (czynnik IIa). Ta reakcja na błonie płytkowej zachodzi tylko w obecności wapnia i jest silnie przyspieszana przez dodatnie sprzężenie zwrotne z kompleksem czynników VIII i IX. Faza aktywacji kończy się wytworzeniem enzymatycznie aktywnej trombiny.
Fazy koagulacji i retrakcji
Enzymatycznie aktywnego trombiny jest odpowiedzialna za polimeryzacji z fibryną , a tym samym tworzenie się czerwonego skrzepliny: w fazie krzepnięcia, to dzieli się jednostek o niskiej masie cząsteczkowej ( monomerów ) z nieaktywnego prekursora, fibrynogenu (czynnik I) , które są niekowalencyjnie połączone w celu wytworzenia fibryny polimerowej. Ostatecznie, poprzez działanie czynnika XIII, powstają wiązania kowalencyjne pomiędzy monomerami i skrzeplina jest stabilizowana. Fibryna łączy już połączone ze sobą trombocyty, wzmacniając w ten sposób zamknięcie rany. Czerwone krwinki zostają uwięzione w sieci, powstaje tak zwany czerwony skrzeplina. Trombina powoduje również kurczenie się szkieletu aktynowo-miozyny w obrębie płytek krwi: kurczące się płytki krwi ściągają razem sieć fibryny, a tym samym brzegi rany i mechanicznie zamykają ranę. Skurcz - wspomagany przez PDGF ( płytkowy czynnik wzrostu ) - sprzyja również penetracji komórek tkanki łącznej: rozpoczyna się gojenie ran.
Nowy model krzepnięcia oparty na komórkach
Klasyczny model krzepnięcia rozróżnia aktywację wewnątrzpochodną i zewnątrzpochodną i tym samym opisuje wieloetapową sekwencję aktywacji białek w osoczu bezkomórkowym. Temu pomysłowi odpowiadają klasyczne testy krzepnięcia aPTT i PT. Model ten nie nadaje się do opisu krzepnięcia krwi w uszkodzonych naczyniach krwionośnych w organizmie, dlatego w 2001 roku powstał model krzepnięcia oparty na komórkach, który opisuje trzy nakładające się fazy:
inicjacja
W wyniku uszkodzenia tkanki komórki znajdujące się poza naczyniem krwionośnym wchodzą w kontakt z krwią pod śródbłonkiem naczyniowym. Komórki znajdujące się teraz otwarte w krwiobiegu niosą czynnik tkankowy (III) na swojej powierzchni (komórka niosąca czynnik tkankowy (III)). Kompleks czynnika tkankowego (III) i prokonwertyny (VII) katalizuje teraz aktywację trombokinazy (X), która początkowo może aktywować tylko niewielkie ilości trombiny (II). Jednak ta niewielka ilość trombiny (II) jest wystarczająca do aktywacji płytek krwi i czynników krzepnięcia proakceleryny (V) i prokonwertyny (VII), a tym samym wywołania amplifikacji tworzenia trombiny. Ta pierwsza faza ma miejsce w niewielkiej przestrzeni na urazie podśródbłonkowym.
Wzmocnienie
Proakceleryna (V) aktywowana w fazie inicjacji tworzy kompleks protrombinazy (X, V) z trombokinazą (X), która może w większym stopniu aktywować trombinę (II). Faza amplifikacji, podczas której płytki krwi przylegają do struktur podśródbłonkowych (adhezja), nakłada się w czasie. Dzieje się to za pośrednictwem receptorów GPVI, które wiążą się z kolagenem, oraz receptora GPIb/IX, który wiąże się z czynnikiem Von Willebranda. Kompleks von Willebranda uwalnia związany czynnik VIII, który wiąże się w formie aktywnej z powierzchnią płytek krwi. Ponadto płytka krwi wylewa swoje wewnętrzne zapasy, które między innymi zawierają również proakcelerin (V). Czynnik tkankowy (III) i prokonwertyna (VII) nie tylko aktywują trombokinazę (X), ale także proteazę serynową (IX). Pierwsze niewielkie ilości trombiny (II) aktywują nie tylko fibrynę (I), ale także czynnik (VIII). Kompleks tenazy utworzony z VIII i IX z kolei aktywuje trombokinazę (X), tak że tworzy się samowzmacniająca pętla. Ten ważny krok jest również znany jako pętla Josso. Obecnie na powierzchni uszkodzenia podśródbłonkowego i na powierzchni przylegających do niego trombocytów znajdują się liczne czynniki krzepnięcia w wysokim stężeniu, które są chronione przed białkami antykoagulacyjnymi w wolnej krwi.

Propagacja
Czynniki gromadzone na powierzchni płytek tworzą kompleksy tenazowe (VIII, IX), które wspomagają tworzenie kompleksu protrombinazy (X, V). Trombokinaza (X) aktywuje teraz duże ilości trombiny (II) (wyrzut trombiny). Trombina (II) ostatecznie tworzy sieci fibryny, w których płytki krwi wiążą się ze swoimi receptorami GPIIb / IIIa. Czynnik XIII stabilizuje te sieci poprzez dodatkowe połączenia krzyżowe fibryny.
Kontrola niepożądanego rozprzestrzeniania się skrzepu
Aby zapobiec tworzeniu się skrzepu poza uszkodzeniem śródbłonka (zakrzepicą), śródbłonek i swobodnie płynąca krew mają różne mechanizmy: Rozpuszczanie trombiny (II) jest szybko dezaktywowane w krwiobiegu przez antykoagulacyjne białko antytrombinę. Rozpuszczająca się trombokinaza (X) i prokonwertyna (VII) są wiązane przez TFPI. Na powierzchni śródbłonka znajduje się trombomodulina (TM), która wiąże trombinę (II), tak że nie może już tworzyć fibryny (I). Jednocześnie tworzenie białka C (APC) przez związaną trombinę (II) jest tysiąckrotnie, tak że trombina ma teraz działanie przeciwzakrzepowe. Białko C (APC) tworzy następnie kompleks z białkiem S, które dezaktywuje czynniki krzepnięcia V i VIII. Śródbłonek zawiera również ADPazy związane z błoną, które rozkładają ADP, a tym samym obniżają czynność płytek.
Przejście do gojenia się ran
Po hemostazie plazmatycznej rana goi się, gdy komórki tworzące tkankę łączną ( fibroblasty ) wrastają w skrzeplinę i przekształcają ją w tkankę łączną. Uszkodzone komórki umierają i ulegają rozkładowi. Białko zwane plazminą jest przede wszystkim odpowiedzialne za rozkład skrzepliny , która również powstaje z nieaktywnego prekursora (plazminogenu) przez złożone mechanizmy regulowane. Plazmina rozpuszcza wiązania kowalencyjne między włóknami fibryny, a tym samym sieć utrzymującą skrzeplinę na miejscu.
Istnieje zrównoważona równowaga między układami krzepnięcia krwi a układem fibrynolizy , który rozpuszcza czerwony skrzeplinę w układzie naczyniowym. Niewielkie zaburzenia tej równowagi mogą prowadzić do poważnego krwawienia lub tworzenia skrzeplin w miejscach, w których nie ma urazu (patrz również Zakrzepica ).
Przegląd czynników krzepnięcia i inhibitorów
Oprócz jonów wapnia (czynnik IV) czynnikami krzepnięcia są białka. Każdemu czynnikowi przypisana jest liczba rzymska. Małe a po liczbie oznacza, że jest w aktywnej formie. Ze względów historycznych (patrz pod historia badań ) numer VI nie jest (już) przypisany, odpowiedni czynnik jest identyczny z Va.
| numer | Nazwy) | Funkcje | Zespoły niedoboru |
|---|---|---|---|
| I. | Fibrynogen | Cząsteczka prekursorowa do tworzenia sieci fibryny. | Afibrynogenemia ( koagulopatia wrodzona lub konsumpcyjna ) |
| II | Protrombina | Aktywna forma trombiny (IIa) aktywuje czynniki I, V, VIII, XI i XIII. | Hipoprotrombinemia (wrodzona, niedobór witaminy K lub koagulopatia konsumpcyjna ) |
| III | Czynnik tkankowy, tromboplastyna tkankowa, czynnik tkankowy (TF) | Jedyny nie we krwi, ale w tkance podśródbłonkowej.
TF i VIIa tworzą zewnętrzną tenazę z Ca2 + , która aktywuje X. |
|
| IV | Wapń | Wiele czynników wymaga kationu wapnia Ca2 + , aby związać się z ujemnie naładowanymi fosfolipidami błon plazmatycznych. | Niedobór wapnia |
| V | Proakcelerina | Va i Xa tworzą kompleks protrombinazy z Ca2 + i fosfolipidami , który aktywuje II. | Parahemofilia (wrodzona) |
| VI | odpowiada współczynnikowi Va | ||
| VII | Proconvertin | VIIa i TF tworzą zewnętrzną tenazę z Ca2 + , która aktywuje X. | Hipoprokonwertynemia (wrodzony niedobór witaminy K) |
| VIII | Globulina przeciwhemofilowa A. | VIIIa i IXa tworzą wewnętrzną tenazę z Ca2 + i fosfolipidami , która aktywuje X. | Hemofilia A (wrodzone, recesywne dziedziczenie sprzężone z chromosomem X) |
| IX | Czynnik bożonarodzeniowy , antyhemofilna globulina B | VIIIa i IXa tworzą wewnętrzną tenazę z Ca2 + i fosfolipidami , która aktywuje X. | Hemofilia B (wrodzone, recesywne dziedziczenie sprzężone z chromosomem X) |
| x | Współczynnik Stuarta Prowera | Va i Xa tworzą kompleks protrombinazy z Ca2 + i fosfolipidami , który aktywuje II. | Niedobór czynnika X (wrodzony) |
| XI | Czynnik Rosenthala , poprzednik tromboplazminy w osoczu (PTA) | XIa aktywowany IX. | Hemofilia C (wrodzona) lub niedobór PTA w koagulopatii konsumpcyjnej |
| XII | Współczynnik Hagemana | XIIa aktywowany XI. | Zespół Hagemana częściej prowadzi do zaburzeń fibrynolizy ( koagulopatia wrodzona lub konsumpcyjna ) |
| XIII | Czynnik stabilizujący fibrynę | XIIIa przekształca monomery fibryny w usieciowaną fibrynę. | Niedobór czynnika XIII |
Aby uniknąć krzepnięcia przy braku urazu, osocze krwi zawiera różne substancje hamujące ( inhibitory ). Inhibitory proteazy hamują tworzenie fibryny. Antytrombina hamuje kilka proteaz krzepnięcia w fazie aktywacji i fazie krzepnięcia. Działanie hamujące jest znacznie wzmocnione przez jej kofaktor, heparynę . Heparyna jest produkowana przez komórki śródbłonka i komórki tuczne . Trombomodulina , która również pochodzi ze śródbłonka, wiąże się z trombiną i aktywuje białko C , które po związaniu z białkiem S inaktywuje kofaktory Va i VIIIa.
Historia badań
Do 1772 r. panowała idea Arystotelesa, że koagulację krwi należy porównać z zamrażaniem płynów.
Pierwsze teorie hemostazy interpretowały skoagulowaną krew na tle patologii humoralnej jako „ czarną żółć ”. Badanie mechanizmów fizjologicznych rozpoczęło się w XVII wieku. W 1772 roku William Hewson wykazał , że we krwi znajduje się limfa odpowiedzialna za krzepnięcie. W XVIII w. ponownie zwyciężyła opinia, że gdy dochodzi do krzepnięcia krwi, ruch krwi zostaje zatrzymany, a gdy zawieszone cząstki osadzają się, pojawia się wrażenie krzepnięcia krwi. W 1821 r. Jean Louis Prévost i Jean Baptiste André Dumas dokonali przełomu w badaniach: koagulacja to połączenie krwinek i fibryny. Johannes Müller ustalił, że fibryna musi być rozpuszczona we krwi, Rudolf Virchow był w stanie dostarczyć dalszych wyjaśnień w 1856 roku, kiedy natknął się na prekursor fibryny, który nazwał fibrynogenem. 1830-1859 Prosper Sylvain Denis de Commercy (1799-1863) przeprowadził kilka badań, w których odkrył między innymi niestabilność skrzepu. Udało mu się również wytrącić serofibrynę z osocza, którą nazwał plazminą.
Alexander Schmidt (1831-1894) zaproponował w 1876 roku teorię krzepnięcia, opartą na oddziałujących białkach. Opisał też rolę wapnia. Przez długi czas dyskutowano o tym, jakie substancje są naprawdę potrzebne do koagulacji i czy ważniejsza jest faza komórkowa czy plazmatyczna.
Olof Hammarsten (1841-1932) i Léon Fredericq (1851-1939) wykazali w 1875 roku, że ferment fibrynowy i fibrynogen to jedyne substancje zatrzymujące krwawienie i że nie jest to substancja fibrynoplastyczna. Schmidt kontynuował badania nad tym fermentem i nazwał go trombiną. Postawił też tezę, że w osoczu musi być protrombina.
W 1904 roku Paul Morawitz opisał system prawie tak, jak jest znany dzisiaj. Ukuł termin koagulacja plazmowa i opisał następujące dwie fazy:
Molekularne mechanizmy krzepnięcia krwi zostały w dużej mierze odkryte w XX wieku. Pierwszą oznaką złożoności mechanizmów krzepnięcia krwi było odkrycie w 1947 r. przez Paula Owrena (1905–1990) proakceleryny, którą nazwano czynnikiem V. Pełna sekwencja aminokwasowa została opublikowana w 1987 roku przez Jenny et al. wydany. Owren już podejrzewał, że ten czynnik wytwarza akcelerinę, którą nazwał czynnikiem VI. Później okazuje się, że czynnik V jest nieaktywnym prekursorem czynnika VI. Dlatego czynnik VI jest teraz określany jako czynnik Va.
Czynnik IX odkryto w 1952 roku w wyniku choroby młodego pacjenta z hemofilią typu B o nazwisku Stephen Christmas, u którego brak tego czynnika spowodował chorobę. Dlatego nazywa się to czynnikiem świątecznym. Wiele innych czynników odkryto również w latach 50. XX wieku i często nazywa się je imionami pacjentów, u których zostały znalezione. Szczegóły tych odkryć są opisane w artykułach dla odpowiednich czynników.
Dopiero niedawno odkryto, że szlak wewnętrzny nie odgrywa roli fizjologicznej, to znaczy, że można go zaobserwować in vitro, ale nie in vivo .
Znaczenie kliniczne
Leczniczy antykoagulant
Przed, w trakcie i po operacji, a także w przypadku przykucia do łóżka z innych powodów, w celu zapobiegania zakrzepicy i zatorowości płucnej często stosuje się tymczasowe leki przeciwzakrzepowe (często błędnie określane jako leki rozrzedzające krew) . Takie podejście nazywa się profilaktyką zakrzepicy .
Obecnie najczęstszą przyczyną długotrwałego leczenia przeciwzakrzepowego jest migotanie lub trzepotanie przedsionków. W przypadku tej arytmii serca istnieje zwiększone ryzyko zatorowości, które u wielu pacjentów należy zmniejszyć stosując leki przeciwzakrzepowe. Drugim najczęstszym powodem jest zakrzepica, głównie żył nóg. Tutaj antykoagulacja w ostrej fazie ma na celu zapobieganie dalszemu rozszerzaniu się zakrzepicy i późniejszemu nawrotowi (nawrotowi).
Heparyna
Do hamowania koagulacji in vivo przez leki można stosować heparynę i heparynoidy. Jest to niezwykle silnie naładowany ujemnie łańcuch cukrów, który przyłącza się do wspomnianego wyżej białka antytrombiny . Kompleks ten teraz skuteczniej wiąże czynniki trombinę i Xa, które w ten sposób zostają przezwyciężone: kaskada krzepnięcia zostaje zatrzymana. Efekt zaczyna się natychmiast po podaniu dożylnym. Heparyna do użytku leczniczego jest zwykle pozyskiwana z tkanek zwierzęcych.
Kumaryny
Inną możliwością są tak zwani antagoniści witaminy K , tacy jak pochodne kumaryny fenprokumon i warfaryna . Witamina K jest niezbędna jako koenzym do syntezy większości czynników krzepnięcia . Kumaryna działa w wątrobie i zapobiega redukcji witaminy K ( filochinon ). Bierze on udział w γ- karboksylacji czynników krzepnięcia (II, VII, IX, X) i sam ulega utlenieniu (uwalnianie elektronów ). Bez późniejszej redukcji (wychwytu elektronów) witamina K pozostaje bez funkcji. Efekt pojawia się dopiero po pewnym czasie, ale można go podawać doustnie.
Leki przeciwpłytkowe
Kwas acetylosalicylowy może interweniować w agregację płytek krwi, czyli hemostazę komórkową. Cyklooksygenazy (COX), która jest wymagana do syntezy czynnika płytkowego tromboksanu 2 , umocowany jest hamowana przez przyłączenie się kwasu octowego, pozostałość. Klopidogrel działa również na agregację płytek krwi poprzez hamowanie zależnej od ADP aktywacji płytek krwi poprzez nieodwracalną blokadę receptorów. Abciximab jest rekombinowanym przeciwciałem monoklonalnym, które blokuje glikoproteinę IIb/IIIa płytek krwi, a tym samym zapobiega również agregacji płytek. Tym samym miejscem ataku jest Tirofiban .
Fibrynolityki
Fibrynolityki aktywują plazminogen iw ten sposób sprzyjają rozpuszczaniu zakrzepów ( tromboliza ). Stosuje się go w leczeniu zawałów serca , zatorowości płucnej , zakrzepicy żył kończyn dolnych , obwodowych chorób okluzyjnych oraz, w ciągu czterech godzin, również w ostrych zawałach mózgu . Podczas gdy substancje czynne, takie jak streptokinaza i urokinaza, mają niespecyficzny wpływ zarówno na fibrynogen, jak i fibrynę, nowsze substancje, takie jak alteplaza ( rekombinowany aktywator plazminogenu typu tkankowego , rt-PA) wykazują selektywność względem usieciowanej fibryny w zakrzepie, co jest zamierzone. w celu zmniejszenia ogólnoustrojowych działań niepożądanych, zwłaszcza krwawienia . Stosowanie fibrynolityków podlega ścisłym wskazaniom.
Hamowanie in vitro
In vitro , m.in. B. w probówkach często stosuje się EDTA i cytrynian , chelatory, które tworzą kompleks z kationami wapnia niezbędnymi do koagulacji. Antykoagulacja heparyną jest również możliwa in vitro. Wybór antykoagulantu opiera się na tym, które badanie jest planowane później z krwią, która została niekoagulowana. Do badania samej koagulacji cytrynian stosuje się prawie wyłącznie jako antykoagulant, rozcieńczając próbkę krwi w stosunku 9 + 1 3,8% roztworem cytrynianu sodu. Z reguły używa się do tego probówek prefabrykowanych przemysłowo, które zawierają już 0,3 ml roztworu cytrynianu sodu, a następnie są wypełnione 2,7 ml krwi. Ze względu na wiarygodność wyników analiz ważne jest dokładne przestrzeganie tego stosunku mieszania oraz staranne wymieszanie próbki krwi z roztworem cytrynianu sodu natychmiast po pobraniu.
Wzmocnienie hemostazy lekiem
Sensowne jest chcieć wpłynąć na hemostazę w przeciwnym kierunku, aw przypadku krwawienia zagrażającego życiu podawać leki, które prowadzą do zwiększonej hemostazy. W przeszłości rozwój takich leków, zwanych technicznie hemostyptykami , był mniej udany niż w przypadku leków hamujących hemostazę.
Ważnym elementem leczenia medycznego stały się preparaty, które leczą dziedziczny lub nabyty niedobór czynników krzepnięcia, np. koncentrat czynnika VIII na hemofilię A, witaminę K i PPSB na krwawienie w terapii kumaryną czy mrożone świeże osocze do rozsianego wykrzepiania śródnaczyniowego . W przypadku wyraźnego niedoboru płytek krwi można je zastąpić w postaci koncentratów płytek krwi . Działanie heparyny może zostać zniesione przez protaminę .
Ponadto hemostazę można zwiększyć poprzez hamowanie naturalnego antagonisty krzepnięcia, fibrynolizy. Leki o tym mechanizmie działania nazywane są lekami przeciwfibrynolitycznymi . Składniki aktywne stosuje się kwas traneksamowy , p- kwas aminometylobenzoesowy i kwas ε-aminokapronowy , uprzednio częściej stosowane aprotyniny został wycofany z rynku w listopadzie 2007 roku z powodu zwiększonej śmiertelności w okresie leczenia.
Alkohol butylowy w preparacie hemostypowym Revici okazał się nieodpowiedni, ponieważ jego działanie mieściło się w zakresie spekulacji .
Testy krzepnięcia
Pomiar krzepliwości krwi (koagulacja, koagulacja, koagulacja) nazywa się koagulometrią , odpowiednie urządzenia nazywane są koagulometrami. Wynikiem pomiaru krzepnięcia krwi jest stan krzepnięcia ( koagulogram ).
| Skr. | opis | jednostka | Wartość standardowa | materiał | Aktywator | Monitorowanie |
|---|---|---|---|---|---|---|
| TPZ, PT | Czas tromboplastyny, czas protrombinowy | sekundy | 11-16 | Osocze cytrynianowe po odwirowaniu | Trombokinaza tkankowa = czynnik tkankowy = tromboplastyna = czynnik III | Rozpoczęcie zewnętrznego układu krzepnięcia, terapia antagonistami witaminy K |
| Szybki | odpowiada TPZ, PT w porównaniu do standardowej plazmy | procent | 70-125% | Osocze cytrynianowe po odwirowaniu | patrz wyżej | patrz wyżej |
| INR | odpowiada standaryzowanemu TPZ, PT w porównaniu do standardowej plazmy | 0,8 - 1,2 | Osocze cytrynianowe po odwirowaniu | patrz wyżej | patrz wyżej | |
| aPTT | (aktywowany) Czas częściowej tromboplastyny | sekundy | 20-38 | Osocze cytrynianowe po odwirowaniu | Fosfolipidy (również przestarzałe: częściowa tromboplastyna lub czynnik płytkowy 3, bezbiałkowy ekstrakt fosfolipidowy) oraz substancja powierzchniowo czynna (np. kaolin) | Czas wystąpienia wewnętrznego układu krzepnięcia, terapia heparyną |
| DZIAŁAĆ | Czas aktywowanej koagulacji, czas krzepnięcia kaolinu | sekundy | 100-130 | Krew pełna | substancja powierzchniowo czynna (np. kaolin) | Początek czasu samoistnego układu krzepnięcia, terapia heparyną, możliwy pomiar blisko pacjenta z krwi pełnej. B. z HLM lub ECMO |
| PTZ, TZ | Czas trombinowy w osoczu, czas trombinowy | sekundy | 20-38 | Osocze cytrynianowe po odwirowaniu | trombina | Początek wspólnego odcinka końcowego układu krzepnięcia, terapia heparyną |
| Multiplate® ASPI | komercyjna agregometria impedancji płytek krwi | Obszar pod krzywą | > 40 | Hirudin pełna krew | Kwas arachidonowy (jako substrat dla COX do produkcji tromboksanu A2) | Czynność płytek krwi, inhibitory COX: ASA (np. aspiryna), NLPZ |
| Multiplate® ADP | komercyjna agregometria impedancji płytek krwi | Obszar pod krzywą | > 40 | Hirudin pełna krew | ADP | Czynność płytek krwi, antagoniści receptora ADP: klopidogrel, prasugrel |
| Pułapka Multiplate® | komercyjna agregometria impedancji płytek krwi | Obszar pod krzywą | > 40 | Hirudin pełna krew | Peptyd aktywujący receptor trombiny (TRAP-6) | Czynność płytek krwi, antagoniści glikoproteiny IIb/IIIa, mechaniczny defekt płytek |
| ROTEM® EXTEM | komercyjna trombelastometria
CT = czas krzepnięcia CFT = czas tworzenia skrzepu MCF = maksymalna jędrność skrzepu ML = maksymalna liza |
Cytrytowana krew pełna | Trombokinaza tkankowa = czynnik tkankowy = tromboplastyna = czynnik III | Czas początku zewnętrznego układu krzepnięcia, siła skrzepu, czas utrzymywania się skrzepu, terapia antagonistami witaminy K | ||
| ROTEMU®
WNĘTRZE |
patrz wyżej | Cytrytowana krew pełna | Częściowy fosfolipid tromboplastyny z mózgu królika | Czas początku wewnętrznego układu krzepnięcia, siła skrzepu, czas utrzymywania się skrzepu, terapia heparyną | ||
| ROTEM® HEPTEM | patrz wyżej | Cytrytowana krew pełna | Częściowy fosfolipid tromboplastyny z mózgu królika
+ Heparynaza, aby zakończyć efekt heparyny |
Czas początku wewnętrznego układu krzepnięcia, siła skrzepu, czas utrzymywania się skrzepu,
po usunięciu efektu heparyny |
||
| ROTEM® FIBTEM | patrz wyżej | Cytrytowana krew pełna | Trombokinaza tkankowa = czynnik tkankowy = tromboplastyna = czynnik III
+ Cytochalazyna D do hamowania płytek krwi |
c. czas początku zewnętrznego układu krzepnięcia, siła skrzepu, czas utrzymywania się skrzepu BEZ efektu płytek H. efekt izolowanego fibrynogenu jest ewidentny | ||
| ROTEMU®
APTEM |
patrz wyżej | Cytrytowana krew pełna | Trombokinaza tkankowa = czynnik tkankowy = tromboplastyna = czynnik III
+ Aprotynina hamująca hiperfibrynolizę |
szczególnie trwałość skrzepów, która jest skrócona przez hiperfibrynolizę |
Medyczna diagnostyka laboratoryjna służy do pomiaru krzepliwości krwi
- Krótki wartość do selektywnego ustalania funkcji systemu poprzez dodanie egzogennego czynnika tkankowego i Ca 2+ do próbki krwi, a następnie oznaczania czasu krzepnięcia w porównaniu do normalnej krwi, na przykład w terapii kumaryny, jak również INR (International Znormalizowany współczynnik) wywodzący się z niego, który odpowiada Szybkiemu testowi jest coraz częściej zastępowany. INR zapewnia lepszą porównywalność między różnymi laboratoriami niż wartość Quick. Jednak obie wartości są prawidłowe w hemofilii.
- PTT (częściowa Thromboplastine czas) dla wybiórczego określania funkcji układu endogennych i wspólnym szlaku koagulacji krwi. W przypadku hemofilii wartość ta przekracza standardową wartość ok. 30 sekund.
Testy te są znane jako globalne testy krzepnięcia. Mogą jedynie wykryć zmniejszoną koagulację (ryzyko krwawienia) i monitorować leczenie lekami przeciwzakrzepowymi, takimi jak Marcumar, ale nie za dużo ( trombofilia ). Ponadto rzadziej stosowanymi testami do pomiaru krzepliwości krwi są czas trombinowy i funkcjonalne oznaczanie fibrynogenu według Claussa.
Stan aktywacji układu krzepnięcia w całym organizmie można określić mierząc D-dimery (produkty rozpadu fibryny). W ten sposób można rozpoznać pewne stany chorobowe, które są obecne w czasie pobierania krwi i są związane z aktywacją krzepnięcia osocza ( zakrzepica , zator tętnicy płucnej , rozsiane wykrzepianie wewnątrznaczyniowe i małopłytkowość wywołana heparyną typu II). Rozróżnienie między różnymi możliwymi przyczynami aktywacji krzepnięcia i wiarygodna ocena przyszłego ryzyka (trombofilia) nie jest możliwe poprzez określenie D-dimerów. Obecnie nie istnieje odpowiedni test do poszukiwania trombofilii, a jeśli istnieje odpowiednie podejrzenie, wszystkie możliwe przyczyny należy wykluczyć indywidualnie.
Ocena wartości Quick i PTT w związku ze skłonnością do krwawień powinna zawsze zawierać szczegółowy wywiad krwawień, liczbę i, jeśli to konieczne, czynność płytek krwi ( trombocytów ). Hemostaza komórkowa jest znacznie trudniejsza do oceny niż osocza. Łatwo i wiarygodnie można określić tylko liczbę płytek krwi, ale nie ich funkcję. Dostarczone w tym celu testy są albo zawodne (czas krwawienia), albo skomplikowane i dlatego nie wszędzie dostępne ( trombelastogram , analizator czynności płytek).
Przed operacjami, nawet u pacjentów, którzy nie przyjmują żadnych leków przeciwzakrzepowych, często przeprowadza się zgrubną ocenę sytuacji krzepnięcia na podstawie tych trzech parametrów (szybkiego, PTT i liczby płytek krwi) w celu zidentyfikowania zaburzeń hemostazy niezwiązanych z lekami. Ta praktyka jest obecnie kontrowersyjna w kręgach eksperckich, gdyż rozpoznaje się tu tylko około 13% zaburzeń hemostazy, a lekarzom stwarza się poczucie fałszywego bezpieczeństwa. Zaburzenia krzepnięcia, które są najczęstsze epidemiologicznie i wpływają na czynność płytek krwi lub czynnik von Willebranda, nie są rejestrowane przez trzy standardowe testy, dlatego zaleca się je tylko w przypadku dodatniego wywiadu krwawienia. Inni autorzy uważają to za zaniedbanie i zalecają rutynowe przedoperacyjne oznaczanie liczby płytek krwi, czasu częściowej tromboplastyny po aktywacji (aPTT), wartości Quicka i fibrynogenu, nawet przy ujemnym wywiadzie krwawień, tak aby dalsze badania wydawały się konieczne.
Krew tętnicza krzepnie szybciej niż krew żylna, co wynika z różnic w zawartości gazu. Krzepnięcie krwi tętniczej można spowolnić przez dodanie kwasu węglowego , ale krzepnięcie krwi żylnej można przyspieszyć przez zwiększenie zawartości tlenu . Różnice temperatury obu rodzajów krwi są znacznie mniej regularne, ponieważ o ile w narządach o bardzo ożywionej przemianie materii (np. gruczołach i mięśniach) krew wypływająca jest cieplejsza niż krew dopływająca, o tyle narządy o znikomej zdolności do wytwarzania ciepła ( np. zewnętrzna skóra) wykazują odwrotne zachowanie.
Znaczenie w chorobach
Zasadniczo równowaga między hemostazą a fibrynolizą może zaburzyć w obu kierunkach: zwiększona koagulacja nazywana jest trombofilią (zakrzepy krwi, które rozwijają się i powodują chorobę, nazywane są skrzepliną lub zatorową ), a zmniejszona koagulacja to skaza krwotoczna . Skłonność do krwawień może również powstać w wyniku wcześniejszej silnej aktywacji krzepnięcia przy zużyciu czynników krzepnięcia.
Skłonność do krwawień
Opisane powyżej fizjologiczne procesy hemostazy po urazie (naczynia krwionośne, hemostaza komórkowa i plazmatyczna) mogą być zaburzone w dowolnej fazie, tak że wiele różnych zaburzeń może prowadzić do tendencji do krwawień. Podobnie jak sama hemostaza, jej zaburzenia mogą rozpocząć się w obszarze naczyń krwionośnych. Przyczyną zwiększonej skłonności do krwawień może być na przykład wrodzona wada rozwojowa naczyń krwionośnych prowadząca do ich powiększenia i znana jako choroba Oslera .
Hemostaza komórkowa jest zaburzona, gdy występuje wyraźny brak płytek krwi ( trombocytopenia ) lub gdy występują dysfunkcje płytek krwi. Te ostatnie są najczęstszą przyczyną zwiększonej skłonności do krwawień. Mogą być spowodowane lekami (patrz rozdział Leki przeciwpłytkowe powyżej), najczęstszym wrodzonym zaburzeniem hemostazy komórkowej (i jednocześnie najczęstszym wrodzonym zaburzeniem krwawienia ze wszystkich) jest zespół Willebranda-Jürgensa .
Brak wielu czynników krzepnięcia plazmatycznego może również prowadzić do chorób, które czasami zagrażają życiu, na przykład chorób dziedzicznych, takich jak hemofilia . Najczęściej dotyczy to czynnika krzepnięcia VIII (hemofilia A), rzadziej także czynnika krzepnięcia IX (hemofilia B).
Oprócz wrodzonych postaci skłonności do krwawień, które są zwykle spowodowane wadami genetycznymi poszczególnych elementów hemostazy, istnieją również stany nabyte, które prowadzą do zwiększonej skłonności do krwawień. Koagulacja plazmowa może m.in. B. być zaburzonym niedoborem witaminy K . W rezultacie czynniki krzepnięcia II, VII, IX i X nie mogą być już wystarczająco karboksylowane w wątrobie , co może prowadzić do upośledzenia czynnościowego i w konsekwencji do ciężkiego krwotoku mózgowego, zwłaszcza u wcześniaków. Ponieważ wszystkie czynniki krzepnięcia są wytwarzane w wątrobie, ciężkie choroby wątroby prawie zawsze prowadzą do braku czynników krzepnięcia, co skutkuje zwiększonym ryzykiem krwawienia.
Rozsianą koagulopatię jest chorobą zagrażającą życiu, w którym korpus własnego przez nienormalnie wysokich poziomów mediatorów, takich jak histamina, serotonina i adrenaliny nadmiernie opróżniania krzepnięcia krwi zachodzi. Prowadzi to do dużego zużycia czynników krzepnięcia plazmatycznego, których organizm nie jest w stanie wystarczająco szybko zastąpić. Dlatego mówi się o koagulopatii konsumpcyjnej.
Profilaktyczne transfuzje osocza mogą być stosowane przed zabiegiem chirurgicznym u pacjentów z zaburzeniami krzepnięcia. Jeśli chodzi o wpływ profilaktycznych przetoczeń osocza przed zabiegami inwazyjnymi u pacjentów bez wrodzonych zaburzeń krzepnięcia , dowody na śmiertelność z jakiejkolwiek przyczyny, w przypadku poważnych krwawień, liczbę transfuzji na pacjenta, liczbę pacjentów wymagających transfuzji i transfuzję komplikacje związane są bardzo niepewne. Różne czynniki wyzwalające transfuzję dla świeżo mrożonego osocza (FFP) mogą umożliwić zmniejszenie liczby osób potrzebujących takiej transfuzji.
Zakrzepica i zator
Zakrzepica jest chorobą naczyniową, w której w naczyniu tworzy się skrzep krwi (skrzeplina). Przyczyny tego można znaleźć w uszkodzeniu ściany naczynia i ogólnie w zmniejszonym przepływie krwi. Dużą rolę odgrywają tu również zaburzenia krzepnięcia: na przykład dziedziczna lub wywołana lekami zwiększona skłonność do koagulacji może szybko doprowadzić do zakrzepicy. Z tego powodu należy podjąć środki zaradcze, takie jak pończochy profilaktyczne przeciw zakrzepicy (MTPS) , przerywany ucisk pneumatyczny lub antykoagulanty, takie jak heparyna lub fenprokumon , na przykład, nawet jeśli nogi są unieruchomione przez długi czas.
Zator jest skrzeplina, która została zmyta z miejscem jego pochodzenia. Może to prowadzić do poważnych powikłań, w tym zawału mózgu .
Trombofilia
Istnieje szereg chorób wrodzonych i nabytych, w których występuje zwiększona skłonność do krzepnięcia. Ich wspólną cechą jest zwiększona niedrożność naczyń krwionośnych, taka jak zakrzepica i zator . W niektórych chorobach bardziej dotknięty jest układ tętnic (tętnic) wysokiego ciśnienia, w innych układ żył niskiego ciśnienia. Najczęstsze i najważniejsze trombofilie to:
- Choroba z czynnikiem V (ponad 90 procent przyczyn oporności na APC )
- Mutacja protrombiny G20210A
- Zespół antyfosfolipidowy
- Niedobór inhibitory krzepnięcia krwi, w szczególności niedoboru białka C , niedoborem białka S i antytrombiny niedoboru
- podwyższona homocysteina
- podwyższony czynnik krzepnięcia VIII.
Podczas leczenia lekiem przeciwzakrzepowym, heparyną, może wystąpić szczególna forma trombofilii . Lek ten, paradoksalnie, w niektórych przypadkach aktywuje płytki krwi, powodując ich zlepianie się i rozpoczęcie kaskady krzepnięcia. Może to prowadzić do ciężkiej zakrzepicy w całym ciele. Spadek liczby płytek krwi można zmierzyć, dlatego obraz kliniczny określa się jako małopłytkowość poheparyną (typ II).
Zobacz też
- Hemostaza dla innych metod hemostazy medycznej
literatura
- Joachim Rassow , Karin Hauser, Roland Netzker: Biochemia . Wydanie I. Thieme, Stuttgart 2006, ISBN 3-13-125351-7 .
- Werner Müller-Esterl: Biochemia. Wprowadzenie dla lekarzy i naukowców . Wydanie I. Wydawnictwo Akademickie Spectrum, Frankfurt 2004, ISBN 3-8274-0534-3 .
- Roland Scholz: Biochemia medyczna . Wydanie I. Rozdział 11/12: Biotransformacja: obce substancje, hem, cholesterol. Krzepnięcie krwi i fibrynoliza. Zuckerschwerdt, Monachium 2003, ISBN 3-88603-822-X .
- Robert F. Schmidt, Florian Lang, Gerhard Thews : Fizjologia człowieka . Wydanie 29. Springer, Berlin 2004, ISBN 3-540-21882-3 .
- Monika Barthels, Mario von Depka: Kompendium krzepnięcia . Wydanie I. Thieme, Stuttgart 2003, ISBN 3-13-131751-5 .
- Herbert A. Neumann: Układ krzepnięcia: fizjologia i patofizjologia. Wprowadzenie . Wydanie I. ABW Wissenschaftsverlag, Berlin 2007, ISBN 3-936072-66-3 .
- Samuel C. Harvey: Historia hemostazy. W: Roczniki historii medycznej. Nowy odcinek, 1, 1929, s. 127-134.
linki internetowe
- Axel W. Bauer , Kerstin Mall: hemostaza, zakrzepica i zator. Koncepcje historyczne dotyczące fizjologii krzepnięcia krwi ( Memento z 4 marca 2010 w Internet Archive ), Uniwersytet w Heidelbergu. Opublikowano w Hemostaseology . 15 (1995) 92-99.
- Koagulacja krwi (angielski)
Indywidualne dowody
- ↑ Gerd Herold : Medycyna wewnętrzna. Publikacja własna, Kolonia 2018, s. 135.
- ↑ Ulrich Weber: Biologia. Pełny tom Oberstufe, Cornelsen, Berlin 2001, ISBN 3-464-04279-0 , s. 153.
- ↑ J. Piasek pylisty: Budowa i funkcja naczyń krwionośnych . W: Anatomia Benninghoffa . Wydanie 15. Urban & Springer, Monachium 1994.
- ^ Robert F. Schmidt, Florian Lang, Gerhard Thews: Physiologie des Menschen . Wydanie 29. Springer, Berlin 2004, ISBN 3-540-21882-3 , s. 524 .
- ↑ Krzepnięcie (s) krwi
- ^ Rainer Klinke, Hans-Christian Pape, Stefan Silbernagl (red.): Podręcznik fizjologii. Wydanie piąte. Thieme, Stuttgart 2005, ISBN 3-13-796003-7 ; s. 246 n.
- ↑ Deetjen, Speckmann, Hescheler: Fizjologia . Wydanie IV. Urban & Fischer, Monachium 2006, ISBN 3-437-44440-9 , s. 366 .
- ^ Earl W. Davie, Kazuo Fujikawa, Walter Kisiel: Kaskada krzepnięcia: inicjacja, konserwacja i regulacja . W: Biochemia, 1991, 30 (43), 10363-10370.
- ^ Joachim Rassow, Karin Hauser, Roland Netzker: Biochemia . Wydanie I. Thieme, Stuttgart 2006, ISBN 3-13-125351-7 , s. 742 .
- ↑ Model hemostazy oparty na komórkach, Maureane Hoffman, Dougald M. Monroe III, Thromb Haemost 2001; 85: 958-65 © 2001 Schattauer GmbH, Stuttgart, PMID 11434702 .
- ↑ Centralna rola płytek krwi w nowym rozumieniu hemostazy, K. Jurk, BE Kehrel, Hämostaseologie 2005; 25: 39-49 Schattauer GmbH, Stuttgart.
- ↑ F. Josso, O. Prou-Wartelle: Interakcja czynnika tkankowego i czynnika VII w najwcześniejszej fazie krzepnięcia. W: Thrombosis et diathesis haemorrhagica. Suplement. Tom 17, 1965, ISSN 0375-9997 , s. 35-44, PMID 5874847 .
- ↑ a b c d Wolf-Dieter Müller-Jahncke , Christoph Friedrich , Ulrich Meyer: Historia medycyny . 2., poprawione. i exp. Wydanie. Wiedza Verl.-Ges, Stuttgart 2005, ISBN 978-3-8047-2113-5 , s. 116 .
- ↑ a b Axel W. Bauer , Kerstin Mall: hemostaza, zakrzepica i zator. Koncepcje historyczne dotyczące fizjologii krzepnięcia krwi ( Memento z 4 marca 2010 w Internet Archive ), Uniwersytet w Heidelbergu. Opublikowano w Hemostaseology . 15 (1995) 92-99.
- ↑ RJ Jenny, DD Pittman, JJ Toole, RW Kriz, RA Aldape, RM Hewick, RJ Kaufman, KG Mann: Kompletne cDNA i pochodna sekwencja aminokwasów ludzkiego czynnika V. W: Proc Natl Acad Sci USA , 1987, 84, s. 4846-4850, PMID 3110773 .
- ^ RA Biggs, AS Douglas, RG MacFarlane, JV Dacie, WR Pittney, C. Merskey i JR O'Brien: Choroba Świąt Bożego Narodzenia, stan wcześniej mylony z hemofilią. W: British Medical Journal , Londyn, 1952, s. 1378-1382.
- ^ Fizjologia krzepnięcia ( Memento z 15 września 2011 w Internet Archive ) Instytut Werlhof.
- ↑ Komunikat prasowy FDA z 5 listopada 2007 r . .
- ↑ Günter Thiele (red.): Handlexikon der Medizin , Urban & Schwarzenberg, Monachium / Wiedeń / Baltimore bez roku, Tom II (F – K), s. 1328.
- ^ Leksykon Medycyna , wydanie 4, Elsevier Verlag, Monachium bez roku [2005], ISBN 3-625-10768-6 , s. 920.
- ^ B. Luxembourg i in.: Podstawowa wiedza o laboratorium krzepnięcia . W: Deutsches Ęrzteblatt 104, wydanie 21, 25 maja 2007, strona A-1489.
- ^ J. Kościelny i wsp.: Przedoperacyjna identyfikacja pacjentów z (pierwotnymi) zaburzeniami hemostazy. W: Hamostaseologie , sierpień 2007, 27 (3), s. 177-184, PMID 17694224 .
- ↑ G. Pfanner i wsp.: Przedoperacyjny wywiad krwawienia . W: Anestezjolog , 56 czerwca 2007 (6), s. 604-611. doi : 10.1007/s00101-007-1182-0 , PMID 17522829 .
- ↑ C. Bidlingmaier i wsp.: Badanie hemostatyczne przed planowym zabiegiem chirurgicznym u dzieci? Nie zawsze! W: Hamostaseologie , 2009 styczeń, 29 (1), s. 64-67, PMID 19151849 .
- ^ FW Albert i wsp.: Analiza laboratoryjna skazy krwotocznej przed planowym zabiegiem chirurgicznym? Tak! . ( Pamiątka z oryginałem z dnia 27 kwietnia 2015 w Internet Archive ) Info: archiwum Link został wstawiony automatycznie i nie została jeszcze sprawdzona. Sprawdź link do oryginału i archiwum zgodnie z instrukcjami, a następnie usuń to powiadomienie. W: Hamostaseologie , 2009 styczeń, 29 (1), s. 58-63.
- ↑ Jonathan Huber, Simon J. Stanworth, Carolyn Doree, Patricia M. Fortin, Marialena Trivella: Profilaktyczna transfuzja osocza dla pacjentów bez dziedzicznych zaburzeń krzepnięcia lub stosowania antykoagulantów poddawanych operacjom niekardiologicznym lub zabiegom inwazyjnym . W: Baza danych przeglądów systematycznych Cochrane . 28 listopada 2019, doi : 10.1002 / 14651858.CD012745.pub2 ( wiley.com [dostęp 25 sierpnia 2020]).