Jod
| nieruchomości | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ogólnie | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nazwa , symbol , liczba atomowa | Jod, ja, 53 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kategoria elementu | Halogeny | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupa , kropka , blok | 17 , 5 , s | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wygląd zewnętrzny | gazowy: ciemnofioletowy, w postaci stałej: szaro-czarny, błyszczący |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| numer CAS | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numer WE | 231-442-4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Karta informacyjna ECHA | 100.028.585 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kod ATC | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ułamek masowy powłoki Ziemi | 0,06 ppm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomowy | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atomowa | 126.90447 (3) i | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Promień atomowy (obliczony) | 140 (115) po południu | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Promień kowalencyjny | 139 po południu | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Promień Van der Waalsa | 198 po południu | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Konfiguracja elektronów | [ Kr ] 4 d 10 5 s 2 5 s 5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Energia jonizacji | 10.451 260 (25) eV ≈ 1 008.39 kJ / mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Energia jonizacji | 19..13126 (12) eV ≈ 1 845.89 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Energia jonizacji | 29.570 (25) eV ≈ 2 853.1 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Energia jonizacji | 40.357 (25) eV ≈ 3 893.9 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Energia jonizacji | 51.52 (4) eV ≈ 4 971 kJ / mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6. Energia jonizacji | 74.4 (4) eV ≈ 7 179 kJ / mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 7. Energia jonizacji | 87.61 (6) eV ≈ 8 453 kJ / mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fizycznie | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Stan fizyczny | naprawiony | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Struktura krystaliczna | rombowy | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| gęstość | 4,94 g cm- 3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| magnetyzm | diamagnetyczny ( Χ m = -4,3 10 -5 ) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Temperatura topnienia | 386,85 K (113,70 ° C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| temperatura wrzenia | 457,2 K (184°C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Objętość molowa | 25,72 · 10 −6 m 3 · mol −1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ciepło parowania | 41,6 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ciepło stapiania | 7,76 kJ mol- 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
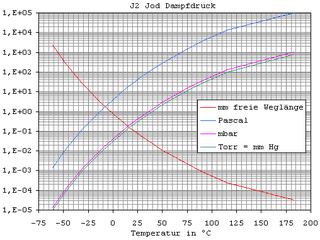
| Ciśnienie pary | 35 Pa przy 298 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Przewodność cieplna | 0,449 W · m- 1 K- 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemicznie | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Stany utleniania | ± 1, 3, 5, 7 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Potencjał normalny | 0,536 V (W 2 + 2 W - → 2 W - ) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektroujemność | 2,66 ( skala Paulinga ) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Izotopy | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dla innych izotopów zobacz listę izotopów | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| instrukcje bezpieczeństwa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| MAK |
Szwajcaria: 0,1 ml m- 3 lub 1 mg m- 3 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dane toksykologiczne |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
W miarę możliwości i zwyczajowo stosowane są jednostki SI . O ile nie zaznaczono inaczej, podane dane dotyczą warunków standardowych . | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Jod ( jod w języku standardowym , jest przestarzały, ale fachsprachlich) jest pierwiastkiem chemicznym o symbolu pierwiastka I (przed wprowadzeniem międzynarodowego symbolu pierwiastka było J ) i liczbie atomowej 53. W układzie okresowym jest w siódmej grupie głównej lub 17. grupa IUPAC i tym samym należy do halogenów . Nazwa pochodzi od starożytnego greckiego słowa „ioeides” (ιο-ειδής) oznaczającego „fioletowy, fioletowy”. Pary powstające po podgrzaniu są charakterystycznie fioletowe.
Starsze nazwy to jod, jod i jod.
W temperaturze pokojowej jod jest ciałem stałym słabo rozpuszczalnym w wodzie, ale łatwo rozpuszczalnym w wodnym roztworze jodku potasu (patrz: płyn Lugola ) i bardzo dobrze rozpuszczalnym w etanolu i innych rozpuszczalnikach organicznych .
W języku potocznym , jod jest wspólna pisowni, również w starszej literaturze chemicznej i głównie w obecnej literaturze medycznej. Pisownia jodu jest wymieniona w Duden z odniesieniem do jodu i wskazuje się na język techniczny. Symbol pierwiastka I jest używany w publikacji IUPAC w specjalistycznej literaturze chemicznej od 1970 r., a nazwę pierwiastka J można znaleźć w starszej literaturze niemieckojęzycznej .
Jod jest niezbędnym składnikiem organizmu zwierzęcego i ludzkiego i jest przyjmowany z pożywieniem. Stężenie u ludzi jest najwyższe w tarczycy , gdzie znajduje zastosowanie w hormonach tyroksynie i trójjodotyroninie oraz jako dijodotyrozyna . Za powstawanie wola odpowiada najczęściej niedobór jodu w wodzie pitnej i pożywieniu . Profilaktycznie zalecamy spożywanie ryb morskich raz lub kilka razy w tygodniu oraz stosowanie tzw. soli jodowanej (sól kuchenna zmieszana z jodanem sodu lub potasu ). Ta indywidualna profilaktyka jodowa i jodowanie pasz częściowo rekompensuje brak jodu w glebie w Niemczech. Tymczasowo osiągnięto, że ogólna podaż jodu w populacji po prostu była zgodna z wytycznymi WHO . Według Federalnego Instytutu Oceny Ryzyka od 2020 r. podaż jodu wykazuje tendencję spadkową i nie jest optymalna.
fabuła
Farmakologiczne znaczenie preparatów zawierających jod było znane już w starożytności . Na przykład, 1500 roku przed naszą erą, wola cierpiących przepisywano zawierający jod tarczycy z owiec lub z popiołów z morskich gąbki .
Jod został po raz pierwszy uzyskany w 1811 r. przez paryskiego producenta saletry i sody Bernarda Courtois przy wytwarzaniu prochu strzelniczego z popiołów wodorostów . Podstawowa postać (którą na przykład Humphry Davy upublicznił wcześnie i który nadał jodowi jego nazwę) została zbadana dopiero w 1813 roku przez francuskich naukowców Nicolasa Clémenta i Josepha Louisa Gay-Lussaca , którzy rok później nadali mu obecną nazwę .
Występowanie
Oprócz astatyny jod jest znacznie rzadszy niż inne halogeny. Jest szeroko rozpowszechniony w przyrodzie, ale tylko w postaci jego związków , np. wzbogacony (0,02–1%) w azotan Chile , głównie w postaci jodanu sodu (NaIO 3 ), ale także nadjodanu sodu (NaIO 4 ) i Lautaritu (Ca (IO 3 ) 2 ). Można go wykryć w niewielkich śladach w glebie i skałach . Średnio 1000 gramów bezwodnej drobnej gleby z Niemiec zawiera około 2,5 miligrama jodu. Zawartość jodu w glebie ma zasadnicze znaczenie dla zaopatrzenia ludności w naturalny jod. Jako jodowodór występuje w bardzo małych ilościach w gazach wulkanicznych .
Rozpuszczalne związki jodu, takie jak jodki metali alkalicznych i ziem alkalicznych, są uwalniane podczas wietrzenia skał przez wodę deszczową lub rozpadają się w wyższych temperaturach. W ten sposób trafiają do wód gruntowych, a ostatecznie do oceanów . Niektóre wody mineralne zawierają jod. Źródło mineralne w Woodhall Spa w Lincolnshire w Anglii produkuje wodę zabarwioną jodem na brązowo. Ilość jodu w wodzie morskiej jest 0,05 miligrama na litr . Występuje tam w postaci jodku (I - ) i jodanu (IO 3 - ) w stężeniu ok. 500 nmol/L. Dystrybucja w wodzie powierzchniowej na ogół waha się od 0–200 nmol I - / L.
W atmosferze ziemskiej jod występuje w postaci związków organicznych lub nieorganicznie w postaci tlenku jodu (IO), azotanu jodu lub wyższych tlenków. Niewiele informacji jest dostępnych dla stratosfery i górna granica 0,1 ppt dla jodu nieorganicznego. Wysokie stężenia powyżej 10 ppt IO wykryto na polach alg na wybrzeżach, a rodnik tlenku jodu wykryto również na tropikalnym Atlantyku.
Organiczne związki jodu można wyizolować z alg morskich (19 gram jodu na kilogram suchej masy ), wodorostów i gąbek (do 14 gram jodu na kilogram suchej masy). Tarczyca jest ważnym magazynem jodu związanego organicznie .
Izotopy
Dotychczas znanych jest 36 izotopów i 10 izomerów jądrowych jodu . Spośród nich tylko jeden izotop jest stabilny, tak więc naturalnie występujący jod składa się w 100% z jedynego stabilnego izotopu 127 I. Jod jest zatem pierwiastkiem czystym ( anizotopowym ). Spośród niestabilnych izotopów emiter beta 129 I ma bardzo długi okres półtrwania wynoszący 15 700 000 lat. Istnieją również cztery izotopy o okresie półtrwania dłuższym niż jeden dzień: 124 I (4,2 dni), 125 I (59 dni), 126 I (13 dni) i 131 I (8,0 dni). Powstają niestabilne izotopy jodu z. B. w rozszczepieniu jądra i uwolnione do powietrza stanowią zagrożenie dla zdrowia, ponieważ mogą gromadzić się w tarczycy.
Ekstrakcja i prezentacja
Dawniej jod w postaci jodków i jodanów był pozyskiwany przez wyrzuconych przez przypływ na plaży Tange zebranych i spalonych. Otrzymany popiół zawierał około 0,1-0,5% jodu. Dziś jednak ta produkcja jodu ma jedynie znaczenie lokalne i stanowi około 2% światowej produkcji rocznej.
Techniczna produkcja jodu jest ściśle powiązana z produkcją saletry . Jod zawarty w roztworach macierzystych jest przekształcany w jod pierwiastkowy poprzez redukcję . W pierwszym etapie reakcji kwas siarkawy jest używany do redukcji kwasu jodowego (jodanu jest anionem tego kwasu) do jodowodór :
- Kwas jodowy i kwas siarkawy reagują, tworząc jodowodór i kwas siarkowy
Jodowodór jest z kolei utleniany do jodu w drugim etapie przez kwas jodowy obecny w roztworze . W tym przypadku mówi się o proporcjach , ponieważ jod staje się jodem pierwiastkowym ze stopniem utlenienia 0 na dwóch różnych stopniach utlenienia (-1 w jodowodorze i +5 w kwasie jodowym).
- Stosunek kwasu jodowego i jodowodoru do wody i jodu
Alternatywnie, dwutlenek siarki (SO 2 ) można również dodać do końcowych roztworów, z których saletra już wykrystalizowała , w celu redukcji .
Podczas produkcji ropy naftowej i gazu ziemnego powstają znaczne ilości solanki o zawartości jodu od 30 do ponad 100 ppm . Jod w postaci jodku sodu jest uwalniany z solanki poprzez utlenianie chlorem :
- Jodek sodu i chlor reagują, tworząc chlorek sodu i jod
Otrzymany jod jest dalej oczyszczany przez wydmuchanie go powietrzem, następnie redukcję dwutlenkiem siarki w roztworze kwasu siarkowego, a na koniec ponowne utlenienie do jodu za pomocą gazowego chloru.
- Jod jest redukowany do jodowodoru przez dwutlenek siarki
- Jodek wodoru i chlor reagują, tworząc chlorowodór i jod
Chromatograficznie jodu za pomocą adsorpcji na polijodkiem do anionowymiennymi są wzbogacane. Do ultraczystej produkcji stosuje się jodek potasu i bezhalogenowy siarczan miedzi .
W skali laboratoryjnej jod może być wytwarzany przez działanie kwasu siarkowego i tlenku manganu (IV) lub nadtlenku wodoru na jodek potasu . Można go również wyekstrahować z popiołów roślin morskich zawierających jod, poddając je działaniu chloru.
nieruchomości
Właściwości fizyczne
W normalnych warunkach jod jest ciałem stałym, które tworzy szaroczarne, błyszczące, metaliczne płatki o gęstości 4,94 g · cm- 3 . Gdy topi się ( temperatura topnienia 113,70 ° C), jod zamienia się w brązową, elektrycznie przewodzącą ciecz. Sprowadza się w 184,2 ° C, z utworzeniem pary fioletowego obejmującej i 2 cząsteczek. Jod sublimuje nawet w temperaturze pokojowej, dzięki czemu topienie jest możliwe tylko przy szybkim i silnym wzroście temperatury.
Struktura krystaliczna i molekularna
Jod ma właściwości półprzewodnika . Właściwości te wynikają z obecności sieci warstwowej, w której poszczególne poziomy składają się z cząsteczek I 2 (długość wiązania 271,5 pm ). Odległość między płaszczyznami w krysztale warstwy rombowej wynosi 441,2 µm, a zatem odpowiada odległości van der Waalsa między dwoma atomami jodu (430 µm). Wynik pomiaru najkrótszej odległości między dwiema cząsteczkami jodu jest znacznie niższy przy 349,6 pm.
Model 3D komórki elementarnej
Właściwości chemiczne
Jod znacznie słabiej reaguje z innymi pierwiastkami, takimi jak fosfor , glin , żelazo i rtęć niż chlor i brom . Z wodoru jodu reaguje jodowodór , lecz rozkłada się przy lekkim ogrzewaniu szybko elementów.
- Jod i wodór są w równowadze z jodowodórem. Jeśli temperatura wzrasta, to przesuwa się w lewo.
Wybuchowa reakcja zachodzi z amoniakiem ze względu na związany z tym wzrost objętości.
Z roztworem amoniaku jod tworzy azot trójjodowy (NI 3 ).
Ciekawą właściwością jodu jest to, że tworzy związki polijodkowe. Rozpuszczone cząsteczki I 2 łączą się z anionem jodkowym, tworząc pojedynczy ujemnie naładowany anion I 3 - . Jedną z właściwości tego związku polijodkowego jest to, że jest on osadzony w helisach skrobiowych . Te związki interkalacyjne dają intensywnie niebieski kolor nawet w niskich stężeniach (czułe i specyficzne wykrywanie skrobi jodowej ).
Kationy jodu
Znane są różne kationy jodu . W ten sposób powstaje niebieski kation jodu I 2 +, gdy jod utlenia się trójtlenkiem siarki (65% oleum : H 2 SO 4 2 SO 3 ) rozpuszczonym w kwasie siarkowym :
Do utleniania można również stosować fluorek antymonu (V) lub pentafluorek tantalu w ciekłym dwutlenku siarki :
Nie udało się jednak połączyć z niesolwatowanym , czyli bezrozpuszczalnikowym monojodokationem I + . Nawet w połączeniu z wyjątkowo słabą zasadą Lewisa, taką jak anion nadchloranowy ClO 4 - znajdujemy kowalencyjnie związany jod. Jednak w fazie gazowej jon I + można wykryć przy braku przeciwjonu.
posługiwać się
Żywność
| Grupa zwierząt | Ilość jodu [mg/kg] |
|---|---|
|
Nieparzystokopytne ( konie , osły, muły) |
4. |
| Krowy mleczne | 5 |
| Kury nioski | 5 |
| Wieprzowy | 10 |
| Drób brojlery | 10 |
| ryby | 20. |
Mineralnych jodu (głównie w postaci jodku) uważa składników pokarmowych w diecie od ludzi i wielu zwierząt i w istotny pierwiastek śladowy . W szczególności sól jodowana jest stosowana jako pożywienie jodowane (wzbogacone w jod) w celu zapobiegania niedoborom jodu. W Rozporządzeniu (WE) nr 1925/2006 (rozporządzenie wzbogacające) zawartość jodu w żywności została ustalona tak, aby była ona prozdrowotna zgodnie z Rozporządzeniem (WE) nr 1924/2006 (Oświadczenia zdrowotne) w Unii Europejskiej (zadeklarowane zgodnie z krajowymi przepisami dotyczącymi znakowania żywności w Niemczech, Austrii i Szwajcarii). Często dodaje się go do tego, zwykle jako jodek wapnia. Jod dodaje się również do gotowej karmy dla zwierząt, na przykład w większości karm dla kotów i psów, ale karmę dla ptaków (np. dla kanarków) można również jodować. W przypadku dodawania jodu do zwierząt rzeźnych obowiązują najwyższe dopuszczalne poziomy w UE zgodnie z zaleceniem lub po przesłuchaniu Europejskiego Urzędu ds. Bezpieczeństwa Żywności (EFSA) . (patrz sąsiednia tabela)
W Niemczech związki jodu nadal znajdują się w glebie w zbyt małych ilościach. Profilaktyka jodowa, która zasadniczo polega na jodowaniu soli kuchennej („soli jodowanej”) i jodowaniu pasz w rolnictwie, poprawiła podaż jodu w Niemczech do tego stopnia, że joduria u dzieci jest najbardziej wiarygodnym kryterium oceny obowiązuje podaż jodu – w dużej próbie w latach 2003-2006 osiągnięto medianę 117 µg/l. Znajdował się więc w dolnym przedziale zalecanym przez Światową Organizację Zdrowia (WHO) od 100 do 200 µg/l. Zgodnie z kryteriami WHO uważa się zatem, że Niemcy mają odpowiednie zaopatrzenie w jod. Niemniej jednak 36% populacji w Niemczech ma łagodny, a 21% umiarkowany do ciężkiego niedoboru jodu .
Zastosowania medyczne
Nalewka i jodoform jodu zawierają jod w postaci elementarnej lub związanej i służą jako środek przeciwgrzybiczy i antyseptyczny . Przyjmuje się, że działanie dezynfekujące opiera się na odszczepieniu tlenu z wody. Krótko po uwolnieniu ( in statu nascendi ) tlen ten jest szczególnie reaktywny:
Mechanizm ten jest również omawiany dla innych halogenów. Z tego powodu jod stosuje się również w indywidualnych przypadkach do dezynfekcji wody w zakładach kąpielowych. W tym kontekście korzystne jest, aby jod był mniej agresywny niż chlor. Jednak to uzdatnianie wody nie jest w stanie zabić glonów, dlatego należy również dodać środek glonobójczy . Jednak intensywne stosowanie jodu może prowadzić do przebarwień skóry. Istnieje również ryzyko alergii . Obu można uniknąć , stosując tak zwane jodofory , materiały nośnikowe, które mogą wiązać jod.
Jodany dodaje się do soli kuchennej w niewielkich ilościach w postaci jodanu sodu lub jodanu potasu w celu zapobiegania chorobom związanym z niedoborem jodu . Oferowana jest w handlu potocznie jako sól jodowana .
Promieniotwórczy jod izotopy 131 I (8,02 dni półtrwania) oraz 123 I (13.22 godzin półtrwania) są stosowane jako radiofarmaceutyków w medycynie nuklearnej diagnostyce i terapii, głównie na choroby tarczycy ( porównaj terapii jodem radioaktywnym ), przy 131 i stosowane coraz więcej dzisiaj. Do oznaczenia zawartości minerałów kostnych stosuje się 125 I ( promieniowanie gamma o γ = 35 keV, 59,4 dni okres półtrwania). 125I jest również radioizotopem najczęściej używanym w badaniach radioimmunologicznych (RIA).
Jod jest szeroko stosowanym katalizatorem w reakcjach chemicznych . Służy do stereospecyficznej polimeryzacji z 1,3-butadienu . Siarkowanie z aromatycznych związków, jak również alkilowania i kondensację aromatycznych amin są dalsze dziedziny stosowania.
W diagnostyce jako rentgenowskie środki kontrastowe stosuje się aromatyczne związki jodu .
Jodek sodu jest używany jako scyntylator w licznikach scyntylacyjnych .
Ochrona przed promieniowaniem
Radioaktywne izotopy jodu znajdują się w opadach po wybuchach jądrowych oraz w reaktorze elektrowni jądrowych (NPP). W przypadku awarii jądrowej z uwolnieniem radioaktywnych izotopów jodu rządy federalne i stanowe przechowują łącznie 137 milionów tabletek jodku potasu o wysokiej zawartości stabilnego izotopu jodu 127 I (w większości określanych jako „tabletki jodu”) w pobliżu niemieckich elektrowni jądrowych Blokada jodowa ma zapobiegać wychwytywaniu radioaktywnych izotopów jodu w tarczycy. Kolba została ostatnio odnowiona w 2004 roku. W Szwajcarii tabletki jodku potasu otrzymują wszyscy, którzy mieszkają w promieniu 50 km od elektrowni jądrowej (około 4,6 mln) oraz znajdujące się tam firmy.
Jod jest uważany za bardzo lotny radionuklid, który w wyniku rozszczepienia jądrowego występuje w wysokich stężeniach w szczelinie, szczelinie między granulkami paliwa a rurką osłaniającą prętów paliwowych elektrowni jądrowej. Jeśli obudowa elektrowni jądrowej ulegnie przeciekowi w przypadku uszkodzenia rdzenia lub nawet stopienia rdzenia po wystąpieniu awarii, spowoduje to poważne szkody z punktu widzenia ochrony radiologicznej, ponieważ jest to praktycznie pierwszy nuklid , obok radioaktywnych izotopów 85 Kr i 135 Xe gazów szlachetnych kryptonu i ksenonu uwalnia się w większych stężeniach i wchodzi w cykl biologiczny.
Znaczenie biologiczne
Po spożyciu większych dawek związków jodu rzędu miligramów dochodzi do podrażnienia skóry i błon śluzowych. Może to prowadzić do „jodyzmu”, któremu towarzyszą objawy kataru („katar jodowy”), zapalenia spojówek , zapalenia oskrzeli i wysypki . Wpływ na błonę śluzową oskrzeli doprowadził w przeszłości do stosowania soli jodu jako środków wykrztuśnych . Z drugiej strony, jodek w wysokich dawkach może być stosowany do hamowania nadczynności tarczycy , ponieważ hamuje uwalnianie i syntezę hormonów tarczycy.
Hormony tarczycy
Jod odgrywa głównie rolę w produkcji hormonów tarczycy tyroksyny (T4) i trójjodotyroniny (T3), które zawierają cztery lub trzy atomy jodu. Podaż jodu w ludzkim ciele szacowana jest na 10 do 30 miligramów. Niedobór jodu początkowo prowadzi jedynie do powstania wola eutyreozy . Tylko wyraźny niedobór jodu prowadzi również do niedoczynności tarczycy ( niedoczynność tarczycy ), która charakteryzuje się obniżoną produkcją T4 i T3. Ponieważ hormony tarczycy pełnią istotne funkcje w regulacji procesów metabolicznych w prawie każdej komórce organizmu, niedoczynność tarczycy powoduje poważne zaburzenia metaboliczne i rozwojowe.
Do roli jodu w chorobach tarczycy podaży zobaczyć profilaktyki jodowej , jod nietolerancja , nadczynność tarczycy i Hashimoto .
Klatka piersiowa
Istnieją dowody na to, że jod i jego produkty przemiany materii wpływają również na rozwój i wzrost nowotworów gruczołu sutkowego .
instrukcje bezpieczeństwa
Jod jest klasyfikowany przez UE jako substancja niebezpieczna, której należy unikać przedostawania się do środowiska. Podczas obsługi elementu należy przestrzegać odpowiednich środków ochronnych. Pozostałości jodu należy traktować roztworem tiosiarczanu sodu (→ redukcja do jodku). Przed wyrzuceniem do ścieków należy zneutralizować wartość pH mieszaniny reakcyjnej wodorowęglanem sodu . Jod nie może mieć kontaktu z amoniakiem, w przeciwnym razie może powstać wybuchowy azot jodowy .
Analityka
Klasyczna analiza jakościowa jodu
Reakcja skrobiowo- jodowa jest najlepiej znaną metodą wykrywania pierwiastkowego jodu. Aby to udowodnić, do badanej próbki dodaje się niewielką ilość wodnego roztworu skrobi. Jeśli obecny jest jod, powstaje barwny kompleks.
Jony jodkowe można wykryć w specyficznych reakcjach strącania . Bardzo dobrze znana jest reakcja z azotanem srebra , która prowadzi do wytrącenia żółtego jodku srebra :
Azotan rtęci (I) spada, gdy jest używany w nadmiarze, jony jodkowe w postaci żółto-zielonego jodku rtęci (I) :
Jeśli z drugiej strony stosuje się azotan rtęci (II) , otrzymuje się czerwony osad jodku rtęci (II) :
Reakcja redoks chloru pierwiastkowego z jodkiem jest podstawą dalszej jakościowej reakcji wykrywania. Chlorowodór może jodkiem elementarnego jodu utlenieniu , a chlor jest zredukowane do chlorku. Utworzony jod staje się widoczny jako brązowawy kolor. Można go ekstrahować rozpuszczalnikami organicznymi (np. chloroformem lub czterochlorkiem węgla ) i stosować do fotometrycznej analizy ilościowej.
Instrumentalna analiza ilościowa jodu
Spektrometria absorpcji atomowej (AAS)
Jod praktycznie nie jest rutynowo wykrywalny za pomocą AAS, ponieważ linia rezonansowa w próżni UV ma długość 183,0 nm. Tylko kilka analitycznych grup roboczych zgłasza metody pośrednie, które jednak są obarczone dużą niepewnością.
Atomowa spektrometria emisyjna (AES)
Jodek można wykryć za pomocą ICP-AES (ICP, plazma sprzężona indukcyjnie). Jedną z metod jest utleniające wytwarzanie pary jodu. Jony jodkowe wytwarzane redukcyjnie z jodanu są atomizowane w plazmie i wzbudzane do emisji przy 178,3 nm. Granica wykrywalności osiągnięta tą metodą wynosi 0,4 µg/l.
Spektrometria mas (MS)
W przyrodzie występuje tylko izotop 127I . To jedyna stajnia. Za pomocą ICP-Quadrupole-MS (ICP, indukcyjnie sprzężona plazma) można go oznaczać w strawionych próbkach skał z granicą wykrywalności około 0,01 ng/ml. Połączenie chromatografii jonowej i ICP-MS jest dostępne jako specyficzna i czuła metoda analizy jodu w próbkach surowicy i moczu .
Chromatografia jonowa (IC)
Chromatografia anionowymienna jest dobrą metodą oddzielania jodków od roztworu próbki. Jodek oddziela się od innych jonów na kolumnie jonowymiennej. Wykrywanie odbywa się z. B. za pomocą detektorów elektrochemicznych, które mierzą przewodność eluatu lub amperometrią impulsową, aby określić wielkość przepływu prądu. Za pomocą amperometrii impulsowej można było osiągnąć granicę wykrywalności 0,5 µg/l jodku w wodzie morskiej. Od niedawna chromatografię jonową połączono również ze spektrometrią mas. Technika IC-Tandem-MS osiąga granicę wykrywalności 0,33 µg/l moczu.
Fotometria
Najbardziej znaną metodą fotometrycznego wykrywania jodku jest metoda kinetyczna według Sandella i Kolthoffa. Katalityczny wpływ jodku na redukcję ceru (IV) przez As (III) jest proporcjonalny do stężenia jodku i można go określić na podstawie szybkości odbarwienia żółtego roztworu ceru (III). Proces ten został dalej rozwinięty przez Moxona i Dixona i zastosowany do utleniania rodanku azotynem. Kinetyczny pomiar absorbancji przeprowadza się przy 450 nm. Osiągnięto granicę wykrywalności całkowitej zawartości jodu w żywności 0,01 µg/g.
Woltamperometria
Katodowa woltamperometria strippingowa jest idealna do elektrochemicznego oznaczania jodków . Rzeczywiste oznaczenie woltamperometryczne jest poprzedzone okresem wzbogacania utleniającego na elektrodzie z pastą węglową przy 700 mV. Wzbogacony jod jest ponownie redukowany, gdy skanowane jest potencjalne okno od 700 mV do -400 mV. Prąd redukcji jest proporcjonalny do stężenia jodku. Osiągnięto granicę wykrywalności 0,25 µmol/l.
spinki do mankietów
→ Kategoria: związek jodu
Jod tworzy związki na różnych stopniach utlenienia od -1 do +7. Najbardziej stabilnym i najczęstszym stopniem utlenienia jest -1, wyższe tworzą się tylko w związkach z bardziej elektroujemnymi pierwiastkami tlen , fluor , chlor i brom . Nieparzyste stany utlenienia +1, +3, +5 i +7 są bardziej stabilne niż parzyste.
Jodek i jodki
Związki nieorganiczne, w których jod znajduje się na -1 stopniu utlenienia, a więc jako anion, nazywane są jodkami . Pochodzą one z gazowego związku wodorowego jodowodór (HI). Jej wodny roztwór nazywa się kwasem jodowodorowym . W roztworze wodnym to wydziela protonu (PK a -10) w bardzo prosty sposób , a zatem jest bardziej kwasowa niż bromowodoru (PK e -8,9) i chlorowodoru (PK s -6,2) w wodzie.
Szczególnie dobrze znane są jodki metali alkalicznych , zwłaszcza jodek sodu i jodek potasu . Jodki są zwykle łatwo rozpuszczalne w wodzie, z wyjątkiem wielu jodków metali ciężkich, takich jak: B. jodek srebra , rtęci (I) , rtęci (II) i ołowiu (II) .
Jodki działają jako silne środki redukujące. Wystawienie na działanie powietrza powoduje stopniowe brązowienie jodków, roztwory soli miedzi (II) powodują wytrącanie się jodku Cu (I) i uwalnianie jodu. Jodek srebra jest stabilny tylko wtedy, gdy wykluczone jest światło, a wystawiony na działanie światła Ag (I) utlenia jodek do zarodków jodu i kryształów srebra ( zaczernienie na fotonegatywach ).
Tlenki jodu
Znana jest duża liczba związków jodu i tlenu . Opierają się one na ogólnych wzorach IO x (x = 1–4) i I 2 O x (x = 1–7). Wykryto związki IO, IO 2 , I 2 O 4 , I 4 O 9 , I 2 O 5 i I 2 O 6 z jodoksydów , z których dijodopentanolan (I 2 O 5 ) jest związkiem najbardziej stabilnym.
Kwasy jodowe
Oprócz jodotlenków jod i tlen tworzą również kilka kwasów tlenowych , w których jeden atom jodu jest otoczony przez jeden do czterech atomów tlenu, a także związane z nimi sole: kwas podjodowy (HIO) i podjodowy , kwas jodowy (HIO 2 ) i odpowiedni jodek , kwas jodowy (HIO 3 ) i jodany oraz kwas nadjodowy (H 5 IO 6 ) i związane z nim nadjodany .
Związki międzyhalogenowe
Jod tworzy szereg związków międzyhalogenowych z innymi halogenami . Są to: fluorek jodu (IF), trifluorek jodu (IF 3 ), pentafluorek jodu (IF 5 ), heptafluorek jodu (IF 7 ), chlorek jodu (ICl), dichlorek jodu ((ICl 2 ) 2 ), trichlorek jodu (ICl 3 ) ) i jodobromek (IBr). Jod jest zawsze bardziej elektrododatnim pierwiastkiem w tych związkach.
Organiczne związki jodu
Wiele organicznych związków jodu (również związków jodoorganicznych ) jest wytwarzanych syntetycznie, m.in. B. jodoalkany i jodoaromatyki . Wykorzystywane są m.in. w medycynie jako środki kontrastowe . Związki jodu są również wytwarzane w przyrodzie np. przez makroalgi. Pod wpływem światła słonecznego możliwa jest również produkcja CH 3 I i innych związków na powierzchni morza.
Zobacz też
literatura
- AF Holleman , E. Wiberg , N. Wiberg : Podręcznik chemii nieorganicznej . Wydanie 102. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1 , s. 440-442.
- BJ Füger, R. Dudczak, CH Pirich, G. Zettinig: Metabolizm jodu . W: Journal of Nutritional Medicine . 4 (2), 2002, s. 7–9 (wydanie dla Austrii), (PDF; 185 kB) .
linki internetowe
- Podaż jodu w Niemczech ponownie spada - Wskazówki dotyczące dobrej podaży jodu - Pytania i odpowiedzi Federalnego Instytutu Oceny Ryzyka (BfR)
Indywidualne dowody
- ↑ Harry H. Binder: Leksykon pierwiastków chemicznych. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3 .
- ↑ Wartości dla właściwości (pole informacyjne) są pobierane z www.webelements.com (jod) , chyba że zaznaczono inaczej .
- ↑ CIAAW, Standardowe Wagi Atomowe Zaktualizowane 2013 .
- ↑ b c d e f g wejście na jod w Kramida, A. Ralchenko Yu, Czytnik J. i NIST ASD zespołu (2019). NIST atomowej Widma bazy danych (wersja 5.7.1.) . Wyd.: NIST , Gaithersburg, MD. doi : 10.18434 / T4W30F ( https://physics.nist.gov/asd ). Źródło 11 czerwca 2020 r.
- ↑ b c d e f g wejście na jod w WebElements, https://www.webelements.com , dostępnym w dniu 11 czerwca 2020 roku.
- ↑ Robert C. Weast (red.): CRC Handbook of Chemistry and Physics . CRC (Chemical Rubber Publishing Company), Boca Raton 1990, ISBN 0-8493-0470-9 , s. E-129 do E-145. Wartości tam podane są w g/mol i podane w jednostkach cgs. Podana tutaj wartość to obliczona z niej wartość SI, bez jednostki miary.
- ↑ a b Yiming Zhang, Julian RG Evans, Shoufeng Yang: Poprawione wartości punktów wrzenia i entalpii parowania pierwiastków w podręcznikach. W: Journal of Chemical & Engineering Data . 56, 2011, s. 328-337, doi: 10.1021/je1011086 .
- ↑ b c d e f wejście na jod w bazie substancji GESTIS o w IFA , dostępnym w dniu 12 kwietnia 2020 r. (wymagany JavaScript)
- ↑ Wpis na jod w wykazie klasyfikacji i oznakowania w Europejskiej Agencji Chemikaliów (ECHA), dostępne w dniu 1 sierpnia 2016. Producenci i dystrybutorzy mogą rozwinąć się zharmonizowanej klasyfikacji i oznakowania .
- ↑ Swiss Accident Insurance Fund (Suva): Wartości limitów - aktualne wartości MAK i BAT (szukaj 7553-56-2 lub jod ), dostęp 2 listopada 2015 r.
- ^ Theodor CH Cole: Słownik chemii / Słownik chemii. Springer-Verlag, 2018, ISBN 978-3-662-56331-1 , s. 314.
- ^ Eduard Reich: Podręcznik chemii dla studentów i lekarzy ogólnych. Tom 1, 1858.
- ↑ Duden, Ortografia niemiecka. Wydanie 24. 2006.
- ↑ Ilość iupac.org
- ↑ Wolfgang Liebscher: Nomenklatura chemii nieorganicznej. John Wiley & Sons, 2009, ISBN 978-3-527-62545-1 , S. XXV ( ograniczony podgląd w wyszukiwarce książek Google)
- ↑ Podaż jodu w Niemczech ponownie spada – Wskazówki dotyczące dobrej podaży jodu – BfR. W: bfr.bund.de. Federalny Instytut Oceny Ryzyka , 20 lutego 2020, dostęp 7 czerwca 2020 .
- ^ L. Pearce-Williams: André-Marie Ampère . W: Charles Coulston Gillispie (red.): Słownik biografii naukowej . taśma 1 : Pierre Abailard-LS Berg . Synowie Charlesa Scribnera, Nowy Jork 1970, s. 139–147 (Ampère podejrzewał również nowy pierwiastek podobny do chloru).
- ↑ Europejski Atlas FOREGS, 2005 (Forum Dyrektorów Europejskich Służb Geologicznych, tekst / PDF , mapa ; PDF; 446 kB).
- ^ V. Truesdale, A. Bale, E. Woodward: południkowa dystrybucja rozpuszczonego jodu w wodach przypowierzchniowych Oceanu Atlantyckiego. W: Postępy Oceanografii . 45 (3), 2000, s. 387-400, doi: 10.1016 / S0079-6611 (00) 00009-4 .
- ↑ A. Butz i in.: Ograniczenia dotyczące nieorganicznego gazowego jodu w tropikalnej górnej troposferze i stratosferze wywnioskowane z obserwacji zasłaniania Słońca na balonach. W: Chemia i Fizyka Atmosfery . 9 (18), 2009, s. 7229-7242, (PDF) .
- ↑ K. Seitz i in.: Przestrzenne rozmieszczenie reaktywnych form jodu IO z jednoczesnych aktywnych i pasywnych obserwacji DOAS. W: Chemia i Fizyka Atmosfery . 10 (5), 2010, s. 2117-2128, (PDF) .
- ^ Katie A. Read et al.: Rozległe niszczenie ozonu za pośrednictwem halogenów nad tropikalnym Oceanem Atlantyckim. W: Przyroda . 453 (7199), 2008, s. 1232-1235, doi: 10.1038 / nature07035 .
- ^ AF Holleman , E. Wiberg , N. Wiberg : Podręcznik chemii nieorganicznej . Wydanie 102. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1 , s. 440-442.
- ↑ Deutscher Verband Tiernahrung : Czy do paszy dodaje się jod, a jeśli tak, to dlaczego? Odwiedzino 12 maja 2015 r.
- ↑ M. Thamm, U. Ellert, W. Thierfelder, K.-P. Liesenkötter, H. Völzke: Zaopatrzenie w jod w Niemczech. Wyniki monitorowania jodu w badaniu zdrowia dzieci i młodzieży (KiGGS) . W: Bundesgesundheitsbl - Badania zdrowia - Ochrona zdrowia . taśma 50 , 2007, s. 744-749 , doi : 10.1007 / s00103-007-0236-4 , PMID 17514459 ( rki.de [PDF; dostęp 27 października 2011]).
- ^ B Hans-Christian Pape, Armin Kurtz, Stefan Silbernagl: fizjologii . Wydanie siódme. Georg Thieme Verlag, Stuttgart 2014, ISBN 978-3-13-796007-2 , s. 620 .
- ↑ Rowa Yousef Alhabbab: test radioimmunologiczny (RIA) . W: Podstawowe badania serologiczne (= Techniki w naukach przyrodniczych i biomedycynie dla osób niebędących ekspertami ). Springer International Publishing, Cham 2018, ISBN 978-3-319-77694-1 , s. 77-81 , doi : 10.1007/978-3-319-77694-1_11 .
- ↑ Wymieniany jest zapas tabletek jodowych - komunikat prasowy BMUB. W: bmub.bund.de. 19 maja 2004, dostęp 5 listopada 2017 .
- ↑ Rozszerza się dystrybucję tabletek jodowych jako środka ostrożności na wypadek awarii elektrowni jądrowej. W: kan.admin. 22 stycznia 2014, dostęp 5 listopada 2017 .
- ↑ Roland Gärtner: Czy jod jest ważny w profilaktyce i leczeniu uzupełniającym raka piersi? W: Niemieckie czasopismo onkologiczne . 41 (2), 2009, s. 53-56, doi: 10.1055 / s-0029-1213543 .
- ↑ Ingeborg Börglein: jod przeciw rakowi piersi. W: Gazeta lekarzy . 24 marca 2012 r.
- ↑ B. Welz, M. Sperling: Spektrometria absorpcji atomowej. Wydanie IV. Wiley-VCH, Weinheim 1997, ISBN 3-527-60320-4 .
- ↑ E. Vtorushina, A. Saprykin, G. Knapp: Optymalizacja warunków wytwarzania par utleniających do oznaczania chloru, bromu i jodu w roztworach wodnych metodą spektrometrii emisyjnej z plazmą sprzężoną indukcyjnie. W: Journal of Analytical Chemistry . 63 (7), 2008, s. 643-648, doi: 10.1134 / S1061934808070071 .
- ↑ J. Chai, Y. Muramatsu: Oznaczanie bromu i jodu w dwudziestu trzech referencyjnych geochemicznych materiałach referencyjnych metodą ICP-MS. W: Geostandardy i badania geoanalityczne . 31 (2), 2007, s. 143-150, doi: 10.1111 / j.1751-908X.2007.00856.x .
- ↑ B. Michalke, H. Witte: Charakterystyka szybkiej i niezawodnej metody biomonitoringu jodku w surowicy i moczu opartej na chromatografii jonowej-ICP-spektrometrii masowej. W: J Trace Elem Med Biol . 29 stycznia 2015 r., s. 63-68, PMID 24933092 .
- ↑ L. Liang, Y. Cai, Sz. Mou, J. Cheng: Porównanie jednorazowej i konwencjonalnej srebrnej elektrody roboczej do oznaczania jodku przy użyciu wysokosprawnej chromatografii anionowymiennej z pulsacyjną detekcją amperometryczną. W: Journal of Chromatography A . 1085, 2005, s. 37-41, doi: 10.1016 / j.chroma.2004.12.060 , PMID 16106845 .
- ↑ L. Valentin-Blasini, B. Blount, A. Delinsky: Oznaczenie ilościowe inhibitorów symportera jodku i jodku sodu w ludzkim moczu za pomocą tandemowej spektrometrii masowej chromatografii jonowej. W: Journal of Chromatography A . 1155, 2007, s. 40-46, doi: 10.1016 / j.chroma.2007.04.014 , PMID 17466997 .
- ^ R. Moxon, E. Dixon: Półautomatyczna metoda oznaczania całkowitego jodu w żywności. W: Analityk . 105, 1980, s. 344-352, doi: 10.1039 / AN9800500344 , PMID 7406209 .
- ↑ I. Svancara, J. Konvalina, K. Schachl, K. Kalcher, K. Vytras: Stripping woltamperometryczny z akumulacją jodku na elektrodzie z pastą węglową. W: Elektroanaliza . 10 (6), 1998, str. 435-441, doi : 10.1002/(SICI) 1521-4109 (199805) 10:6<435::AID-ELAN435>3.0.CO;2-J .
- ^ BJ Allan, JMC Plane, G. McFiggans: Obserwacje OIO w odległej morskiej warstwie granicznej. W: Listy z badań geofizycznych . 28 (10), 2001, s. 1945-1948, doi: 10.1029 / 2000GL012468 .
- ^ AF Holleman , E. Wiberg , N. Wiberg : Podręcznik chemii nieorganicznej . Wydanie 102. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1 , s. 488-489.
- ↑ Manuela Martino i in.: Nowe źródło lotnych związków jodoorganicznych w powierzchniowej wodzie morskiej. W: Listy z badań geofizycznych . 36 (1), 2009, doi: 10.1029 / 2008GL036334 .