selen
| nieruchomości | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ogólnie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nazwa , symbol , liczba atomowa | Selen, Se, 34 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kategoria elementu | Półmetale | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupa , kropka , blok | 16 , 4 , s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wygląd zewnętrzny | szary, błyszczący | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| numer CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numer WE | 231-957-4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Karta informacyjna ECHA | 100.029.052 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ułamek masowy powłoki Ziemi | Częstotliwość 0,8 ppm # 59 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomowy | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atomowa | 78 971 (8) i in | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Promień atomowy (obliczony) | 115 (103) po południu | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Promień kowalencyjny | 120 po południu | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Promień Van der Waalsa | 190 po południu | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Konfiguracja elektronów | [ Ar ] 3 d 10 4 s 2 4 p 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Energia jonizacji | 9.752 392 (15) eV ≈ 940.96 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Energia jonizacji | 21.196 (10) eV ≈ 2 045.1 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Energia jonizacji | 31.697 (19) eV ≈ 3 058.3 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Energia jonizacji | 42.947 (3) eV ≈ 4 143.8 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Energia jonizacji | 68.30 (10) eV ≈ 6 589.9 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6. Energia jonizacji | 81.83 (3) eV ≈ 7 895 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fizycznie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Stan fizyczny | naprawiony | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| gęstość | czarny w 60 ° C: 4,28 g / cm 3 szarości w temperaturze 25 ° C: 4.819 g / cm 3 czerwone w temperaturze 25 ° C: 4,48 g / cm 3 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Twardość Mohsa | 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| magnetyzm | diamagnetyczny ( Χ m = -1,9 10 -5 ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Temperatura topnienia | 494 K (221°C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| temperatura wrzenia | 958,2 K (685 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Objętość molowa | 16,42 · 10 −6 m 3 · mol −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ciepło parowania | 95,5 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ciepło stapiania | 5,4 kJ mol- 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Prędkość dźwięku | 3350 m s -1 w 293,15 K. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Funkcja pracy | 5,9 eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Przewodność cieplna | 0,52 W · m- 1 K- 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemicznie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Stany utleniania | ± 2, 4 , 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Potencjał normalny | -0,67 V (Se + 2 e - → Se 2- ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektroujemność | 2,55 ( skala Paulinga ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Izotopy | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dla innych izotopów zobacz listę izotopów | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Właściwości NMR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| instrukcje bezpieczeństwa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
W miarę możliwości i zwyczajowo stosowane są jednostki SI . O ile nie zaznaczono inaczej, podane dane dotyczą warunków standardowych . | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Selen ( zeˈleːn , gr. σελήνη [selḗnē], „ księżyc ”) to pierwiastek chemiczny o symbolu pierwiastka Se i liczbie atomowej 34. W układzie okresowym jest w 4 okresie i 6 grupie głównej , czyli 16 grupie IUPAC i jest jednym z chalcogenów .
Selen jest niemetalem, jego właściwości są zbliżone do właściwości siarki i telluru. Tworzy kilka modyfikacji polimorficznych i alotropowych , z których najbardziej stabilna jest szara, metalopodobna forma. Najczęściej występuje w rudach siarczkowych metali, gdzie częściowo zastępuje siarkę, rzadko w postaci elementarnej lub jako czysty związek rudy. Szwedzki lekarz i chemik Jöns Jacob Berzelius odkrył selen w 1817 roku. Selen jest pozyskiwany komercyjnie przy przetwarzaniu rud metali. Technicznie wykorzystywana jest do produkcji szkła , do pigmentów i fotokomórek . Kiedyś był używany do produkcji elementów elektronicznych.
Selen jest niezbędnym dla człowieka pierwiastkiem śladowym i między innymi składnikiem enzymu antyoksydacyjnego, peroksydazy glutationowej . Margines pomiędzy niedożywieniem a poziomem toksycznym w spożyciu selenu jest bardzo mały, co wymaga starannej kontroli spożycia. Zarówno pierwiastkowy selen jak i sole selenu mogą być toksyczne nawet w małych dawkach i powodować selenozy .
fabuła

Selen został odkryty w 1817 roku przez Jönsa Jakoba Berzeliusa w szlamie z komory ołowiowej jego fabryki kwasu siarkowego w pobliżu Gripsholm . Zastosowany tam piryt z kopalni Falun utworzył w komorach ołowianych czerwony osad, który początkowo zakładał Berzeliusz jako związek arsenu . Jednak po spaleniu osad wytworzył wyraźny zapach rzodkiewki , który nie jest typowy dla arszeniku, ale charakterystyczny dla telluru , którego nazwa pochodzi od łacińskiego tellusu „ziemia” , do którego selen ma pewne podobieństwa.
W liście do Aleksandra Marceta Berzelius wspomniał, że znalazł związek telluru. Jednak brak związków telluru w minerałach kopalni Falun skłonił Berzeliusa do ponownej analizy czerwonego osadu. W 1818 roku, w ramach swoich eksperymentów, Berzelius w końcu doszedł do wniosku, że jest to nowy pierwiastek. Napisał kolejny list do Marceta, w którym opisał nowo znaleziony pierwiastek, podobny do siarki i telluru. Aby wskazać na podobieństwo do telluru, nazwał je selenem, na cześć greckiej bogini księżyca Selene .
W 1873 roku Willoughby Smith odkrył, że opór elektryczny szarego selenu jest związany z ekspozycją. Pozwala to na wykorzystanie selenu w fotokomórkach . Werner von Siemens opracował pierwsze komercyjne fotokomórki zawierające selen w połowie lat 70. XIX w . Ich przewodność w świetle słonecznym była 14,8 razy większa niż bez oświetlenia. Alexander Graham Bell opracował tak zwany fotofon w 1878 roku . Światło padło na lustro, które wibrowało megafonem . Wibracje megafonu przekazywane były przez lustro, światło przesyłane było do układu odbiorczego, który składał się z fotoelementu, baterii i telefonu. Mimo że był to pierwszy bezprzewodowy system telefoniczny, system nie zyskał żadnego znaczenia.
Od 1910 roku August von Wassermann prowadził badania nad chemioterapią raków i mięsaków myszy . Wstrzyknięcie do krwiobiegu niedokładnie określonego składnika eozyny Y i selenu prowadziło początkowo do martwicy komórek nowotworowych, a ostatecznie do wygojenia zaatakowanych narządów. Z drugiej strony próby leczenia nowotworu selenianem sodu u ludzi skutkowały śmiercią z powodu przedawkowania. Badania nad skutecznością selenu w terapii przeciwnowotworowej doznały kolejnego niepowodzenia, gdy w latach trzydziestych XX wieku na Wielkich Równinach doszło do masowego zatrucia owiec i krów tragakantami, kiedy to zmarło około 15 000 owiec zatrutych selenem.
W 1954 r. Jane Pinsent odkryła, że oprócz śladowych ilości molibdenianów , selen jest również niezbędny do tworzenia dehydrogenazy mrówczanowej w bakteriach z grupy coli . Badania nad selenem nabrały nowego rozmachu, gdy grupa badawcza kierowana przez Klausa Schwarza odkryła w 1957 roku, że selen zapobiega martwiczej degeneracji wątroby i jest niezbędnym pierwiastkiem śladowym.
Występowanie
Ziemskie wydarzenia
Stężenie selenu w glebie mieści się w zakresie od 0,01 do 2,0 miligramów na kilogram ze średnią około 0,4 miligrama na kilogram. Lokalnie występują znacznie wyższe stężenia do 1200 miligramów na kilogram. Oprócz początkowej geologii, naturalne źródła, takie jak erupcje wulkanów lub źródła antropogeniczne, takie jak spalanie węgla, mogą prowadzić do akumulacji selenu.
Zawartość selenu w węglu kamiennym wynosi średnio około 1,6 ppm, w brunatnym około 1 ppm. Stężenie w popiele wzrasta od 6 do 8 razy. Selen występuje w węglach zarówno organicznie jak i nieorganicznie, na przykład jako selenek w postaci Clausthalite. Część z nich jest w postaci wymywalnego selenianu, a część jest izomorficzna, zastępująca siarkę w pirycie.
Zawartość selenu w troposferze szacuje się na około 13 do 19 000 ton. Około 60% z nich pochodzi ze źródeł naturalnych, takich jak biosfera morska, a największym źródłem antropogenicznym jest spalanie węgla . Wydaje się, że emisje mają głównie charakter gazowy.
Jako niezbędny pierwiastek śladowy, selen wchodzi w skład 21. biogennego aminokwasu selenocysteiny . Selenocysteina jest specyficznym składnikiem katalitycznym enzymów zależnych od selenu . W drożdżach i roślinach selen występuje głównie w postaci selenometioniny . Selenometionina zamiast metioniny włączana niespecyficznie do wielu białek bez żadnej funkcji; jest postrzegany jako forma przechowywania selenu. Inne naturalnie występujące związki organiczne selenu to selenek dimetylu i selenocysteina metylu .
Ilość selenu w pożywieniu w dużym stopniu zależy od zawartości selenu w glebie. Gleby ubogie w selen w Europie występują zwłaszcza w Niemczech, Szkocji, Danii, Finlandii, w części krajów bałkańskich iw Szwajcarii. Na niektórych obszarach ubogich w selen do gleby dodaje się nawozy zawierające selenian, na przykład w Finlandii od 1984 r. W glebach bogatych w selen tragakant , kapustnik lub czosnek gromadzą selen w postaci metyloselenocysteiny . Sucha substancja Astragalus Bisulcatus zawiera do 0,65% selenu. Dobrze znanym źródłem selenu wśród produktów spożywczych jest orzech brazylijski . Zawartość selenu w jednym orzechu brazylijskim wynosi około 50 mikrogramów selenu.
Zdarzenia pozaziemskie
Stężenie selenu w bazaltach księżycowych w przybliżeniu odpowiada wartościom ziemskim, ale skład izotopowy jest przesunięty w kierunku cięższych izotopów selenu. Selen wśród innych elementów została odkryta w najbliższej ultrafioletowym widma gwiazd ubogich w metale HD 108317 i HD 128279 korzystając z Goddard High Resolution spektrograf o tym Kosmicznego Teleskopu Hubble'a . Selen, związany głównie z siarką, został wykryty w meteorytach .
Selen jako minerał
Naturalne występowanie selenu w postaci pierwiastkowej znane było jeszcze przed założeniem Międzynarodowego Stowarzyszenia Mineralogicznego (IMA). Dlatego selen jest uznawany za minerał chroniony , tzw. praojcowski , jako samodzielny rodzaj minerału. Selen rodzimy został po raz pierwszy odkryty i opisany w 1934 roku przez Charlesa Palache'a . Typu stanowisko jest Wielka Verde Mine niedaleko Jerome w amerykańskim stanie Arizona.
Według systematyki minerałów według Strunza (wydanie IX) selen znajduje się pod numerem systemu 1.CC.10 (pierwiastki - półmetale (metaloidy) i niemetale - siarka-selen-jod - grupa selenowa) lub Wydanie 8 pod I/B.03 (grupa siarkowo-selenowa). Systematyka minerałów według Dany , stosowana głównie w krajach anglojęzycznych , wymienia pierwiastek mineralny w systemie nr. 01.03.04.01 (elementy - półmetale i niemetale).
Selen jako minerał rzadko tworzy dobre kryształy , które mogą wówczas mieć wielkość do dwóch centymetrów. Ich habitus jest zwykle w kształcie igły do rurkowatego i czasami pusty. Często kryształy tworzą również grupy liściaste lub matowe maty. Jako metal selen jest zwykle nieprzezroczysty ( nieprzezroczysty ), ale może być przezroczysty w przypadku bardzo cienkich drzazg. Selen czysty jest rzadko spotykany. W 2021 r. na całym świecie udokumentowano tylko około 160 przypadków rodzimego selenu.
Minerały, takie jak selen Clausthalite ( ołowiu selenu , PbSe) i naumannite ( selenu srebra Ag 2 Se) jest również rzadkością. Dwie odmiany selenku żelaza dzharkenit i ferroselit (FeSe 2 ) mają najwyższą zawartość selenu, każda z prawie 74% Se . W 2021 roku, w zależności od źródła, od 127 do 270 minerałów zawierało selen.
Gleby często zawierają selen w formach rozpuszczalnych, takich jak seleniany , które łatwo się wypłukują. Woda morska zawiera znaczne ilości selenu.
Selen w piaskowcu z kopalni uranu w pobliżu Grants , Nowy Meksyk
Ciemnoszare błyszczące kryształy selenu w matrycy ze stosu odpadów przeróbczych Lichtenberg, Ronneburg (Turyngia) , pole widzenia 5 mm
Clausthalite z kopalni Brummerjan, Zorge (Walkenried) , Dolna Saksonia, Niemcy (pole widzenia 1,5 cm)
Ferroselite z El Quemado, General Lamadrid Department , La Rioja , Argentyna
Ekstrakcja i prezentacja
Selen pierwiastkowy
Selen występuje głównie w postaci selenków metali , jako towarzysz rud metali zawierających siarkę , miedzi , ołowiu , cynku , złota i żelaza . W przemyśle selen jest otrzymywany jako produkt uboczny w elektrolitycznej produkcji miedzi i niklu ze szlamu anodowego przez prażenie. Podczas prażenia z rudy , firma zbiera selen dwutlenku w wylotowej płuczki. Wchłonięty również dwutlenek siarki zamienia się w zredukowany metaliczny selen i powstaje kwas siarkowy.
Osadzony selen odsączono, a następnie oczyszczono metodą destylacji próżniowej w około 280°C pod próżnią.
W skali laboratoryjnej selen może być wytwarzany w reakcji kwasu selenowego z jodowodórem .
Całkowita produkcja znanych krajów producenckich wyniosła w 2020 roku 2900 ton, cena w tym samym roku wynosiła około 44 USD za kilogram. Zasoby szacowane są na około 100 tys. ton. Wydobycie selenu z popiołów lotnych z węgla jest technicznie możliwe, ale nie jest przeprowadzane ze względu na wysokie koszty. Niewielka część pozyskiwanego selenu pochodzi z recyklingu elementów elektronicznych i kserokopiarek.
Selenometionina
W żywności suplementów i żywieniu zwierząt (zatwierdzone w żywieniu zwierząt w Unii Europejskiej od maja 2005), organiczne źródło selenu był używany przez kilka lat, który jest otrzymywany poprzez hodowlę niektórych drożdży piwowarskich z Saccharomyces cerevisiae typu ( Sel-Plex , Lalmin TM ) na pożywce bogatej w selen ( melasa i selenian sodu ). Drożdże syntetyzują wysoki poziom selenometioniny jako aminokwasu, a tym samym wiążą do 2000 ppm selenu w sposób organiczny. Największy zakład do produkcji takich naturalnych drożdży selenowych został zbudowany w 2004 roku w São Pedro w brazylijskim stanie Paraná .
nieruchomości
Właściwości fizyczne
Selen występuje w postaci krystalicznej w jednej szarej, trzech czerwonych i jednej czarnej modyfikacji alotropowej ; trzy czerwone krystaliczne modyfikacje są polimorficzne . Ponadto występuje w postaci czarnego selenu w fazie amorficznej, która przy wzroście temperatury do ok. 80 °C przechodzi w czarną, szklistą fazę, która również powstaje po schłodzeniu selenu do temperatury pokojowej. Czarny selen to kruche, błyszczące ciało stałe, które jest słabo rozpuszczalne w dwusiarczku węgla. Ta faza staje się plastyczna w temperaturach powyżej 50°C. Można zsyntetyzować fazy z pierścieniami sześcio- i siedmioczłonowymi. Nie są one jednak trwałe i szybko przechodzą w inne kształty.
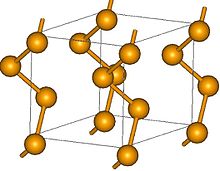
W normalnych warunkach stabilna jest tylko szara modyfikacja, pozostałe są metastabilne i z czasem przekształcają się w szary selen. Ma heksagonalną sieć krystaliczną i zachowuje się jak półmetal, który wykazuje właściwości półprzewodnikowe . Składa się ze spiralnie ułożonych łańcuchów z potrójną osią ślimaka o kątach Se – Se 103°. W krysztale łańcuchy mają jednolity kierunek wkręcania. Monokryształy szarego selenu są więc optycznie aktywne i tworzą enancjomery . W przeciwieństwie do innych alotropów jest nierozpuszczalny w dwusiarczku węgla . Szary selen jest słabym przewodnikiem elektryczności, a zanieczyszczenie halogenkami lub ekspozycja na światło zwiększa przewodność .
Dwie z czerwonych modyfikacji krystalizują monoklinicznie . Nazywane są α- i β-selenem i różnią się długością osi. Wytwarza się je z czarnego selenu poprzez ekstrakcję dwusiarczkiem węgla. Dwie fazy można wytworzyć w specyficzny sposób, zmieniając szybkość parowania rozpuszczalnika. Postać znana jako γ-selen, otrzymywana przez krystalizację z roztworu dipiperydynotetraselanu w dwusiarczku węgla, krystalizuje również monoklinicznie, w grupie przestrzennej P 2 1 / c . Rozpuszczalny w dwusiarczku węgla czerwony selen składa się w około 30% z sfałdowanych pierścieni Se 8 i 70% z Se 8 + n , który pod ciśnieniem, w temperaturze powyżej 120°C lub w obecności katalizatora przekształca się w szary selen . W pierścieniach Se 8 odległość Se-Se wynosi 233,5 pikometra, a kąt Se-Se-Se wynosi 105,7°. Bezpostaciowa modyfikacja koloru czerwonego powstaje przez schłodzenie stopionego selenu. Izolatorem jest czerwony pierwiastek selenu.
Powyżej temperatury topnienia 220 ° C selen tworzy czarną ciecz. Para selenu wytwarzana przy dalszym wzroście temperatury jest żółta. Gdy osadza się z fazy gazowej na chłodniejszej powierzchni, osadza się w postaci sześciokątnych, metalicznie szarych igieł kryształowych.
Ekspozycja na światło zmienia jego przewodność elektryczną. Pasmo wzbronione selenu wynosi około 1,74 elektronowoltach , na granicy między światłem widzialnym i podczerwieni. Dodatkowo wykazuje efekt fotowoltaiczny . Przewodnictwo nie jest spowodowane przez elektrony w paśmie przewodnictwa , ale przez przewodzenie dziur (patrz pod przewodnictwem elektrycznym i defektem elektronu ), czyli dodatnio naładowanymi defektami elektronowymi , co między innymi powoduje, że znak efektu Halla jest ujemny. Jako mechanizm przewodnictwa tej dziury proponuje się tzw .
Właściwości chemiczne
Selen jest bardzo podobny do siarki pod względem właściwości chemicznych i zachowania. Można to wytłumaczyć podobnymi promieniami kowalencyjnymi i podobną elektroujemnością tych dwóch pierwiastków. Promień kowalencyjny siarki wynosi 103 pikometry , a selenu 117 pikometrów. Elektroujemność siarki w skali Allreda-Rochowa wynosi 2,4, a selenu 2,5.
Selen ma konfigurację elektronów walencyjnych 3 d 10 4 s 2 4 p x 2 p y 1 p z 1 . Osiąga konfigurację gazu szlachetnego poprzez dwa wiązania kowalencyjne lub akceptację dwóch elektronów . Selen tworzy selenek wodoru (H 2 Se) z wodorem powyżej 400 ° C. Tworzy selenki z metalami , np. selenkiem sodu (Na 2 Se), który można uznać za sole selenku wodoru.
Po podgrzaniu w powietrzu selen spala się niebieskim płomieniem, tworząc dwutlenek selenu SeO 2 .
Zachowanie chemiczne jest podobne do siarki, ale selen jest trudniejszy do utlenienia. W reakcji z kwasem azotowym powstaje kwas selenowy, związek selenu(IV).
Reakcja ze związkami Grignarda R – Mg – Hal prowadzi do powstania związków organoselenowych R-Se-Mg-Hal, z których drogą hydrolizy mogą być wytwarzane selenole R – Se – H.
Izotopy
Selen ma wiele izotopów . Z siedmiu naturalnie występujących izotopów pięć jest stabilnych. Procentowa częstość stabilnych izotopów rozkłada się następująco: 74 Se (0,9%), 76 Se (9,0%), 77 Se (7,6%), 78 Se (23,6%) i 80 Se (49, 7%). 79 Se z okresem półtrwania 327 000 lat jest składnikiem rud uranu w niewielkich ilościach. Jest produkowany z rozszczepieniem uranu z częstotliwością 0,04% i znajduje się również w wypalonym paliwie jądrowym. 82 Se jako izotop promieniotwórczy ma jeden z najdłuższych ze wszystkich okresów półtrwania wynoszący około 10-20 lat i rozpada się do 82 Kr poprzez podwójny rozpad beta.W praktyce można go uznać za stabilny, jego częstotliwość wynosi 9,2%.
Ponadto znanych jest 21 innych izotopów promieniotwórczych, wśród których szczególne znaczenie ma 75 Se o okresie półtrwania wynoszącym 120 dni. 75 Se służy do budowy specjalnych źródeł promieniowania gamma do badań nieniszczących szwów spawalniczych. 75 , jest stosowana w medycynie nuklearnej w połączeniu z metioninę jako znacznika do oceny funkcji trzustki i kwasu homotaurocholic (SeHCAT) W celu oceny resorpcji z kwasów żółciowych .
posługiwać się
Selen jest niezbędny dla wszystkich form życia. Związki selenu są zatem oferowane jako suplementy diety i przetwarzane na dodatki do pasz i nawozów. W przemyśle szklarskim służy do odbarwiania zielonych szkieł, a także do produkcji szkieł w kolorze czerwonym.
Zastosowania techniczne
| rok | Produkcja szkła |
Chemikalia i pigmenty |
Aplikacje elektroniczne |
Zastosowania metalurgiczne |
inne aplikacje |
|---|---|---|---|---|---|
| 1970 | 30% | 14% | 37% | 0% | 19% |
| 1980 | 30% | 25% | 35% | 0% | 10% |
| 1990 | 25% | 20% | 35% | 0% | 20% |
| 2000 | 25% | 22% | 10% | 24% | 19% |
- Bębny obrazowe do kserokopiarek i drukarek laserowych
- Produkcja półprzewodników
- Dodatek lateksu w celu zwiększenia odporności na ścieranie
- Toner do zdjęć czarno-białych w celu zwiększenia kontrastu (jasne odcienie pozostają niezmienione, uzyskuje się ciemniejsze czernie, ciemne części wydają się bardziej trójwymiarowe), zwiększenie trwałości (nie jest wyraźnie udowodnione) i jasne zabarwienie ciemnych elementów obrazu na kolor bakłażana (również dla zwiększenia plastyczności)
- do produkcji czerwonych pigmentów i kropek kwantowych na bazie selenku kadmu (CdSe)
- Dodatek stopowy poprawiający skrawalność mechaniczną stali automatowych i stopów miedzi
- Stosowany w prostowniku selenowym i ogniwie selenowym , ale dziś w dużej mierze zastąpiony krzemem ( półprzewodniki ).
- do brązowienia aluminium, mosiądzu itp. (Dwutlenek selenu)
- z miedzianą i indową częścią warstwy fotoaktywnej ogniw słonecznych CIGS
- w analogowych światłomierzach do fotografii
- Jako selenek cynku jest używany do wytwarzania powierzchni o wysokim współczynniku odbicia optycznie, ale jest przezroczysty w zakresie podczerwieni i jest tu używany do produkcji okien i soczewek ogniskujących np. dla laserów CO 2
- W procesie elektrolizy manganu zużywane są większe ilości dwutlenku selenu. Dodatek dwutlenku selenu zmniejsza zużycie energii podczas elektrolizy. Na tonę manganu zużywa się do 2 kg dwutlenku selenu.
Zastosowanie medyczne
W przypadku niedoboru selenu, którego nie można zrekompensować dietą, na przykład w przypadku zaburzeń trawienia i trawienia, lub w przypadku niedożywienia lub niedożywienia, selen podaje się w postaci seleninu sodu .
W przeciwłupieżowych szamponach do włosów stosuje się dwusiarczek selenu w stężeniach do 1% i leczniczo w stężeniach np. 2,5% w profilaktyce i leczeniu łupieżu pstrego , choroby skóry wywołanej przez drożdżaki. Szampony przeciwłupieżowe zawierające selen nadają się również do leczenia świądu u koni.
Znaczenie biologiczne
Selen jest niezbędnym pierwiastkiem śladowym dla ludzi i zwierząt. Zawarta jest w selenocysteinie , aminokwasie w centrum aktywnym enzymu peroksydazy glutationowej i wielu innych selenoproteinach . Selenocysteina jest również znana jako 21. aminokwas i jest włączana poprzez własne tRNA podczas syntezy białek . Enzym peroksydazy glutationowej (GSHPx) zawierający selen, który występuje we wszystkich komórkach zwierzęcych, odgrywa decydującą rolę w rozkładzie utleniaczy uszkadzających błony i produktów rodnikowych. Służy do ochrony błon komórkowych przed oksydacyjnym zniszczeniem przez nadtlenki , które powstają podczas normalnego metabolizmu lipidów . Należą do nich komórkowa lub klasyczna peroksydaza glutationowa 1 (GSHPx-1), która działa w cytozolu i macierzy mitochondrialnej oraz GSHPx-2 przewodu pokarmowego, działająca w błonie śluzowej jelit. Zewnątrzkomórkowa osoczu peroksydazy glutationowej (GSHPx-3), a akt w GSHPx-4 fosfolipidów błon lipidowych lub białka strukturalnego ogona elementu plemników. Wiele zespołów niedoboru selenu można wyjaśnić obniżoną aktywnością peroksydazy glutationowej. W ludzkim proteomie znanych jest około 25 selenoprotein. Selen odgrywa ważną rolę w produkcji hormonów tarczycy, a dokładniej w „aktywacji” tyroksyny (T4) do trójjodotyroniny (T3). Wchodzi w skład enzymu tyroksyny 5′-dejodynazy , który odpowiada za usuwanie atomu jodu z T4. Ta dejodyzacja tworzy T3. Niedobór selenu prowadzi do niedoboru 5′-dejodazy tyroksyny, co oznacza, że tylko część dostępnej T4 może zostać odjodowana. Ponieważ T3 jest znacznie bardziej efektywny w metabolizmie, niedobór T3 powoduje niedoczynność tarczycy ( niedoczynność tarczycy ).
Reduktaza tioredoksynowa (TrxR), która redukuje tioredoksynę , która jest ważna dla wzrostu komórek , ale także wiele innych nisko- i wysokocząsteczkowych substratów. 5'-dejodynazy jodotyroniny (jodynazy hormonów tarczycy; ID-I, ID-II, ID-III) katalizują syntezę hormonów tarczycy .
Selenoproteiny ze zmodyfikowanym aminokwasem selenocysteiną w centrum, w tym białka selenu H, I, K, M, N, O i P, służą jako białka transportujące selen między komórkami organizmu; R, reduktaza sulfotlenku metioniny oraz S, T, V i W występują w mięśniach. Syntetaza selenofosforanowa 2 katalizuje syntezę monoselenofosforanu, prekursora selenocysteiny.
Selen jest wysoce toksyczny w wyższych stężeniach, przy czym zakres pomiędzy stężeniami powodującymi objawy niedoboru a stężeniami toksycznymi jest bardzo mały. Ponadto toksyczność selenu zależy od wiązania chemicznego.
Wzbogacanie selenu w łańcuchu pokarmowym
Glony i mikroorganizmy w środowisku wodnym mogą wchłaniać selen z wody i wzbogacać go o miliony w stężeniu wodnym. W zależności od zawartości gleby rośliny włączają selen niespecyficznie w aminokwasy zamiast siarki, zwłaszcza w selenometioninę i w mniejszym stopniu selenocysteinę lub jej pochodne, takie jak metyloselenocysteina . Tylko tzw. „rośliny zbierające selen” (rośliny akumulatorowe selenu, np. rajski orzech ), które występują na terenach bogatych w selen o suchym klimacie , przechowują również selen jako organicznie związane, rozpuszczalne w wodzie sole selenu lub selenu. Wielkość spożycia zależy od biodostępności selenu. Wysokie proporcje organiczne adsorbują selen i redukują go tak, że jest unieruchomiony i nie może być przyswajany przez rośliny. Gleby o stężeniu mniejszym niż 0,1 części na milion (ppm) uważane są za ubogie w selen, a gleby bogate w selen o stężeniu selenu większym niż 0,5 ppm.
Spożycie selenu
W oparciu o wysycenie selenoproteiny P selenem, zalecana dawka dobowa w Niemczech, Austrii i Szwajcarii została ustalona na 70 mikrogramów dziennie dla mężczyzny, 60 mikrogramów dziennie dla kobiet i 75 mikrogramów dziennie dla kobiet karmiących piersią. Szacuje się, że zapotrzebowanie na dzieci i młodzież jest mniejsze w zależności od wieku. Komitet Naukowy ds Żywności Komisji Europejskiej przedstawionej w 1993 roku ustalono wartość referencyjną 55 mikrogramów selenu dziennie dla dorosłych. Według oceny komisji, całkowite dzienne spożycie nie powinno przekraczać 300 mikrogramów dziennie. Niemiecki Federalny Instytut Oceny Ryzyka (BfR) zaleca ograniczenie dziennej dawki suplementów diety do 45 mikrogramów. Amerykańskie Narodowe Instytuty Zdrowia zalecają 55 mikrogramów selenu dziennie jako normalną dawkę dla dorosłych i 400 mikrogramów dziennie jako górną granicę tolerancji, przy której nie oczekuje się żadnych negatywnych skutków dla zdrowia. Selen jest dodawany do pasz dla bydła mlecznego, ponieważ naturalna zawartość selenu w paszy jest często niewystarczająca do żywienia zwierząt gospodarskich.
Aspekty medyczne
European Food Safety Authority (EFSA) znalazła wystarczających dowodów naukowych, że selen przyczynia się do prawidłowego spermatogenezy , utrzymanie włosów i paznokci, normalnej funkcji układu odpornościowego i ochronie komórek przed stresem oksydacyjnym , jak i normalnego funkcjonowania tarczycy .
Publikacja czasopisma Pharmaceutical Information w czerwcu 2005 omawiała dodatkowy dar selenu, pomijający postulowaną użyteczność w różnych chorobach: Żadne z dostępnych badań nie dostarczyło dowodów na korzyści z selenu w jakimkolwiek kontekście. Chociaż pozytywny wpływ na różne typy nowotworów wydaje się możliwy, z drugiej strony faworyzowanie innych nowotworów nie jest mało prawdopodobne. Taki związek jest dyskutowany w przypadku chorób układu krążenia. Eksperymentalne nadciśnienie u szczurów można znacznie zmniejszyć przez profilaktyczne podawanie selenu. Interesujące w tym kontekście jest ochronne działanie selenu w kriokonserwacji fragmentów mięśnia sercowego.
The ( „studiować ochronne działanie selenu i witaminy E na raka” SELECT „badanie zainicjowane Sel enium i witamina E C ancer Zapobieganie T rial”) został odwołany w 2008 roku przed planowanym końcem, jako świadczenie już wyłączone w momencie mógł . Różne randomizowane, kontrolowane badania nie wykazały pozytywnego wpływu podawania preparatów selenowych na zmniejszenie ryzyka raka przy wysokim dowodach . Powtarzające się badania na przestrzeni kilku lat wykazały częściowo odwrotną, częściowo brak, a częściowo bezpośrednią zależność między ekspozycją na selen a ryzykiem raka, ale w żadnym z badań nie było wskazań na związek między dawką a efektem . Nie jest jasne, czy selen może zmienić ryzyko zachorowania na raka u osób o określonym podłożu genetycznym lub stanie odżywienia, a także możliwe działanie różnych form selenu. Badania nad wpływem selenu na łagodzenie skutków ubocznych chemioterapii i radioterapii również nie dały podstaw do zalecenia za lub przeciw suplementacji selenem. W tych badaniach, stężenie selenu mierzona zarówno w osoczu krwi , w osoczu krwi lub w paznokcie . Oznaczanie zawartości selenu w paznokciach stóp podlega mniejszym wahaniom niż w surowicy lub osoczu, dlatego wartości te są zwykle bardziej znaczące.
Podobnie przebiegały badania nad wpływem suplementów diety zawierających selen na rozwój chorób układu krążenia u zdrowych osób dorosłych, które były już odpowiednio zaopatrywane w selen z normalnej diety. Nie zaobserwowano żadnych zalet ani wad, nie można było zapobiec chorobom sercowo-naczyniowym przez podawanie selenu. W grupie substytucji selenu wystąpiła zwiększona cukrzyca 2 przypadki, ale różnica nie była znacząca. Jednak nasiliło się łysienie i zapalenie skóry . Stała dodatkowa podaż selenu (suplementacja) została powiązana ze szkodliwymi skutkami. Po tym, jak badania z 2007 roku dotyczące suplementacji selenu nieoczekiwanie ujawniły nadmierne ryzyko cukrzycy typu 2 , przeprowadzono szereg innych badań na ten temat. Przegląd systematyczny z 2018 r. wykazał, że selen może zwiększać ryzyko cukrzycy typu 2 w szerokim zakresie ekspozycji, ale ogólnie ryzyko jest niskie.
Choroby niedoboru selenu
Dobrze znane choroby związane z niedoborem selenu to choroba Keshana (kardiomiopatia młodzieńcza), nazwana na cześć północno-wschodniego chińskiego miasta Keshan w dystrykcie Heilongjiang w Mandżurii, oraz choroba Kashin-Becka u ludzi, zwyrodnienie chrząstki stawowej związane z odżywianiem, nazwane na cześć rosyjskich lekarzy wojskowych Nikołaj Iwanowicz Kaszyn (1825–1872) i Jewgienij Władimirowicz Beck (1865–1915). Na Kubie dochodzi do epidemii ludzkiej neuropatii . Niedobór selenu powoduje mutację wirusa grypy A/Bangkok/1/79, który w rezultacie staje się zjadliwy. Selen stosuje się leczniczo ( selenin sodu , doustnie lub pozajelitowo ) w przypadku niedoboru selenu, którego nie można wyrównać dietą, np. w przypadku zaburzeń trawienia i trawienia, lub w przypadku niedożywienia lub niedożywienia .
W weterynarii, jest biały choroby mięśni (odżywcza Myodegeneration (NMD), żywieniowe dystrofia , białaczki dystrofię odżywcza, rabdomiolizę , odżywcze Rhabdomyopathie , myopathic - dyspnoisches syndrom Kälberrheumatismus, Hühnerfleischigkeit, Fischfleischigkeit) znany przeżuwaczy występuje, świnie, indyki i gdzie niedobór selenu jest uważany za (współ)przyczynę. Mioglobinuria porażenna , rabdomioliza wysiłkowa, występuje u bydła przeżuwającego w rejonach świata z niedoborem selenu , zwłaszcza u bydła w wieku 8 miesięcy i starszych.
dowód
Ilościowe oznaczenie śladów (0,003%) selenianu można przeprowadzić elektrochemicznie za pomocą polarografii . W 0,1 molowym roztworze chlorku amonu występuje stopień przy -1,50 V (w porównaniu z SCE ). W zakresie ultra-śladowym można zastosować spektrometrię atomową , z płomieniem AAS 100 μg/l ( ppb ), piecem grafitowym AAS 0,5 i technologią wodorkową, która jest w stanie wykryć 0,01 µg/l selenu.
instrukcje bezpieczeństwa
Selen i związki selenu są trujące. Bezpośredni kontakt uszkadza skórę (pęcherze) i błony śluzowe. Wdychany selen może prowadzić do przewlekłych problemów z płucami.
Zatrucie spowodowane nadmiernym spożyciem selenu znane jest jako selenoza . Pierwszy opis zatrucia selenem, nie znając jego natury, pochodzi od Marco Polo , który podczas przekraczania prowincji Shaanxi zaobserwował, że konie i inne zwierzęta juczne rozszczepiają kopyta po spożyciu niektórych roślin znanych jako akumulatory selenu. Spożycie selenu powyżej 3000 µg dziennie może prowadzić do marskości wątroby , wypadania włosów i niewydolności serca . Zagrożeni są pracownicy z branży elektronicznej, szklarskiej i lakierniczej. Według innych źródeł objawy zatrucia takie jak nudności i wymioty, wypadanie włosów, zmiany paznokci, neuropatia obwodowa i wyczerpanie występują już od 400 µg/d .
Związki selenu
W związkach, selen występuje najczęściej w reakcji utleniania stanowi -II ( selenowodór , selenków ) i + IV (czterohalogenki, dwutlenek selenu i selenianów (IV) , Selenici nieaktualna ). W jonach selenku selen występuje z niecałkowito ujemnymi stopniami utlenienia. Mniej powszechne dodatnie stopnie utlenienia to + I (halogenki Se 2 X 2 ) i + VI ( heksafluorek selenu , kwas selenowy ). Związki selenu o stopniu utlenienia + VI są silniejszymi utleniaczami niż analogiczne związki siarki i telluru. Mieszaniny stężonego kwasu selenowego (VI) z kwasem solnym rozpuszczają metale takie jak złoto i platyna.
Związki wodoru
Selenowodór (H 2 Se) to bezbarwny, bardzo trujący gaz, który powstaje w reakcji selenków (M x Se y ) z mocnymi kwasami, np. kwasem solnym (HCl). Z pierwiastków wodór i selen związek można przedstawić jako związek silnie endotermiczny w temperaturach powyżej 350 ° C. Selenowodór powoli rozkłada się na pierwiastki w temperaturze pokojowej, rozkład jest przyspieszany pod wpływem światła. Wodny roztwór ( kwas selenowy ) jest słabo kwaśny; kwas siła K y = 1,88 x 10 -4 jest tego samego rzędu wielkości jak w kwasie azotowym (HNO 2 ).
Selenidy
W przypadku większości metali selen tworzy binarne selenki zawierające anion selenowy Se 2- . Ponadto znane są Diselenide Se 2 2- i Polyselenide Se n m- , które można otrzymać w reakcji metalu z nadmiarem selenu:
Synteza jest możliwa przez stopienie elementów razem lub w roztworze. Selenki są wrażliwe na hydrolizę i utlenianie. Oprócz selenków jonowych znany jest związek cząsteczkowy diselenek węgla , Se = C = Se.
- Przykłady poliselenów
Wodorek sodu redukuje elementarny selen do diselenku sodu (Na 2 Se 2 ).
Związki tlenu i interchalkogeny
Dwutlenek selenu ( selenu (IV) ) jest bezbarwny, krystaliczne ciało stałe, które można otrzymać w wyniku spalania selenu w powietrzu. W wodzie tworzy kwas selenowy H 2 SeO 3 . Jest stosunkowo silnym utleniaczem i łatwo ulega redukcji do selenu.
Selen trójtlenek ( selen (VI), tlenek ) może być otrzymany przez odwodnienie kwas selenowy , H- 2 SeO 4 . Jest także krystalicznym ciałem stałym i silnym środkiem utleniającym.
Istnieją również stałe, krystaliczne, wielowartościowe tlenki selenu (IV, VI) Se 2 O 5 i Se 3 O 7 .
Tlenek selenu, SeO, jest znany tylko jako niestabilny produkt pośredni.
Siarczek selenu SeS ≈2 (niestechiometryczny związek selenowo-siarkowy, który składa się z siarkopodobnych cyklicznych cząsteczek o zmiennej wielkości i składzie, nazywany również dwusiarczkiem selenu ze względu na przybliżony stosunek SeS 2 ).
Seleniany to sole kwasu selenowego z anionami SeO 4 2− . Ortoseleniany, takie jak trygonalny dwupiramidowy anion SeO 5 4− i oktaedryczny SeO 6 6−, są rzadko obserwowane.
Halogenki selenu
Sześciofluorek selenu można przedstawić w reakcji selenu z pierwiastkowym fluorem. Chociaż jest bardziej reaktywny niż sześciofluorek siarki , w normalnych warunkach nie reaguje z wodą.
Najważniejszymi halogenkami selenu są tetrahalogenki, tetrajodek selenu nie mógł zostać zsyntetyzowany. Tetrahalogenki można przedstawić z elementów. Mogą reagować jako zasady Lewisa z wytworzeniem: SeX 3 + oraz kwasów Lewisa (powstanie SeX 6 2- ). Dihalogenki i monohalogenki znane ze wszystkich halogenów są nietrwałe.
Organiczne związki selenu
Organiczne związki selenu występują głównie na stopniach utlenienia <II, II i IV. Organiczne związki selenu zasadniczo obejmują następujące grupy substancji;
- Selan (selenki organiczne) RSeR, takie jak selenek dimetylu
- Diselane ( diselenek ) RSeSeR
- Triselan (triselenid) RSeSeSeR
- Selenole RSeH
- Selenenyle RSeX
- Tlenki selenu R-Se (= O) -R
- Selenon R 2 SeO 2
- Selone R 2 C = Se, selenowe analogi ketonów
Polikationy selenu
Ostrożnie utleniający selen, liczne selenu polikationy Se n x + mogą być przygotowane i krystalizuje z odpowiednim przeciwjonem. Przeciwjon musi być słabą zasadą Lewisa, ponieważ polikationami selenu są stosunkowo silne kwasy Lewisa. Odpowiednimi utleniaczami są często halogenki metali przejściowych, które dają pożądany związek bezpośrednio w temperaturach typowo 200°C:
Często krystalizacja przebiega pomyślnie w warunkach transportu chemicznego , ale czasami trzeba stosować rozpuszczalniki bezwodne, takie jak chlorek cyny (IV) lub tetrabromek krzemu .
Jeżeli halogenek metalu nie jest odpowiednim środkiem utleniającym, jak to często ma miejsce w przypadku halogenków pierwiastków z grupy głównej, odpowiednie tetrahalogenki telluru można stosować jako środki utleniające:
Zmieniając przeciwjon i środowisko reakcji, można wytworzyć wiele różnych polikationów; mieszane polikationy selenowo-tellurowe są dostępne przez odpowiedni dobór reagentów syntezy.
- Przykłady polikationów selenu
literatura
- AF Holleman , N. Wiberg : Chemia nieorganiczna . Wydanie 103. Tom 1: Podstawy i główne elementy grupy. Walter de Gruyter, Berlin / Boston 2016, ISBN 978-3-11-049585-0 , s. 693–728 (próbka lektur: Część A - Podstawy chemii wodoru. Google book search ).
- W. Marktl: Fizjologia i fizjologia żywienia selenu. W: Journal for Mineral Metabolism . Tom 8, nr 3, 2001, s. 34-36. (PDF)
- PF Surai: naturalne przeciwutleniacze. Nottingham University Press, 2002, ISBN 1-897676-95-6 .
- Dolph L. Hatfield i wsp. (red.): Selen: jego biologia molekularna i rola w zdrowiu człowieka. 3. Wydanie. Springer, Nowy Jork 2012, ISBN 978-1-4614-1024-9 ( ograniczony podgląd w Google Book Search).
- Gary S. Bañuelos i wsp. (red.): Selen w środowisku i zdrowiu człowieka. CRC Press / Balkema, Leiden 2014, ISBN 978-1-138-00017-9 . ( ograniczony podgląd w wyszukiwarce Google Book)
linki internetowe
- Biuro Suplementów Diety Arkusz informacyjny: Selen
- Selen w medycynie onkologicznej - dokumentacja ( Memento z 28.02.2013 w Internet Archive ) (plik PDF; 901 kB)
- Selen. W: Mineralienatlas Lexikon. Stefan Schorn i in., Dostęp 10 sierpnia 2021 r .
- Wyniki wyszukiwania selenu. W: ruff.info. Baza danych spektroskopii ramanowskiej, dyfrakcji rentgenowskiej i chemii minerałów (RRUFF), dostęp 10 sierpnia 2021 r .
- Amerykańska-Mineralog-Baza Danych-Struktur-Kryształów - Selen. W: ruff.geo.arizona.edu. Dostęp 10 sierpnia 2021 r .
Indywidualne dowody
- ↑ Harry H. Binder: Leksykon pierwiastków chemicznych. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3 .
- ↑ Wartości dla właściwości (pole informacyjne) są pobierane z www.webelements.com (selen) , chyba że zaznaczono inaczej .
- ^ IUPAC, Standardowe Wagi Atomowe Zmienione 2013 .
- ↑ a b c d e f Wpis na temat selenu w Kramidzie, A., Ralchenko, Yu., Reader, J. i NIST ASD Team (2019): NIST Atomic Spectra Database (wersja 5.7.1) . Wyd.: NIST , Gaithersburg, MD. doi : 10.18434 / T4W30F ( https://physics.nist.gov/asd ). Źródło 11 czerwca 2020 r.
- ↑ a b c d e f Wpis na temat selenu w WebElements, https://www.webelements.com , dostęp 11 czerwca 2020 r.
- ↑ Robert C. Weast (red.): CRC Handbook of Chemistry and Physics . CRC (Chemical Rubber Publishing Company), Boca Raton 1990, ISBN 0-8493-0470-9 , s. E-129 do E-145. Wartości tam podane są w g/mol i podane w jednostkach cgs. Podana tutaj wartość to obliczona z niej wartość SI, bez jednostki miary.
- ↑ a b Yiming Zhang, Julian RG Evans, Shoufeng Yang: Poprawione wartości punktów wrzenia i entalpii parowania pierwiastków w podręcznikach. W: Journal of Chemical & Engineering Data . 56, 2011, s. 328-337, doi: 10.1021/je1011086 .
- ↑ Ludwig Bergmann, Clemens Schaefer, Rainer Kassing: Podręcznik fizyki doświadczalnej . Tom 6: ciała stałe. Wydanie II. Walter de Gruyter, 2005, ISBN 3-11-017485-5 , s. 361.
- ↑ b Wejście na selenu w bazie substancji GESTIS z tej IFA , dostępnym w dniu 30 kwietnia 2017 r. (wymagany JavaScript)
- ↑ Wpis na Selen w wykazie klasyfikacji i oznakowania w Europejskiej Agencji Chemikaliów (ECHA), dostępne w dniu 1 sierpnia 2016. Producenci i dystrybutorzy mogą rozwinąć się zharmonizowanej klasyfikacji i oznakowania .
- ↑ a b c Jan Trofast: Odkrycie selenu Berzeliusa. W: Chemistry International , 33 maja 2011.
- ^ William Grylls Adams, Richard Evan Dzień: IX. Działanie światła na selen. W: Philosophical Transactions of the Royal Society of London . 167, 1877, s. 313-349, doi: 10.1098/rstl.1877.0009 .
- ^ Engen Obach: Badania nad selenem. W: Journal of the Society of Telegraph Engineers . 6.20, 1877, s. 498-506.
- ↑ ME Levinshtein, GS Simin: Najwcześniejsze urządzenie półprzewodnikowe. Poznawanie półprzewodników. World Scientific, Singapur, New Jersey, Londyn, Hongkong, ISBN 978-981-02-3516-1 , s. 77-79.
- ↑ a b Gerhard N. Schrauzer, Peter F. Surai: Selen w żywieniu ludzi i zwierząt: problemy rozwiązane i nierozwiązane. Częściowo historyczny traktat upamiętniający pięćdziesiątą rocznicę odkrycia biologicznej istotności selenu, poświęcony pamięci Klausa Schwarza (1914–1978) z okazji trzydziestej rocznicy jego śmierci. W: Krytyczne recenzje w biotechnologii . 29, 2009, s. 2-9, doi: 10.1080 / 07388550902728261 .
- ^ A. Wassermann, Franz Keysser, Michael Wassermann: Wkład w problem: Wpływanie na nowotwory terapeutycznie z krwiobiegu. W: DMW - Niemiecki Tygodnik Medyczny . 37, 1911, s. 2389-2391, doi: 10.1055/s-0028-1131175 .
- ↑ Arthur Galston: Zielona mądrość. Ślepi zataczający się. Basic Books, Inc. 1981. ISBN 978-0465027125 , s. 57.
- ↑ Jane Pinsent: Potrzeba seleninu i molibdenianu w tworzeniu dehydrogenazy mrówkowej przez członków grupy bakterii Coli-aerogenes. W: Czasopismo Biochemiczne . 57, 1954, s. 10-16, doi: 10.1042/bj0570010 .
- ^ Klaus Schwarz, Calvin M. Foltz: Selen jako integralna część czynnika 3 przeciwko martwiczym zwyrodnieniom wątroby. W: Journal of the American Chemical Society . 79, 1957, s. 3292-3293, doi: 10.1021/ja01569a087 .
- ↑ Susan J. Fairweather-Tait: Selen w zdrowiu i chorobie człowieka. W: Antioxidants & Redox Signaling , 14, 2011, s. 1337-1387, doi: 10.1089 / ars.2010.3275 .
- ↑ Tak . E. Judowicz, poseł Ketris: Selen w węglu: przegląd. W: International Journal of Coal Geology . 67, 2006, s. 112-126, doi: 10.1016 / j.coal.2005.09.003 .
- ^ Byard W. Mosher, Robert A. Duce: globalny budżet atmosferyczny selenu. W: Journal of Geophysical Research . 92, 1987, s. 13289-13298, doi: 10.1029 / JD092iD11p13289 .
- ↑ Monitoruj poziom selenu. W: schweizerbauer.ch . 22 listopada 2018 . Źródło 22 listopada 2018 .
- ^ Selen w medycynie środowiskowej. W: Federalna Gazeta Zdrowia - Badania Zdrowotne - Ochrona Zdrowia. 49, 2006, s. 88, doi: 10.1007 / s00103-005-1185-4 .
- ↑ Christine D. Thomson, Alexandra Chisholm, Sarah K. McLachlan, Jennifer M. Campbell: Orzechy brazylijskie: skuteczny sposób na poprawę stanu selenu. W: The American Journal of Clinical Nutrition . 87, 2008, s. 379-384, doi: 10.1093/ajcn/87.2.379 .
- ↑ Hauke Vollstaedt, Klaus Mezger, Ingo Leya: Skład izotopów selenu skał księżycowych: Implikacje dla powstania Księżyca i jego lotnej utraty. W: Listy o Ziemi i Naukach Planetarnych . 542, 2020, S 116289, doi: 10.1016 / j.epsl.2020.116289 .
- ^ Ian U. Roederer i in.: Nowe odkrycia arsenu, selenu i innych ciężkich pierwiastków w dwóch ubogich w metale gwiazdach. W: Czasopismo Astrofizyczne . 791, 2014, s. 32-44, doi: 10.1088/0004-637X/791/1/32 .
- ↑ G. Dreibus, H. Palme, B. Spettel, J. Zipfel, H. Wanke: Siarka i selen w meteorytach chondrytowych. W: Meteoritics , 30, 1995, s. 439-445, doi: 10.1111 / j.1945-5100.1995.tb01150.x .
- ↑ Malcolm Back, William D. Birch, Michel Blondieau i inni: Nowa lista minerałów IMA – praca w toku – aktualizacja: lipiec 2021. (PDF; 3,52 MB) In: cnmnc.main.jp. IMA / CNMNC, Marco Pasero, lipiec 2021, dostęp 10 sierpnia 2021 .
- ^ Charles Palache : Wkład do krystalografii: Claudetite; minasgraryt; samsonit; natywny selen; ind . W: Amerykański Mineralog . taśma 19 , 1934, s. 194-205 (angielski, rruff.info [PDF; 599 kB ; udostępniono 10 sierpnia 2021]).
- ↑ Kopalnia Zjednoczonego Zielonego Przylądka. W: Mineralienatlas Lexikon. Stefan Schorn i in., Dostęp 10 sierpnia 2021 r .
- ↑ Ernest H. Nickel , Monte C. Nichols: IMA / CNMNC Lista Minerałów 2009. (PDF; 1,82 MB) W: cnmnc.main.jp. IMA / CNMNC, styczeń 2009, dostęp 11 sierpnia 2021 .
- ↑ David Barthelmy: Minerały uporządkowane według klasyfikacji New Dana - 01.03 Pierwiastki rodzime z elementami półmetalicznymi i niemetalicznymi. W: webmineral.com. Dostęp 11 sierpnia 2021 r .
- ↑ Selen . W: John W. Anthony, Richard A. Bideaux, Kenneth W. Bladh, Monte C. Nichols (red.): Handbook of Mineralogy, Mineralogy Society of America . 2001 (angielski, handbookofmineralogy.org [PDF; 60 kB ; udostępniono 11 sierpnia 2021]).
- ↑ Miejscowości dla selenu. W: mindat.org. Hudson Institute of Mineralogy, dostęp 11 sierpnia 2021 r .
- ^ David Barthelmy: Gatunki mineralne zawierające selen (Se). W: webmineral.com. Dostęp 11 sierpnia 2021 r .
- ^ Szukaj minerałów według chemii - Minerały zawierające Se. W: mindat.org. Hudson Institute of Mineralogy, dostęp 11 sierpnia 2021 r .
- ^ S. Ramachandra Rao: Odzyskiwanie zasobów i recykling z odpadów hutniczych. Elsevier, Oksford, Amsterdam, 2006, ISBN 978-0-08-045131-2 , s. 425.
- ↑ Erwin Riedel , Christoph Janiak : Chemia nieorganiczna . Wydanie ósme. de Gruytera, 2011, ISBN 3-11-022566-2 , s. 458 .
- ↑ a b W. C. Butterman, RD Brown Jr .: Profile surowców mineralnych: selen. USGS, raport z otwartych plików nr 2003-18. 2004.
- ↑ GN Schrauzer: Drożdże selenowe: skład, jakość, analiza i bezpieczeństwo. W: Chemia Czysta i Stosowana . 78, 2006, s. 105-109, doi: 10.1351 / pac200678010105 .
- ↑ Wejście na temat przejścia alotropowego . W: Kompendium terminologii chemicznej IUPAC („Złota Księga”) . doi : 10.1351 / goldbook.A00244 Wersja: 3.0.1.
- ↑ Wpis o przejściu polimorficznym . W: Kompendium terminologii chemicznej IUPAC („Złota Księga”) . doi : 10.1351 / goldbook.P04748 Wersja: 3.0.1.
- ↑ a b c A. F. Holleman , E. Wiberg , N. Wiberg : Podręcznik chemii nieorganicznej . Wydanie 102. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1 , s. 618-646.
- ↑ Peter Paetzold : Chemia – wprowadzenie. Walter de Gruyter, Berlin 2009, ISBN 978-3-11-020268-7 , s. 167.
- ↑ Olav Foss, Vitalijus Janickis: Struktura krystaliczna selenu γ-jednoskośnego. W: J. Chem.Soc ., Dalton Trans., 1980, str. 624-627, doi: 10.1039/DT9800000624 .
- ^ NF Mott: Przewodzenie w materiałach niekrystalicznych. W: Magazyn Filozoficzny . 19, 1969, s. 835-852, doi: 10.1080 / 14786436908216338 .
- ↑ Ralf Steudel : Chemia niemetali: od struktury i spoiwa do zastosowania. Walter de Gruyter, 2008, ISBN 978-3-11-019448-7 , s. 432.
- ↑ webelements.com
- ↑ ptb.de: Okres półtrwania Se-79 .
- ↑ G. Jörg, R. Bühnemann, S. Hollas, N. Kivel, K. Kossert, S. Van Winckel, Ch. Lierse przeciwko. Gostomski: Wytwarzanie radiochemicznie czystego 79 Se i bardzo precyzyjne określenie jego okresu półtrwania. W: Applied Radiation and Isotopes , 68.12, 2010, s. 2339-2351, doi: 10.1016 / j.apradiso.2010.05.006 .
- ↑ Patent DE60033511T2 : Źródło promieniowania gamma. Opublikowane 27 kwietnia 1999 r. , Wynalazca: Mark Golder, Aston Clinton. Patent, źródło promieniowania gamma 75 zawiera Se.
- ↑ Torsten Kuwert, Frank Grünwald , Uwe Haberkorn , Thomas Krause (red.): Medycyna nuklearna. Stuttgart 2008, ISBN 978-3-13-118504-4 .
- ↑ Selen i tellur . W: Rocznik Minerałów 2010 . udostępniono 31 lipca 2021 r.
- ↑ Ben Curnow: Diagnostyka i leczenie swędzącego konia . W: InPractice , 42.1, 2020, s. 47–55, doi: 10.1136 / inp.l6929 .
- ↑ P. Oehme , W. Krause, E. Göres, N. Michael, O. Gomazkov: Selen w medycynie. W: farmakoterapia . nr 11, 1993, s. 355-357.
- ↑ U. Schweizer, AU Bräuer, J. Köhrle, R. Nitsch, NE Savaskan: Selen a funkcja mózgu: słabo rozpoznany związek. W: Badania mózgu . Przeglądy badań mózgu. Tom 45, Numer 3, lipiec 2004, s. 164-178, doi: 10.1016 / j.brainresrev.2004.03.004 . PMID 15210302 (przegląd).
- ↑ D. Behne, A. Kyriakoupoulos, H. Meinhold, J. Köhrle: Identyfikacja 5′-dejodynazy jodotyroniny typu I jako selenoenzymu . W: Biochem. Biofizyka. Rozdz. Nie. 173 , 1990, s. 1143-1149 , PMID 2268318 .
- ^ JR Arthur, F. Nicol, GJ Beckett: Niedobór selenu, metabolizm hormonów tarczycy i dejodynazy hormonów tarczycy . W: Am. J. Żywienie kliniczne . Nie. 57 , 1993, s. 236-239 ( streszczenie ).
- ↑ C. Ekmekcioglu: Pierwiastki śladowe na drodze do XXI wieku - rosnące znaczenie żelaza, miedzi, selenu i cynku . W: Journal of Nutritional Medicine . Nie. 2 (2) , 2000, s. 18–23 ( wydanie PDF dla Austrii).
- ↑ a b L. L. Stillings: Selen . W: KJ Schulz, JH DeYoung Jr., RR Seal II, DC Bradley (red.): Krytyczne zasoby mineralne Stanów Zjednoczonych — geologia gospodarcza i środowiskowa oraz perspektywy przyszłych dostaw. Rozdział Q, 2017, US Geological Survey Professional Paper 1802, s. Q1 - Q55, doi: 10.3133 / pp1802Q , ISSN 2330-7102.
- ↑ a b A. P. Kipp, D. Strohm, R. Brigelius-Flohé, L. Schomburg, A. Bechthold, E. Leschik-Bonnet, H. Heseker: Zmienione wartości referencyjne dla spożycia selenu. W: Czasopismo pierwiastków śladowych w medycynie i biologii : organ Towarzystwa Minerałów i Pierwiastków Śladowych. Tom 32, październik 2015, s. 195-199, doi: 10.1016 / j.jtemb.2015.07.005 . PMID 26302929 .
- ↑ KS Prabhu, XG Lei: Selen. W: Postępy w żywieniu . Tom 7, numer 2, marzec 2016, s. 415-417, doi: 10.3945 / an.115.010785 . PMID 26980826 , PMC 4785479 (darmowy pełny tekst).
- ^ Komitet Naukowy ds. Żywności: Sprawozdania Komitetów Naukowych ds. Żywności. 31. seria, 1993 (PDF)
- ↑ Komitet Naukowy ds. Żywności, Panel Naukowy ds. Produktów Dietetycznych, Żywienia i Alergii: Tolerowane górne poziomy spożycia poszczególnych witamin i minerałów. 2006 (PDF)
- ↑ Anke Weißenborn i in.: Maksymalne ilości witamin i minerałów w suplementach diety. W: Journal of Consumer Protection and Food Safety . 13, 2018, s. 25-39, doi: 10.1007 / s00003-017-1140-y .
- ↑ Selenium - Arkusz informacyjny dla pracowników służby zdrowia , na nih.gov, dostęp 10 sierpnia 2021 r.
- ↑ Europejski Urząd ds. Bezpieczeństwa Żywności: Opinia naukowa. W: Dziennik EFSA . Tom 7, nr 9, 2009, s. 1220 doi: 10.2903 / j.efsa.2009.1220
- ↑ Europejski Urząd ds. Bezpieczeństwa Żywności: Opinia naukowa. W: Dziennik EFSA . Tom 8, nr 10, 2010, s. 1727 doi: 10.2903 / j.efsa.2010.1727
- ↑ Czy istnieją wskazania do podania selenu? W: Informacje o farmacji . Tom 20, nr 2, czerwiec 2005, dostęp 29 maja 2013.
- ↑ W. Krause, P. Oehme: O potencjalnym znaczeniu związków selenu w medycynie. Część I: Selen jako niezbędny pierwiastek śladowy - mechanizmy działania, konsekwencje niedoboru selenu. W: Niemieckie istoty zdrowotne. Tom 34, 1979, s. 1713-1718.
- ↑ W. Krause, P. Oehme: O potencjalnym znaczeniu związków selenu w medycynie. Część II: Niektóre punkty wyjścia do terapeutycznego zastosowania związków selenu. W: Niemieckie istoty zdrowotne . Tom 34, 1979, s. 1769-1773.
- ↑ H. Hilse, P. Oehme, W. Krause, K. Hecht : Wpływ seleninu sodu na doświadczalne nadciśnienie u szczura. W: Acta physiologica et pharmacologica bulgarica . Tom 1, nr 3, 1979, s. 47-50.
- ↑ G. Matthes, HA Hackensellner, KD Wagenbreth, H. Wendtlandt, P. Oehme, KD Jentzsch: Zależność stężenia efektu selenu w kontekście kriokonserwacji fragmentów mięśnia sercowego. W: Prob. Ham. Przekład, t. 7, 1980, s. 174-231.
- ↑ Scott M. Lippman, Eric A. Klein i in.: Wpływ selenu i witaminy E na ryzyko raka prostaty i innych nowotworów. W: JAMA . 301, 2009, s. 39, doi: 10.1001 / jama.2008.864 .
- ↑ Marco Vinceti i in.: Selen w profilaktyce raka. W: Baza danych przeglądów systematycznych Cochrane . , doi: 10.1002 / 14651858.CD005195.pub4 .
- ↑ Gabriele Dennert, Markus Horneber: Selen do łagodzenia skutków ubocznych chemioterapii, radioterapii i operacji u chorych na raka. W: Cochrane Database of Systematic Reviews. 2017, doi: 10.1002 / 14651858.CD005037.pub2 .
- ↑ Reinhard Saller i wsp.: O klinicznym znaczeniu selenu: przegląd systematyczny. W: Swiss Journal for Holistic Medicine , 19 czerwca 2007, s. 333-340.
- ↑ Karen Rees, Louise Hartley, Camilla Day, Nadine Flowers, Aileen Clarke, Saverio Stranges: Suplementacja selenem w pierwotnej prewencji chorób układu krążenia. W: Cochrane Database of Systematic Reviews. 2013, doi: 10.1002/14651858.CD009671.pub2 .
- ^ S. Stranges, JR Marshall, R. Natarajan, RP Donahue, M. Trevisan, GF Combs, FP Cappuccio, A. Ceriello, ME Reid: Wpływ długoterminowej suplementacji selenem na zachorowalność na cukrzycę typu 2: badanie losowe . W: Roczniki Chorób Wewnętrznych . taśma 147 , nie. 4 , 2007, s. 217 .
- ↑ Ekspozycja na selen a ryzyko cukrzycy typu 2: przegląd systematyczny i metaanaliza . W: European Journal of Epidemiology . taśma 33 , nie. 9 , 2018, s. 789-810 . doi: 10.1007 / s10654-018-0422-8
- ↑ G. Schwedt: Chemia analityczna . Thieme Verlag, Stuttgart 1995, s. 197 .
- ^ JE Oldfield: Selen: perspektywa historyczna. W: DL Hatfield, MJ Berry, VN Gladyshev (red.)): Selen. 2006, Springer, Boston, MA., ISBN 978-0-387-33826-2 , s. 1-6.
- ↑ Cornelia A. Schlieper: Selen. W: Cornelia A. Schlieper: Podstawowe zagadnienia żywienia. Wydawnictwo dr. Feliksa Buchnera , 2000, ISBN 3-582-04475-0 .
- ^ Robert M. Russell (za wydanie niemieckie: Hans-Joachim F. Zunft): Witaminy i pierwiastki śladowe - niedobór i nadmiar. W: Manfred Dietel, Joachim Dudenhausen, Norbert Suttorp (red.): Interna Harrisona . Berlin 2003, ISBN 3-936072-10-8 .
- ↑ Alain Krief, Michel Derock: Synteza diselenków i selenków z pierwiastkowego selenu. W: Litery czworościanu . 43, 2002, s. 3083-3086, doi: 10.1016 / S0040-4039 (02) 00277-0 .
- ^ J. Beck: Pierścienie, klatki i łańcuchy - Bogata chemia strukturalna polikationów chalkogenów. W: Przeglądy chemii koordynacyjnej . 163, 1997, s. 55-70, doi: 10.1016 / S0010-8545 (97) 00009-X .
















![{\ displaystyle \ mathrm {17 \ Se \ + \ 2 \, WCl_ {6} \ longrightarrow \ Se_ {17} [WCl_ {6}] _ {2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9d84d24044480db3d71f417b3215a28035951a6e)
![{\ displaystyle \ mathrm {7 \ Se \ + \ SeCl_ {4} \ + \ 8 \ BiCl_ {3} \ longrightarrow \ Se_ {8} [Bi_ {4} Cl_ {14}] _ {2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3cb0faa868c47614d949e63102c492234888d14b)

